Содержание
- 2. Движущая сила реакции – это возможность образования новой более стабильной системы, обладающей минимальной потенциальной энергией. Факторы,
- 3. Химическая реакция характеризуется 2 факторами: Термодинамическим изменением свободной энергии; Кинетическим– скоростью превращения и его механизмом, т.е.
- 4. В соответствии с уравнением Гиббса: ∆Н – изменение энтальпии (разность энергий разрывающихся и вновь образующихся связей);
- 5. Реакционная способность вещества – способность вещества вступать в ту или иную реакцию и реагировать с большей
- 6. Теория переходного состояния При переходе от исх. реагентов к продуктам реагирующая система должна пройти через некоторое
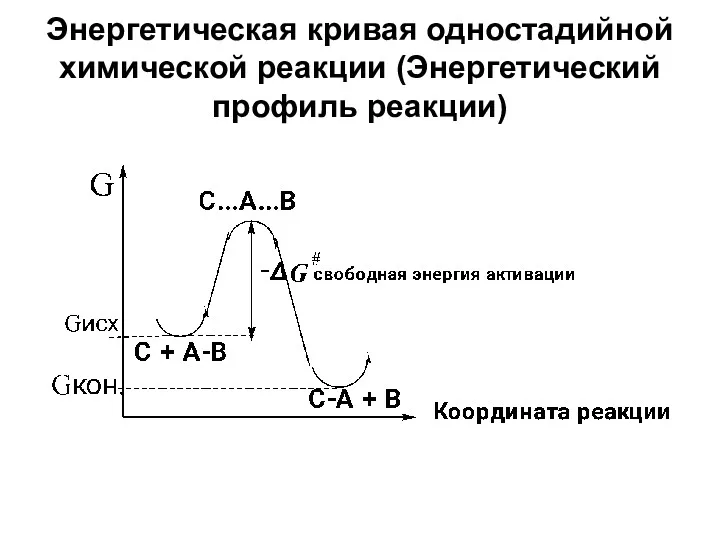
- 7. Энергетическая кривая одностадийной химической реакции (Энергетический профиль реакции)
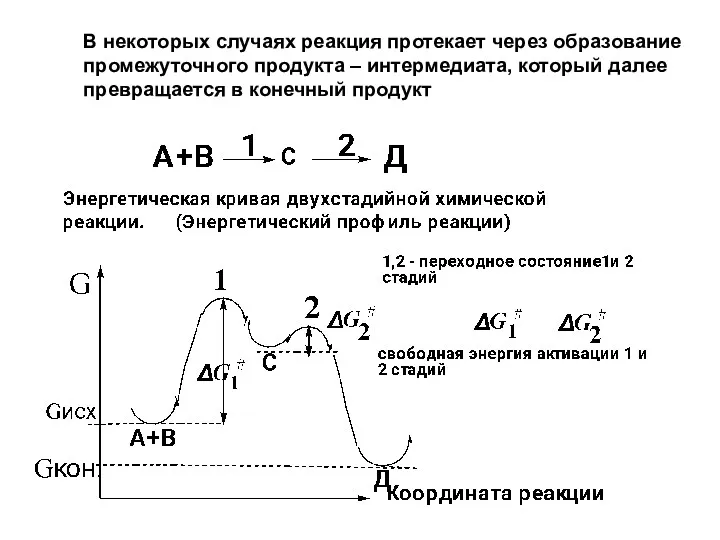
- 8. В некоторых случаях реакция протекает через образование промежуточного продукта – интермедиата, который далее превращается в конечный
- 9. Первая стадия будет скоростьлимитирующей, так как: Скорость химических реакций определяется относительной стабильностью интермедиатов, образующихся в лимитирующей
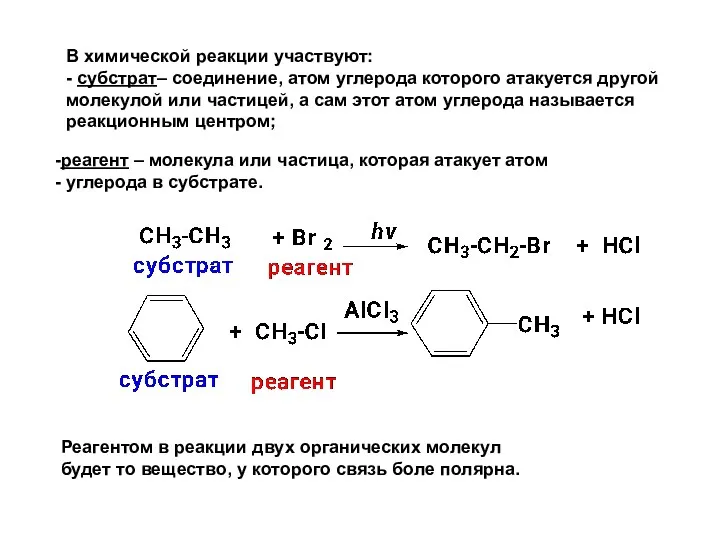
- 10. В химической реакции участвуют: - субстрат– соединение, атом углерода которого атакуется другой молекулой или частицей, а
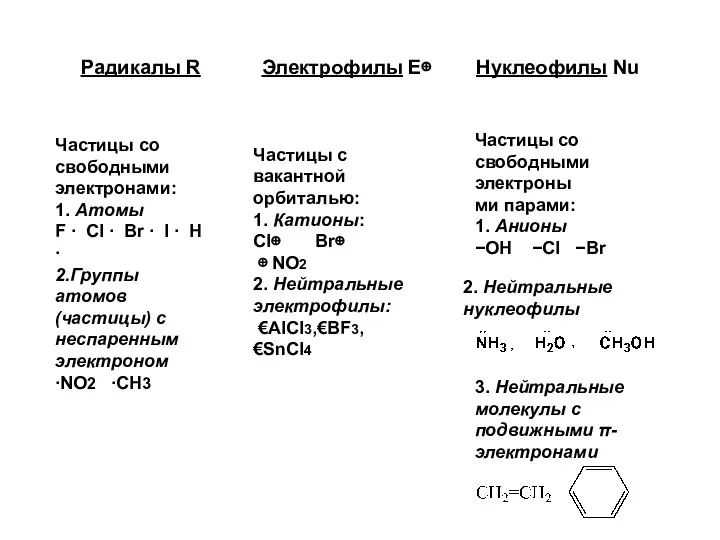
- 11. Типы реагентов Радикальные – свободные атомы или частицы с неспаренным электроном. Электрофильные – частицы, которые принимают
- 12. Радикалы R Электрофилы Е⊕ Нуклеофилы Nu Частицы со свободными электронами: 1. Атомы F ∙ Cl ∙
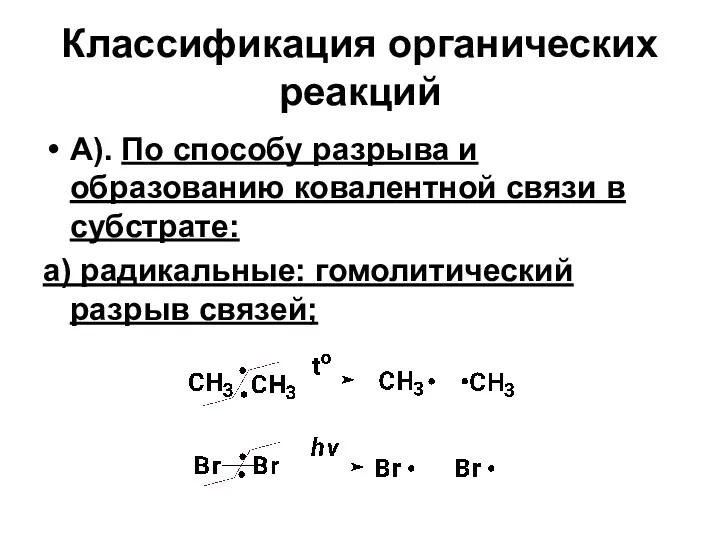
- 13. Классификация органических реакций А). По способу разрыва и образованию ковалентной связи в субстрате: а) радикальные: гомолитический
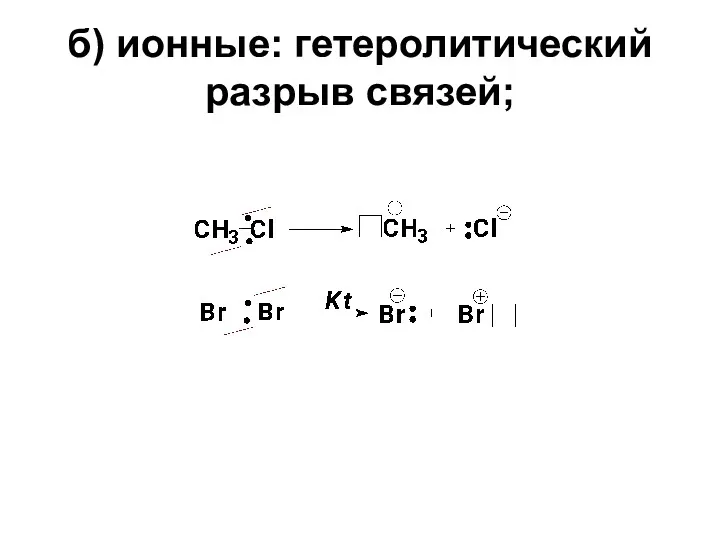
- 14. б) ионные: гетеролитический разрыв связей;
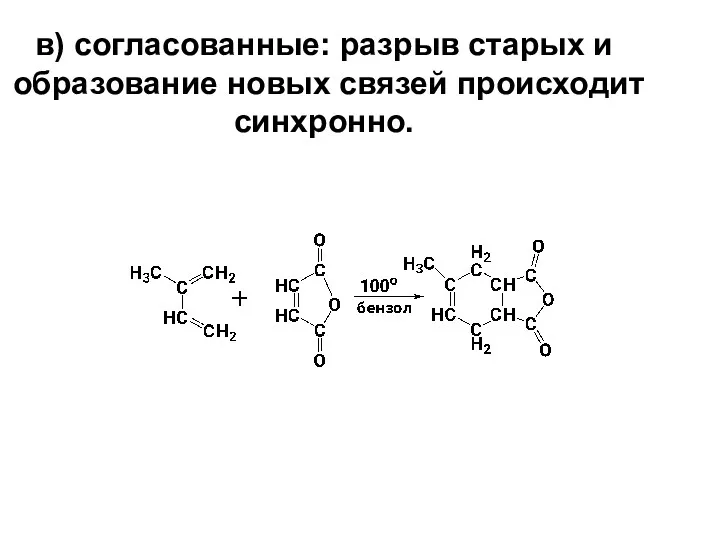
- 15. в) согласованные: разрыв старых и образование новых связей происходит синхронно.
- 16. Б. По направлению реакции, т.е. результат конечного химического превращения: 1). Замещения S – происходит замещения атома
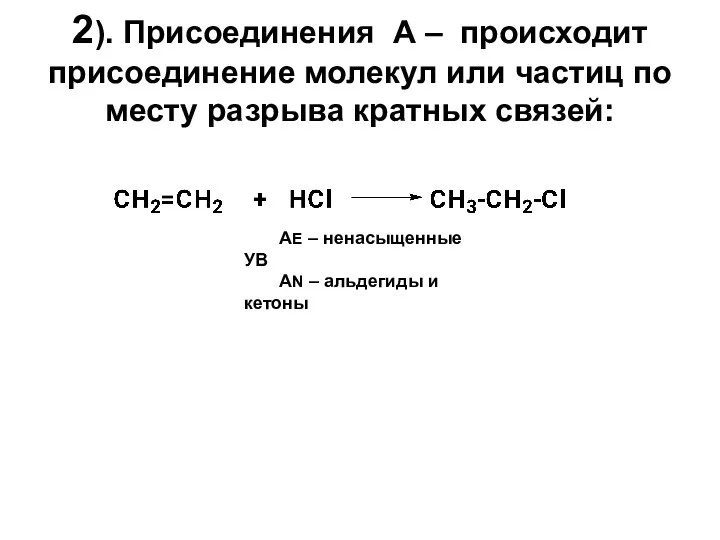
- 17. 2). Присоединения А – происходит присоединение молекул или частиц по месту разрыва кратных связей: АЕ –
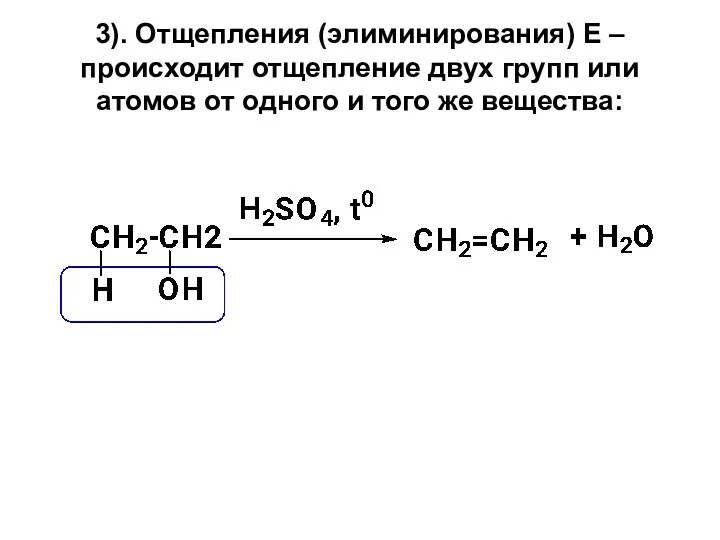
- 18. 3). Отщепления (элиминирования) Е – происходит отщепление двух групп или атомов от одного и того же
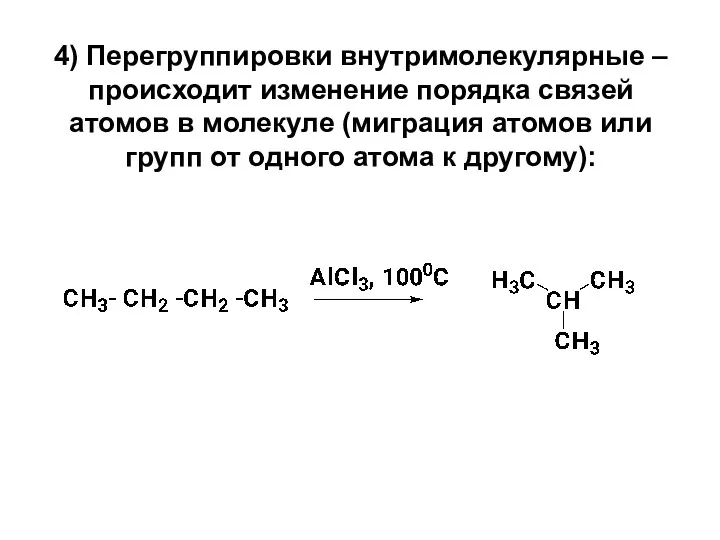
- 19. 4) Перегруппировки внутримолекулярные – происходит изменение порядка связей атомов в молекуле (миграция атомов или групп от
- 20. 5). Окислительно-восстановительные – происходит переход электронов от органического субстрата (восстановителя) к реагенту – окислителю, или наоборот:
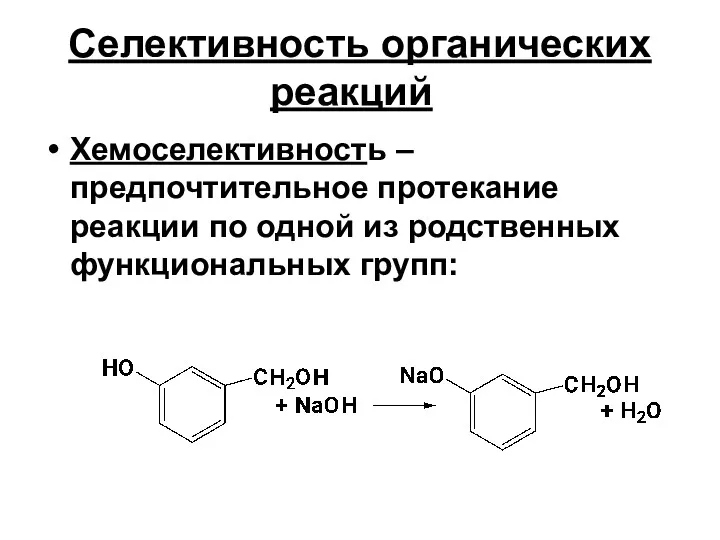
- 21. Селективность органических реакций Хемоселективность – предпочтительное протекание реакции по одной из родственных функциональных групп:
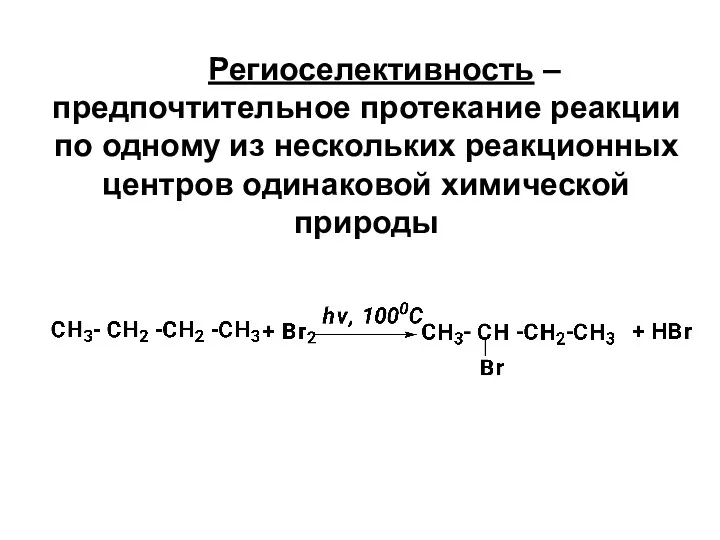
- 22. Региоселективность – предпочтительное протекание реакции по одному из нескольких реакционных центров одинаковой химической природы
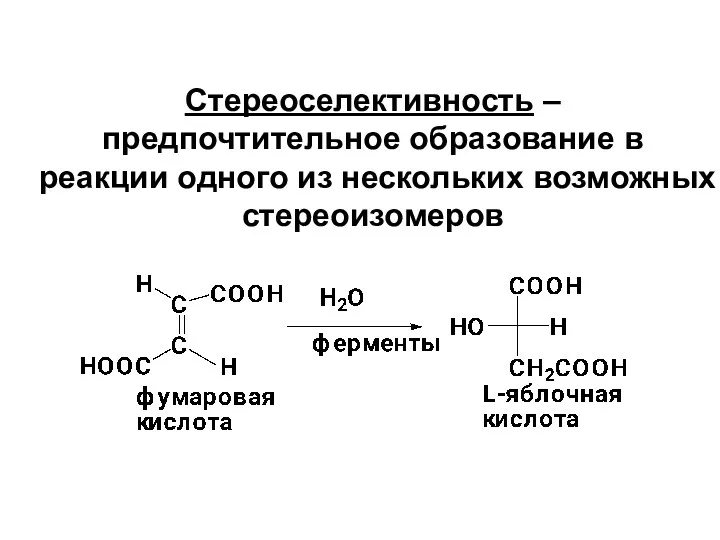
- 23. Стереоселективность – предпочтительное образование в реакции одного из нескольких возможных стереоизомеров
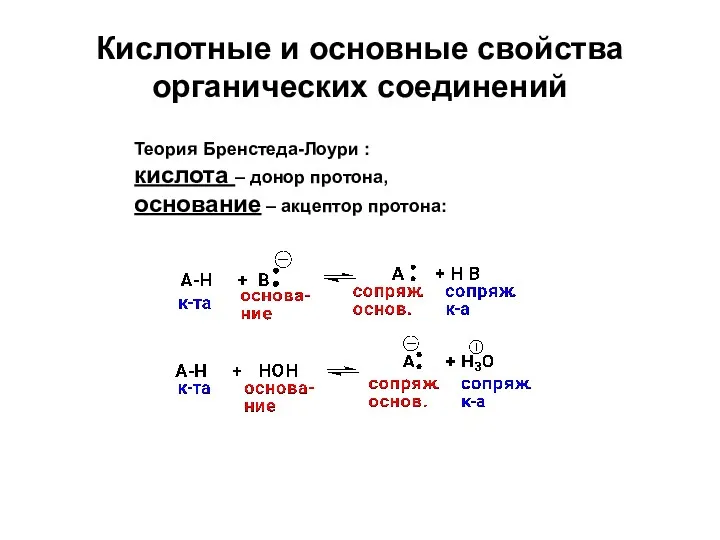
- 24. Кислотные и основные свойства органических соединений Теория Бренстеда-Лоури : кислота – донор протона, основание – акцептор
- 25. Ка –характеризует силу кислоты. Показатель кислотности рКа = – lg Ka. Чем меньше показатель кислотности, тем
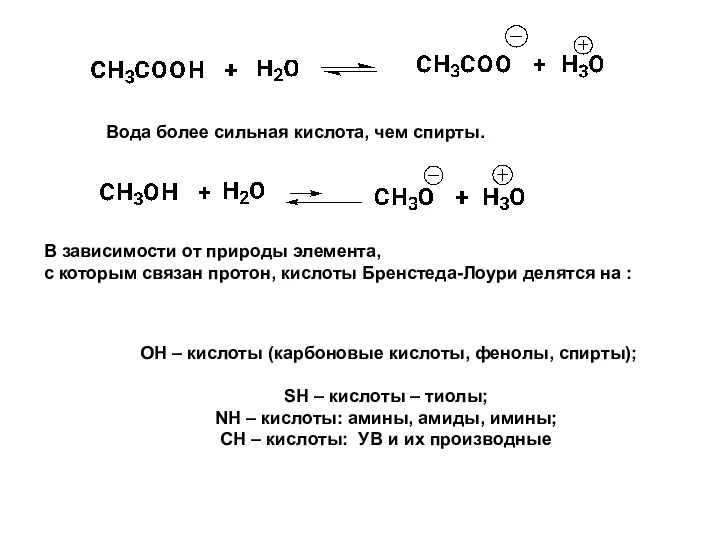
- 26. Вода более сильная кислота, чем спирты. ОН – кислоты (карбоновые кислоты, фенолы, спирты); SН – кислоты
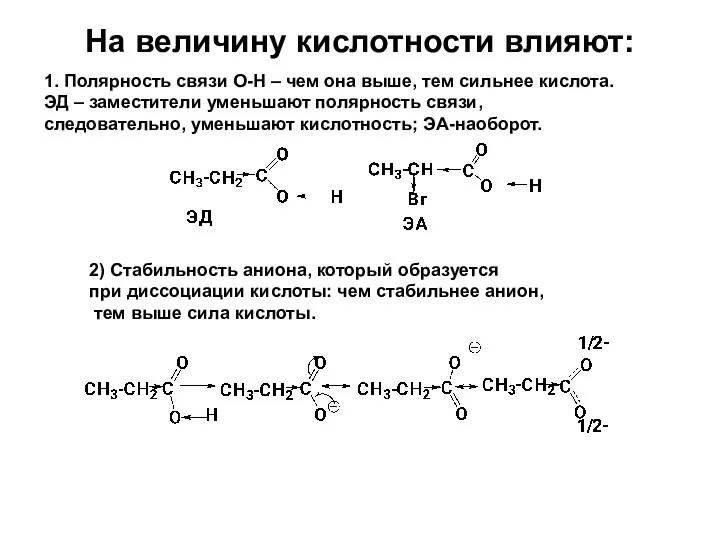
- 27. На величину кислотности влияют: 1. Полярность связи О-Н – чем она выше, тем сильнее кислота. ЭД
- 28. 4) Влияние растворителя: сольватированный растворителем анион будет более стабильным, следовательно сила кислоты будет выше. 3) Тип
- 29. Основания Бренстеда-Лоури: n– основания, которые содержат неподеленную пару электронов: π– основания: алкены, алкины, алкадиены, арены. Для
- 30. Уравнение показывает, что аминосоединения более сильные основания, чем вода.
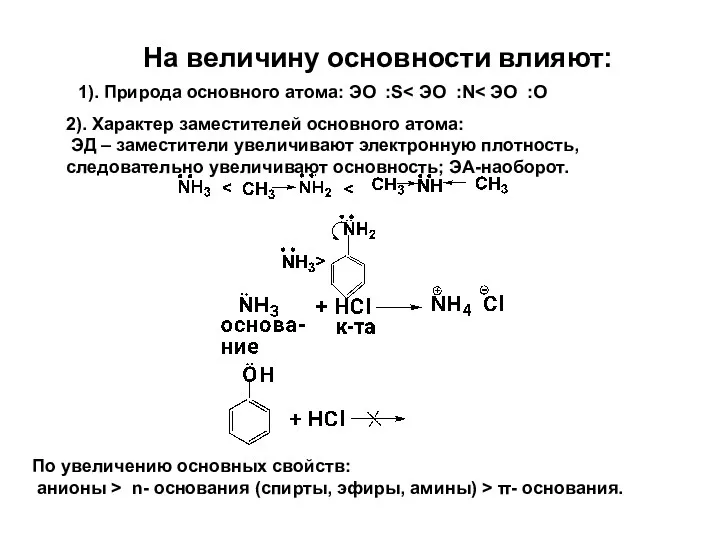
- 31. На величину основности влияют: 1). Природа основного атома: ЭО :S 2). Характер заместителей основного атома: ЭД
- 33. Скачать презентацию













 Биология пәнін оқытуда инновациялық технологияларды қолдану
Биология пәнін оқытуда инновациялық технологияларды қолдану метод разработка мех колебания
метод разработка мех колебания Решение задач а фотоэффект
Решение задач а фотоэффект Конструкция автомобиля. Мосты
Конструкция автомобиля. Мосты Методы исследования. Вещества
Методы исследования. Вещества ЭОР тест по теме Уравнение состояния идеального газа. Газовые законы
ЭОР тест по теме Уравнение состояния идеального газа. Газовые законы Классификация технологического и диагностического оборудования СТОА
Классификация технологического и диагностического оборудования СТОА Электрический ток в газах. Газовый разряд. 10 класс
Электрический ток в газах. Газовый разряд. 10 класс Виготовлення наглядового стенду з будови, технічного обслуговування та ремонту коробки змінних передач автомобіля ВАЗ-2101
Виготовлення наглядового стенду з будови, технічного обслуговування та ремонту коробки змінних передач автомобіля ВАЗ-2101 Простые механизмы
Простые механизмы Проект реконструкции сервисного центра по обслуживанию автовладельцев г. Великий Новгород. Разработка услуги по тюнингу салона
Проект реконструкции сервисного центра по обслуживанию автовладельцев г. Великий Новгород. Разработка услуги по тюнингу салона Магнитное поле. Постоянные магниты. Индукция магнитного поля. Графическое изображение магнитного поля
Магнитное поле. Постоянные магниты. Индукция магнитного поля. Графическое изображение магнитного поля Размещение автосцепки на вагоне. Особенности автосцепки СА-3М
Размещение автосцепки на вагоне. Особенности автосцепки СА-3М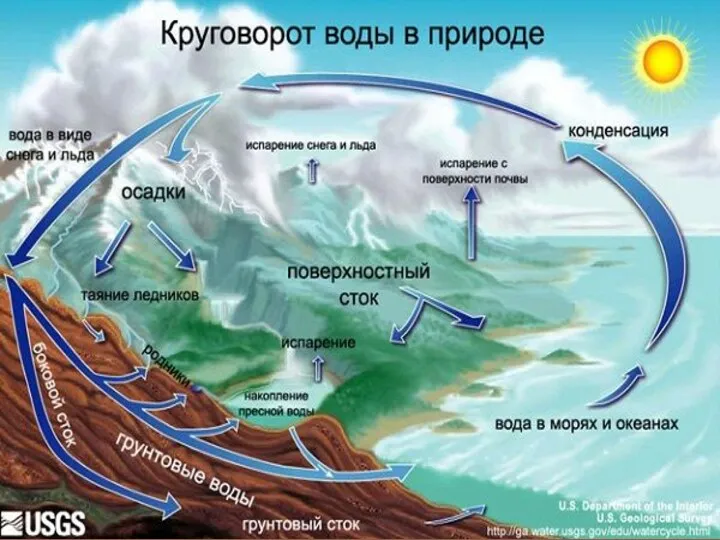 Круговорот воды в природе
Круговорот воды в природе Модуляция и детектирование
Модуляция и детектирование Тема урока. Индукция магнитного поля.8 класс
Тема урока. Индукция магнитного поля.8 класс Почему радуга разноцветная
Почему радуга разноцветная Определение твердости
Определение твердости Сила упругости. Закон Гука
Сила упругости. Закон Гука Элементарные частицы
Элементарные частицы Твердые диэлектрики, применяемые в ТВН. (Лекция 7)
Твердые диэлектрики, применяемые в ТВН. (Лекция 7) Колебательно– вращательные спектры двухатомных молекул. Классическая теория
Колебательно– вращательные спектры двухатомных молекул. Классическая теория Курс теоретической механики
Курс теоретической механики Сила Архимеда
Сила Архимеда Устройство автомобиля – шасси. Подвеска автомобиля
Устройство автомобиля – шасси. Подвеска автомобиля Методика решения задач по прикладной гидравлике
Методика решения задач по прикладной гидравлике Еркін түсу үдеуі. Есептер шығару
Еркін түсу үдеуі. Есептер шығару Плазма и её свойства
Плазма и её свойства