Содержание
- 2. Тема урока : "Окислительно-восстановительные реакции"
- 3. Ca0 +20 ) ) ) ) Ca2+ +20 ) ) ) Ca0 - 2 e =>
- 4. Расставьте степени окисления элементов в реакциях. Сравните, как ведут себя степени окисления в процессе реакции. HCl
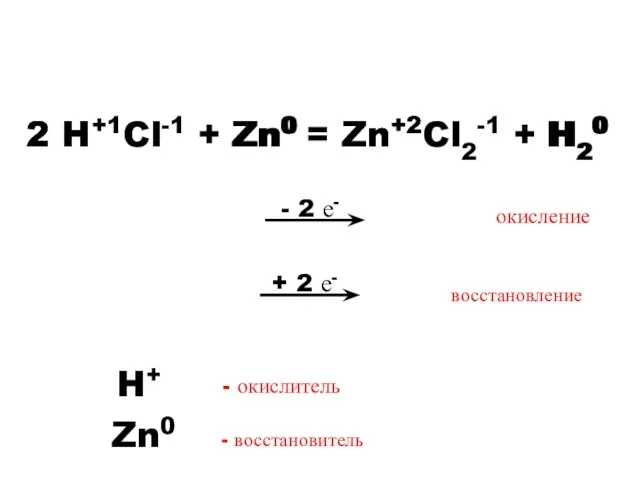
- 5. - 2 е- 2 H+1Cl-1 + Zn0 = Zn+2Cl2-1 + H20 Zn0 2 H+ Zn+2 H20
- 6. Окисление – процесс отдачи электронов. Восстановление – процесс присоединения электронов. Окислитель – элемент, принимающий электроны. Восстановитель
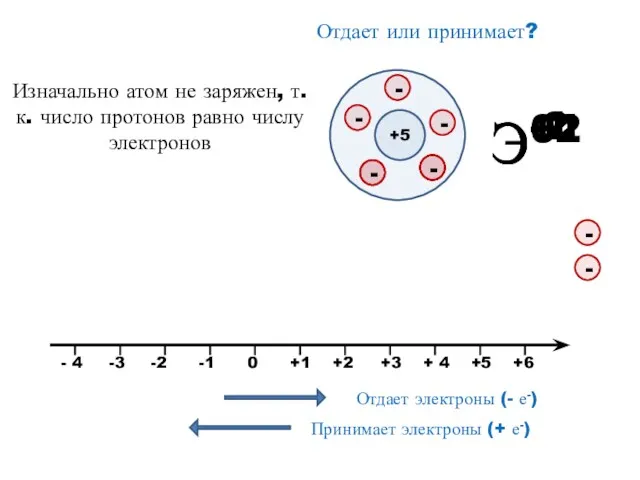
- 7. Э+1 Э+2 Э-2 Э-1 Отдает или принимает? +5 Изначально атом не заряжен, т.к. число протонов равно
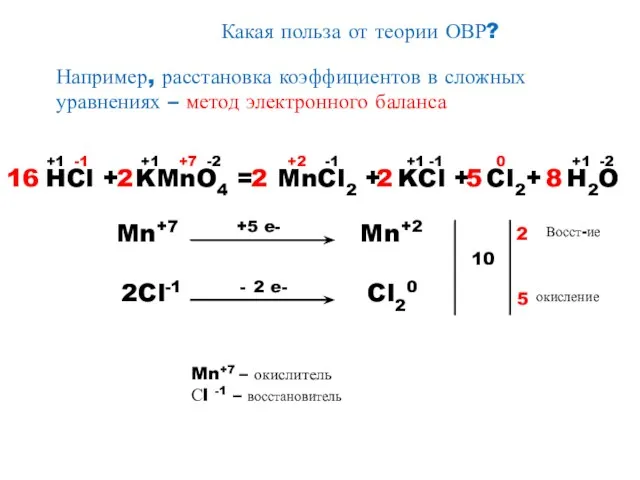
- 8. Какая польза от теории ОВР? Например, расстановка коэффициентов в сложных уравнениях – метод электронного баланса HCl
- 9. Расставьте коэффициенты методом электронного баланса. Al + MnO2 = Al2O3 + Mn Fe2O3 + Zn =
- 10. Покажите электронные переходы в следующих схемах ОВР Назовите окислитель и восстановитель Li0 + O20 => Li2O
- 11. Из приведенных схем уравнений реакций выпишите те, которые можно отнести к ОВР СаСО3 => СаО +
- 12. Расставьте коэффициенты методом электронного баланса в следующих схемах ОВР Определите окислитель, восстановитель 1)С-4Н4+1 + 2О20 =>
- 14. Скачать презентацию








 Жидкокристаллические индикаторы
Жидкокристаллические индикаторы Элементы VА-группы
Элементы VА-группы Периодический закон Д. И. Менделеева
Периодический закон Д. И. Менделеева Кислоты 8 класс
Кислоты 8 класс Спектрофометрия
Спектрофометрия Понятия и определения химической термодинамики. (Лекция 11)
Понятия и определения химической термодинамики. (Лекция 11) Химия и сельское хозяйство
Химия и сельское хозяйство Каталитический риформинг
Каталитический риформинг История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева Химия и путешествия во времени. Задача 7
Химия и путешествия во времени. Задача 7 Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ
Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ Электронные конфигурации атомов
Электронные конфигурации атомов Минералогия литофильных редких элементов. Бор
Минералогия литофильных редких элементов. Бор Биологически важные пяти- и шестичленные гетероциклы с одним и двумя гетероатомами
Биологически важные пяти- и шестичленные гетероциклы с одним и двумя гетероатомами Загрязнители пищи тяжелые металлы, радиоктивные элементы, ПАУ, пестициды, и нитрозамины
Загрязнители пищи тяжелые металлы, радиоктивные элементы, ПАУ, пестициды, и нитрозамины Общие черты гидротермальных месторождений
Общие черты гидротермальных месторождений Химическая связь
Химическая связь Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде
Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие Органолептические и визуальные методы идентификация полимера
Органолептические и визуальные методы идентификация полимера Углекислый газ
Углекислый газ Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1 Физические свойства минералов
Физические свойства минералов Классификация химических реакций
Классификация химических реакций Вода-растворитель. Работа воды в природе
Вода-растворитель. Работа воды в природе Классификация и номенклатура основных классов неорганических соединений
Классификация и номенклатура основных классов неорганических соединений Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс