Слайд 2

Учебная цель:
изучить способы получения,
химические свойства
и применение алкенов
на
примере непредельного углеводорода - этилена
Слайд 3

Эпиграф к уроку
«Границ научному познанию и предсказанию предвидеть невозможно»
Д.И.Менделеев
Слайд 4
Лист самоанализа учебной деятельности учащегося ___________
по теме «Получение, химические свойства
Слайд 5

Ответьте, пожалуйста, на следующие вопросы:
Какие углеводороды называются алкенами?
Какова общая формула алкенов?
Какова
структурная формула первого представителя гомологического ряда алкенов? Назовите его.
Почему в отличие от алканов алкены в природе практически не встречаются?
Какие способы получения алкенов вы знаете? Каким лабораторным способом можно получить алкены?
Какие химические свойства обуславливает наличие кратной (двойной) связи в молекулах алкенов?
Для чего используют алкены?
Слайд 6
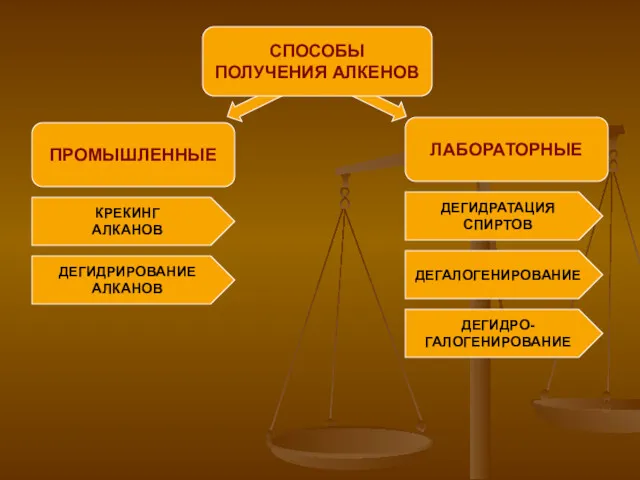
ПРОМЫШЛЕННЫЕ
СПОСОБЫ
ПОЛУЧЕНИЯ АЛКЕНОВ
ЛАБОРАТОРНЫЕ
КРЕКИНГ
АЛКАНОВ
ДЕГИДРИРОВАНИЕ
АЛКАНОВ
ДЕГИДРАТАЦИЯ
СПИРТОВ
ДЕГАЛОГЕНИРОВАНИЕ
ДЕГИДРО-
ГАЛОГЕНИРОВАНИЕ
Слайд 7

ПРОМЫШЛЕННЫЙ
СПОСОБ ПОЛУЧЕНИЯ
КРЕКИНГ АЛКАНОВ
АЛКАН → АЛКАН + АЛКЕН
С БОЛЕЕ ДЛИННОЙ С
МЕНЕЕ ДЛИНОЙ
УГЛЕРОДНОЙ УГЛЕРОДНОЙ
ЦЕПЬЮ ЦЕПЬЮ
ПРИМЕР:
t=400-700C
С10Н22 → C5H12 + C5H10
декан пентан пентен
Слайд 8

ПРОМЫШЛЕННЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРИРОВАНИЕ АЛКАНОВ
АЛКАН → АЛКЕН + ВОДОРОД
ПРИМЕР:
Ni, t=500C
Н3С - СН3 → Н2С = СН2 + Н2
этан этен
(этилен)
Слайд 9
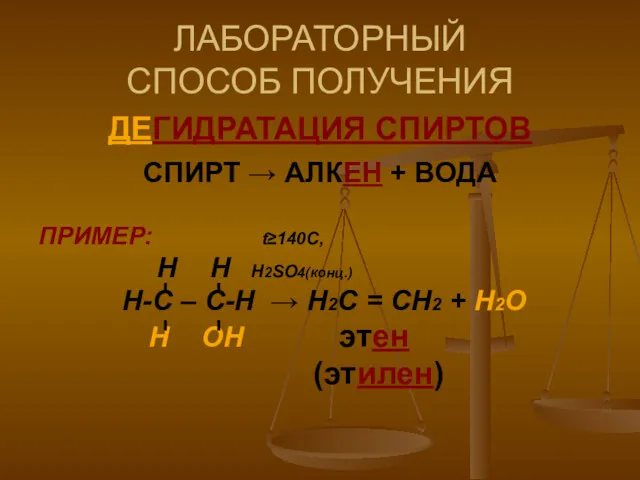
ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРАТАЦИЯ СПИРТОВ
СПИРТ → АЛКЕН + ВОДА
ПРИМЕР: t≥140C,
Н Н
Н2SO4(конц.)
Н-С – С-Н → Н2С = СН2 + Н2О
Н ОН этен
(этилен)
Слайд 10

ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГАЛОГЕНИРОВАНИЕ
ПРИМЕР:
t
Н2С – СН2 + Zn → Н2С = СН2
+ ZnBr2
Br Br этен
1,2-дибромэтан (этилен)
Слайд 11

ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРОГАЛОГЕНИРОВАНИЕ
УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ
ПРИМЕР:
спиртовой
H H раствор
Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O
Н
Cl этен
хлорэтан (этилен)
Слайд 12
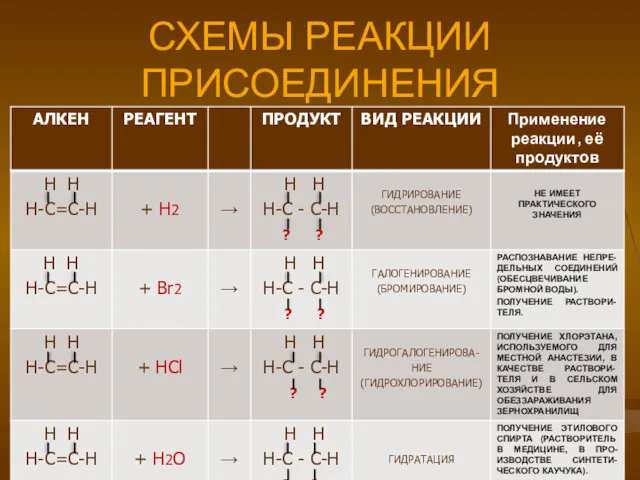
СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯ
Слайд 13

РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ
Это процесс соединения одинаковых молекул в более крупные.
ПРИМЕР: n CH2=CH2
(-CH2-CH2-)n
этилен полиэтилен
(мономер) (полимер)
n – степень полимеризации, показывает число молекул, вступивших в реакцию
-CH2-CH2- структурное звено
Слайд 14

РЕАКЦИИ ОКИСЛЕНИЯ
ГОРЕНИЕ АЛКЕНОВ
ПРИМЕР:
2С2Н6 + 7О2 4СО2 + 6Н2О
Слайд 15

РЕАКЦИИ ОКИСЛЕНИЯ
МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ
(реакция
Е.Е.Вагнера)
Н2С=СН2 + [O] + H2O H2C - CH2
OH OH
этиленгликоль
(этандиол-1,2)
! Качественная реакция на непредельность углеводорода – на кратную связь.
Слайд 16

Слайд 17

Слайд 18

СИНКВЕЙН
1 строка – имя существительное (тема синквейна)
2 строка – два прилагательных
(раскрывающие тему синквейна)
3 строка – три глагола (описывают действия)
4 строка – фраза или предложение
(высказывают своё отношение к теме)
5 строка – синоним (слово-резюме)
Слайд 19

Этилен
Ненасыщенный, активный
Горит, обесцвечивает, присоединяет
Этилен – представитель непредельных углеводородов
Алкен
Слайд 20

ДОМАШНЕЕ ЗАДАНИЕ
Оценка «3»: параграф 4, ТПО стр. 24-25, № 5-7
Оценка
«4»: Хомченко И.Г.: 20.21
Оценка «5»: Составить цепочку превращений, используя материал по темам «Алканы» и «Алкены»



















 Задачи по химии
Задачи по химии Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування
Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування Полимеры в нашей жизни (10 класс)
Полимеры в нашей жизни (10 класс) Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Титрование в неводных средах. (Лекция 26)
Титрование в неводных средах. (Лекция 26) Минералы. Классификация
Минералы. Классификация Особенности дисперсных систем
Особенности дисперсных систем Алкадиены (диены, диеновые углеводороды)
Алкадиены (диены, диеновые углеводороды) Арены. Бензол. Урок химии. 10 класс
Арены. Бензол. Урок химии. 10 класс Оксид меди
Оксид меди Многоатомные спирты
Многоатомные спирты Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее?
Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее? Азотная кислота
Азотная кислота Классы неорганических соединений
Классы неорганических соединений Омега 3
Омега 3 Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент
Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент Жиры (триглицериды)
Жиры (триглицериды) Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Природный и попутный нефтяной газ
Природный и попутный нефтяной газ Реакционные аппараты
Реакционные аппараты Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов
Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов Электролиз
Электролиз Свойства НЦ
Свойства НЦ Ионный обмен. Хроматография
Ионный обмен. Хроматография Алкани. Ізомерія та номенклатура алканів
Алкани. Ізомерія та номенклатура алканів Вода - основа жизни
Вода - основа жизни Роль побутової хімії у житті
Роль побутової хімії у житті