Содержание
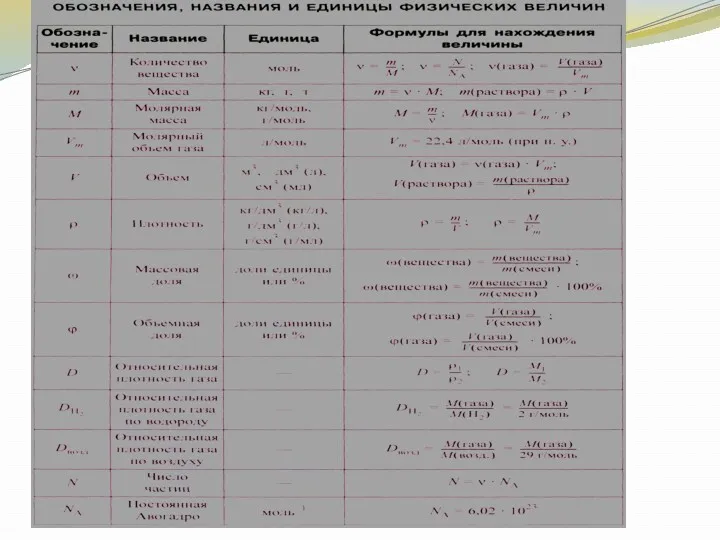
- 2. Закон сохранения массы. Был открыт М. В. Ломоносовым и сформулирован А. Лавуазье (1777): Масса веществ, вступивших
- 3. Закон постоянства состава вещества. Сформулирован Ж.-Л. Прустом в 1799г.: Всякое чистое вещество независимо от способа его
- 4. Современная формулировка закона постоянства состава вещества: Состав соединений молекулярной структуры является постоянным независимо от способа их
- 5. ГАЗОВЫЕ ЗАКОНЫ 1) Закон Авогадро. Сформулирован А. Авогадро в результате проведения многочисленных экспериментов: В равных объемах
- 6. Из закона Авогадро вытекают 2 следствия: 1 следствие - Один моль любого газа при одинаковых условиях
- 7. 2 следствие - Массы двух разных газов, занимающих одинаковый объем при одинаковых условиях, относятся между собой
- 8. Газовые законы 2) Состояние идеального газа определённой массы характеризуется тремя параметрами: P, V, T. Между этими
- 9. Эти три закона можно объединить в один универсальный газовый закон (уравнение состояния идеального газа): , или
- 10. Уравнение Менделеева-Клапейрона (для произвольного количества газа n ): или где p – давление газа в замкнутой
- 11. Основные законы химии
- 14. ЗАДАЧИ на ВЫХОД ПРОДУКТА РЕАКЦИИ
- 19. Сколько молекул содержится в 32 г сернистого газа ? Какова масса молекул аммиака ? Какова масса
- 20. 8.Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV)
- 21. Базовые задачи ЕГЭ
- 23. Скачать презентацию



















 Химия өнеркәсібі
Химия өнеркәсібі Измерение и оценка химического фактора. Лекция 9
Измерение и оценка химического фактора. Лекция 9 Карбоновые кислоты
Карбоновые кислоты Нафталин
Нафталин Значення хімії у розв’ язанні енергетичної проблеми
Значення хімії у розв’ язанні енергетичної проблеми Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Предельные углеводороды
Предельные углеводороды Введение в химию органических соединений
Введение в химию органических соединений Метод окислительно-восстановительного титрования
Метод окислительно-восстановительного титрования Металлы; их классификация, строения и свойства
Металлы; их классификация, строения и свойства Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Фенол, його властивості
Фенол, його властивості Азотсодержащие органические соединения
Азотсодержащие органические соединения Электронные представления в химии
Электронные представления в химии Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Запись атомов и молекул с помощью химических символов
Запись атомов и молекул с помощью химических символов Химия. ЕГЭ. Задание № 32
Химия. ЕГЭ. Задание № 32 Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Бордың адам ағзасына әсері. Бор дегеніміз не?
Бордың адам ағзасына әсері. Бор дегеніміз не? Химические средства гигиены и косметики
Химические средства гигиены и косметики Бытовая химия. Правила безопасного обращения со средствами бытовой химии
Бытовая химия. Правила безопасного обращения со средствами бытовой химии Минералы группы кварца
Минералы группы кварца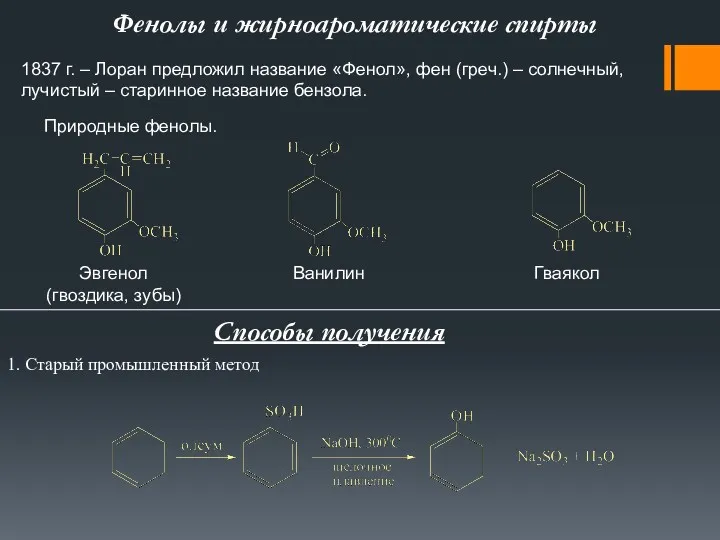 Фенолы и жирноароматические спирты
Фенолы и жирноароматические спирты Алициклді көмірсутекті қосылыстар
Алициклді көмірсутекті қосылыстар Химическая связь. Лекция 2-3
Химическая связь. Лекция 2-3 Железо. Физические свойства
Железо. Физические свойства Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Аминокилоты. Свойства
Аминокилоты. Свойства