Содержание
- 2. План 1. Количественный анализ в аналитической химии. Сущность гравиметрического метода. Основные операции в гравиметрическом методе. Осадитель
- 3. 1. Количественный анализ. Задачи и методы количественного анализа Раздел аналитической химии, изучающий методы определения количественного содержания
- 4. Гравиметрический анализ Гравиметрический анализ – метод количественного химического анализа, который базируется на точном измерении массы определяемого
- 5. Методы гравиметрического анализа Метод осаждения – это метод гравиметрического анализа, который базируется на измерении точной массы
- 6. Осаждаемая и гравиметрическая формы Соединение, которое осаждается из раствора при взаимодействии определяемого компонента с реагентом-осадителем, называется
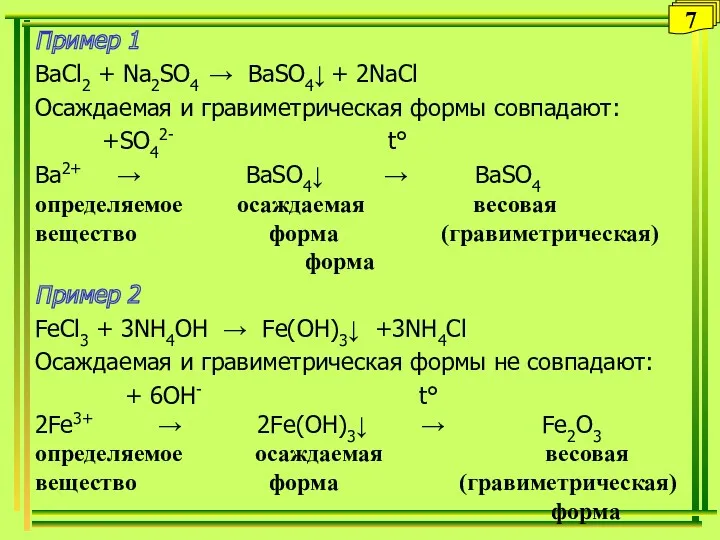
- 7. Пример 1 BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl Осаждаемая и гравиметрическая формы совпадают: +SO42- t°
- 8. Требования к осадителю Качество осадка находится в зависимости от свойств осадителя. Желательно, чтобы осадитель был веществом
- 9. Требования к осаждаемой форме Осаждаемая форма должна обладать достаточно низкой растворимостью. Осадок должен быть по возможности
- 10. Схема анализа и главные операции метода осаждения отбор средней пробы вещества и подготовка ее к анализу
- 11. П.2. Расчеты в гравиметрическом анализе. Фактор пересчета Расчет навески и массовой доли анализируемого вещества где g
- 12. Преимущества и недостатки гравиметрического анализа 12
- 13. 3. Растворимость соединений. Произведение растворимости. Насыщенный и ненасыщенные растворы. Условия выпадения осадка. Произведение растворимости и растворимость
- 14. Растворимость (L), моль/л МхАу(т) х Ма+ + у Аb– [Ma+] = x L; [Ab–] = y
- 15. Условия выпадения и растворения осадка. Насыщенные и ненасыщенные растворы 15 Условия выпадения осадка: ПК > ПР,
- 16. П.4. Решение задач на произведение растворимости Задача Рассчитать растворимость сульфата серебра, если ПР(Ag2SO4) = 1,2 .
- 17. Посуда и оборудование в гравиметрическом анализе. Весы аналитические 17
- 18. Осаждение 18
- 19. Фильтрование 19
- 20. Фильтрование 20
- 21. Гравиметрическая форма (после прокаливания) 21
- 22. 22
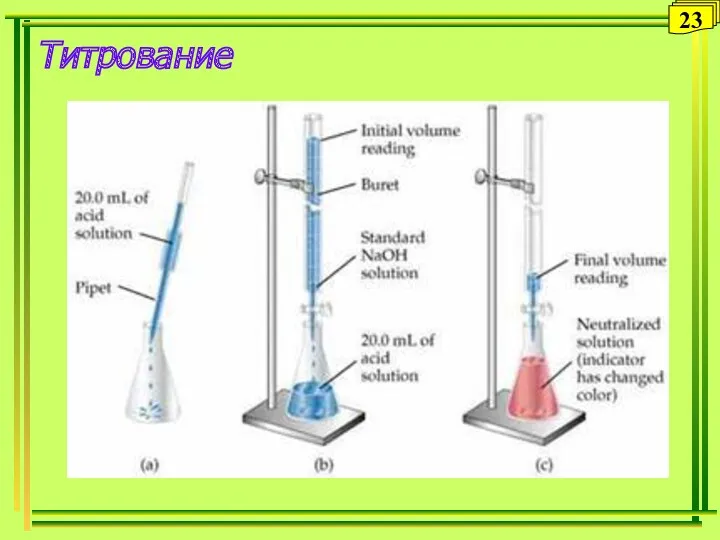
- 23. Титрование 23
- 25. Скачать презентацию











![Растворимость (L), моль/л МхАу(т) х Ма+ + у Аb– [Ma+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/288725/slide-13.jpg)







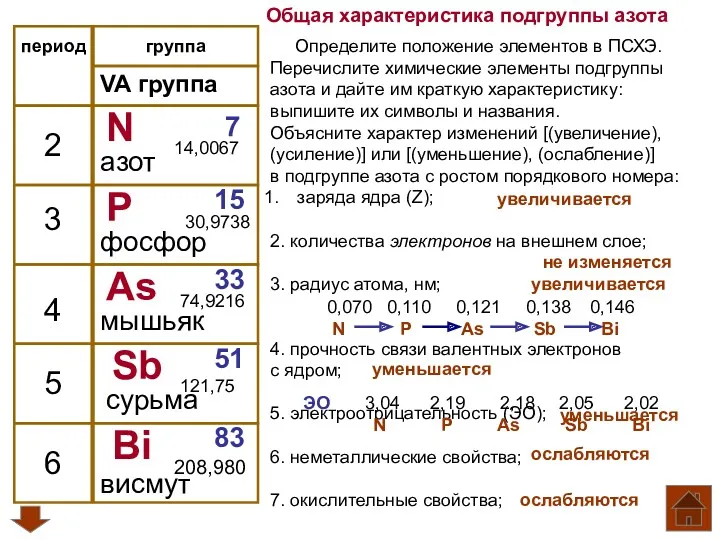 Общая характеристика подгруппы азота
Общая характеристика подгруппы азота Энергетика химических процессов
Энергетика химических процессов Арени. Бензен: молекулярна і структурна формули, фізичні властивості
Арени. Бензен: молекулярна і структурна формули, фізичні властивості Тайна великого открытия периодической таблицы
Тайна великого открытия периодической таблицы Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Современные конструкционные материалы
Современные конструкционные материалы Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Значення періодичного закону
Значення періодичного закону Полимеры. Протезы трахеи
Полимеры. Протезы трахеи №9 зертханалық жұмыс
№9 зертханалық жұмыс Алкадиены
Алкадиены Элемент свинец Рb
Элемент свинец Рb Циклические алифатические углеводороды
Циклические алифатические углеводороды Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Теория твердения минеральных вяжущих веществ
Теория твердения минеральных вяжущих веществ Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Классы неорганических веществ (лекция № 4)
Классы неорганических веществ (лекция № 4) Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Композиционные материалы
Композиционные материалы Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування
Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах The Sulphur cycle. The Sulphur dioxide problems
The Sulphur cycle. The Sulphur dioxide problems Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Классификация и номенклатура неорганических соединений (Малый химический тренажёр)
Классификация и номенклатура неорганических соединений (Малый химический тренажёр) Строение атома. Классификация ядер атомов
Строение атома. Классификация ядер атомов Химический состав прямогонных бензинов
Химический состав прямогонных бензинов Химико-токсикологическое исследование отравлений отдельными лекарственными препаратами
Химико-токсикологическое исследование отравлений отдельными лекарственными препаратами