Содержание
- 2. План. Определение. Общая формула класса углеводородов. Гомологический ряд. Виды изомерии. Номенклатура алканов Строение алканов. Физические свойства.
- 3. Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.) Алканы - углеводороды в молекулах которых все атомы углерода связаны
- 4. Гомологический ряд метана СН4 метан С2H6 этан C3H8 пропан C4H10 бутан C5H12 пентан C6H14 гексан C7H16
- 5. Изомерия алканов Структурная изомерия: CH3 - CH2 - CH2 - CH2 - CH3 или CH3 –
- 6. номенклатура алканов Алгоритм. Выбор главной цепи: CH3 – CH - CH2 - CH3 │ CH3
- 7. Номенклатура алканов 2. Нумерация атомов главной цепи: 1 2 3 4 CH3 – CH - CH2
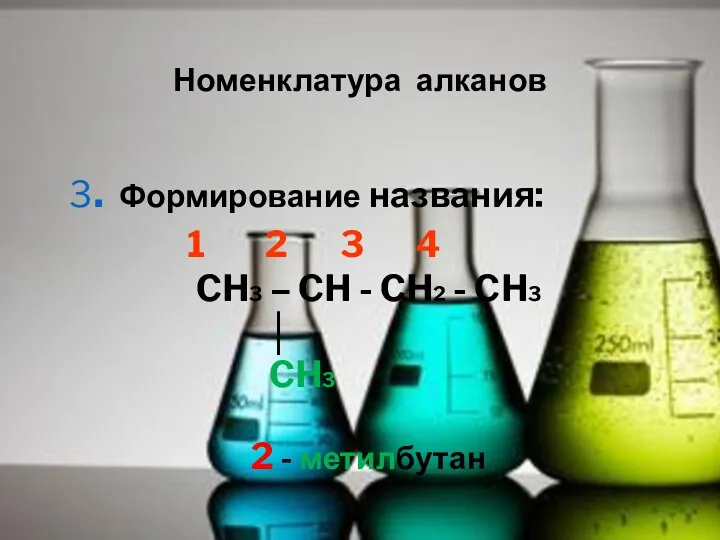
- 8. Номенклатура алканов 3. Формирование названия: 1 2 3 4 CH3 – CH - CH2 - CH3
- 9. Радикал – это частица, имеющая неспаренные электроны.
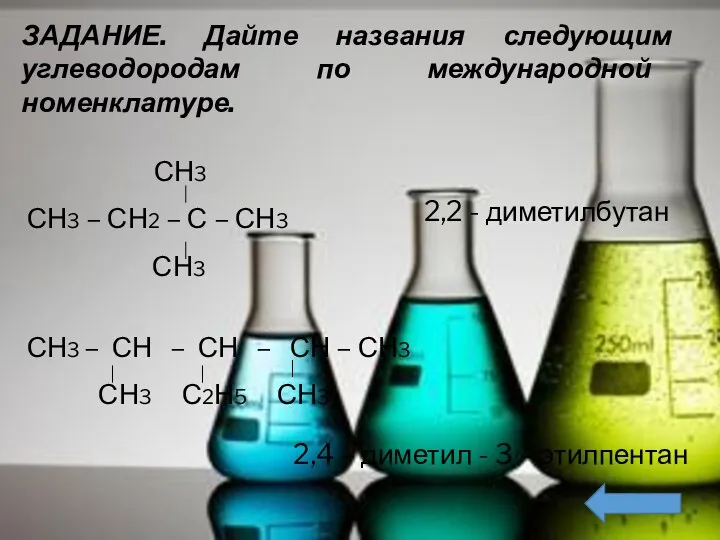
- 10. ЗАДАНИЕ. Дайте названия следующим углеводородам по международной номенклатуре. СН3 СН3 – СН2 – С – СН3
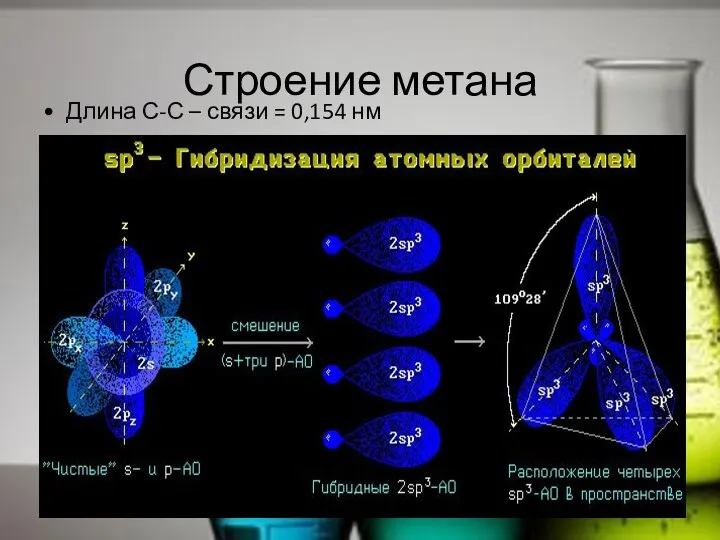
- 11. Строение метана Длина С-С – связи = 0,154 нм
- 12. Строение метана
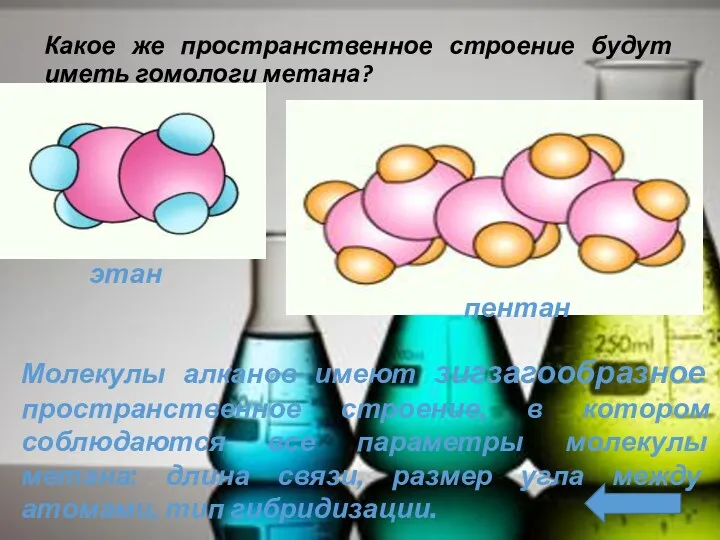
- 13. Какое же пространственное строение будут иметь гомологи метана? этан пентан Молекулы алканов имеют зигзагообразное пространственное строение,
- 14. Физические свойства С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления.
- 15. Получение алканов 1 –выделение углеводородов из природного сырья 2- гидрирование циклоалканов и непредельных углеводородов 3- декарбоксилирование
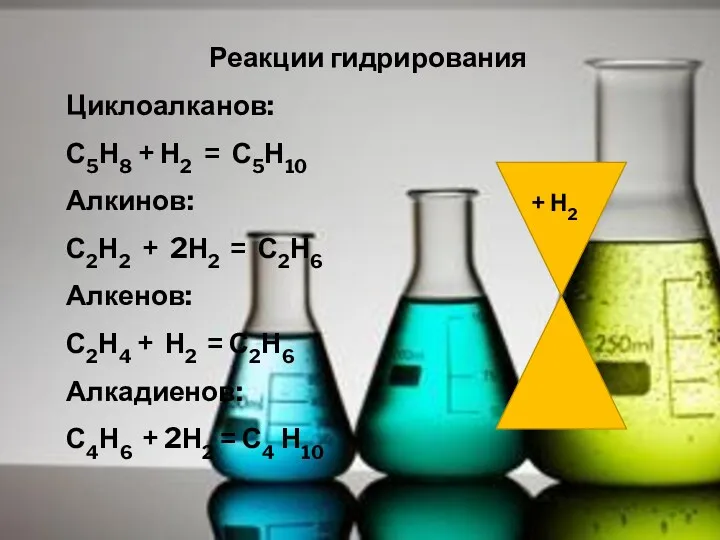
- 16. Реакции гидрирования Циклоалканов: С5Н8 + Н2 = С5Н10 Алкинов: С2Н2 + 2Н2 = С2Н6 Алкенов: С2Н4
- 17. Получение метана при сплавлении ацетата натрия со щелочью: t °C CH3COONa + NaOH ⎯⎯→ CH4 ⇑
- 18. Синтез Вюрца Проводят с целью получения алканов с более длинной углеродной цепью. Например: получение этана из
- 19. Метан в лаборатории можно получить гидролизом карбида алюминия Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
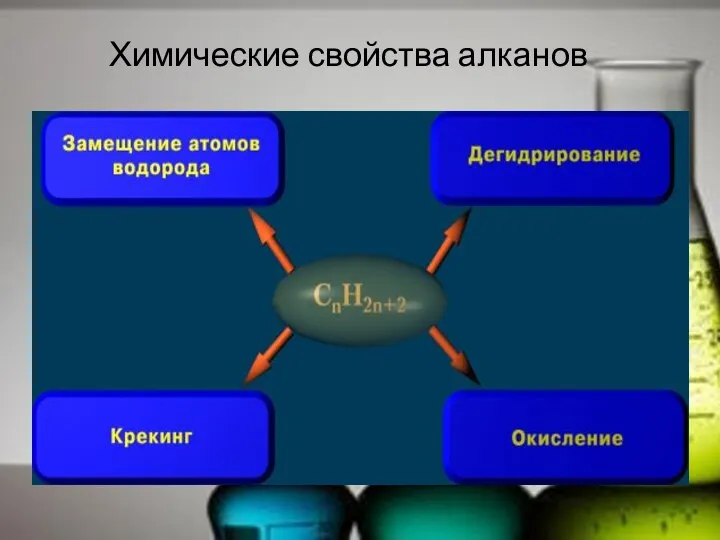
- 20. Химические свойства алканов
- 21. СН4 + Сl2 CH3Cl + HCl + Q t Реакции протекают по радикальному механизму. С Н
- 22. Реакции изомеризации: СН3 СН2 СН2 СН2 СН3 t, катализатор СН3 СН СН2 СН3 СН3 Реакции с
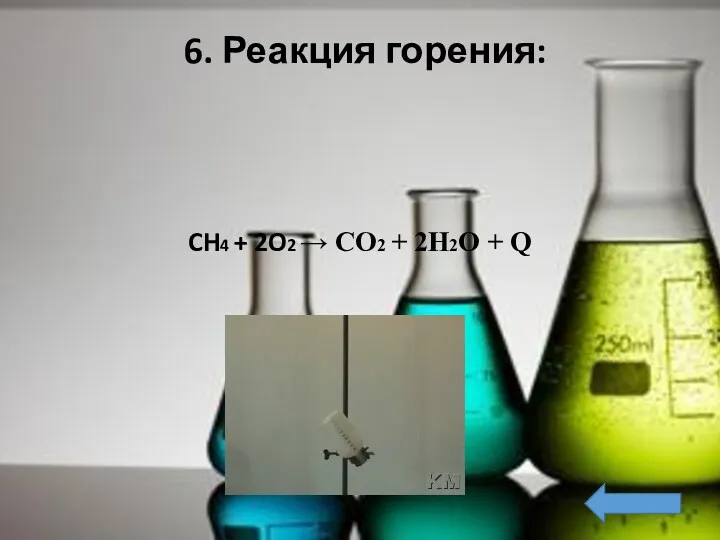
- 23. 6. Реакция горения: CH4 + 2O2 → CO2 + 2H2O + Q
- 24. Применение Получение ацетилена Горючее для дизельных и турбореактивных двигателей Получение растворителей В металлургии А также сырьё
- 26. Скачать презентацию
















 Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Basic concepts and laws of chemical thermodynamics
Basic concepts and laws of chemical thermodynamics Синтез, фото- и ионохромные свойства спиропиранов на основе гидроксихинолинового альдегида
Синтез, фото- и ионохромные свойства спиропиранов на основе гидроксихинолинового альдегида Литье под давлением термопластов
Литье под давлением термопластов Смоги и их влияние на человека
Смоги и их влияние на человека Химические превращения веществ
Химические превращения веществ Электрохимический ряд напряжений металлов. Свойства металлов
Электрохимический ряд напряжений металлов. Свойства металлов Электролитическая диссоциация. Вещества в растворах
Электролитическая диссоциация. Вещества в растворах Периодические изменения свойств химических элементов
Периодические изменения свойств химических элементов Зависимость свойств веществ от типа химической связи и кристаллической решетки
Зависимость свойств веществ от типа химической связи и кристаллической решетки Силикатное производство
Силикатное производство Твердые вещества
Твердые вещества Alkaline earth metals
Alkaline earth metals Электролиз. Классификация
Электролиз. Классификация Классификация органических соединений. Углеводороды
Классификация органических соединений. Углеводороды Химия и косметика
Химия и косметика Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения
Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения Элементы IV А - группы
Элементы IV А - группы Центрифугирование в почвоведении
Центрифугирование в почвоведении Азот. Элемент V группы главной подгруппы
Азот. Элемент V группы главной подгруппы Минералдар. Минералдардын жіктелуі
Минералдар. Минералдардын жіктелуі Вуглеводи. Класифікація вуглеводів, їх утворення й поширення у природі. Глюкоза
Вуглеводи. Класифікація вуглеводів, їх утворення й поширення у природі. Глюкоза Поверхностно-активные вещества и их роль
Поверхностно-активные вещества и их роль Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде Химия элементов VA группы (пниктогены или пникти́ды)
Химия элементов VA группы (пниктогены или пникти́ды) Камни и Скорпион
Камни и Скорпион The production of stable isotopes
The production of stable isotopes Органические и неорганические кислоты
Органические и неорганические кислоты