Слайд 2
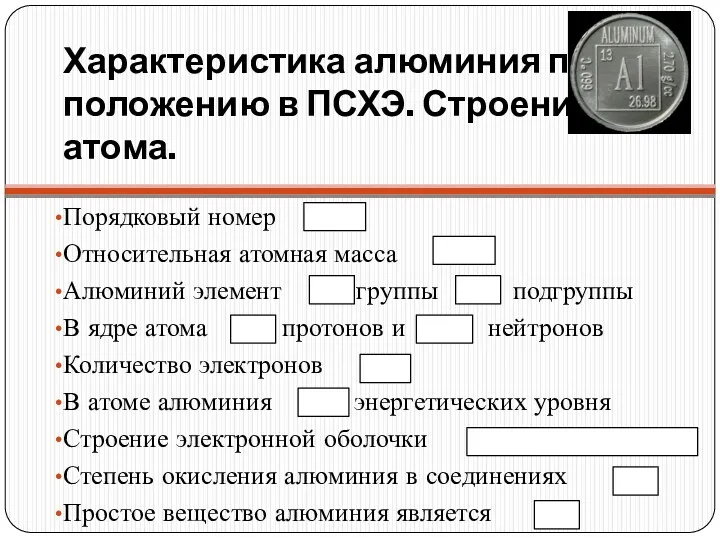
Характеристика алюминия по положению в ПСХЭ. Строение атома.
Порядковый номер
Относительная атомная масса
Алюминий
элемент группы подгруппы
В ядре атома протонов и нейтронов
Количество электронов
В атоме алюминия энергетических уровня
Строение электронной оболочки
Степень окисления алюминия в соединениях
Простое вещество алюминия является
Слайд 3
Слайд 4

Нахождение в природе.
Изотоп алюминия 27Al со следами радиоактивного изотопа 26Al, полураспад
720 тыс. лет.
Содержание алюминия в земной коре около 8%. По распространенности в природе занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию.
Слайд 5

Минералы алюминия.
Бокситы Al2O3∙nH2O (с примесями SiO2, Fe2O3 и CaCO3)
Нефелины KNa3[AlSiO4]4
Алуниты (Na,
K)2SO4∙Al2(SO4)3∙4Al(OH)3
Каолин Al2O3∙2SiO2∙2H2O
Слайд 6

Корунд (сапфир, рубин) Al2O3
Берилл (изумруд, аквамарин) 2BeO∙ Al2O3∙6SiO2
Хризоберилл (александрит) BeAl2O4
Слайд 7

Алюминий в металлическом состоянии был впервые получен в 1825 году датским
физиком Гансом Эрстедом действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути.
Слайд 8

Получение алюминия.
В промышленности – электролиз раствора глинозема Al2O3 в расплаве криолита
Na3AlF6 с добавкой CaF2.
Криолит используется как растворитель Al2O3, а добавка CaF2 позволяет поддерживать температуру плавления в электролитической ванне не выше 10000С.
Слайд 9
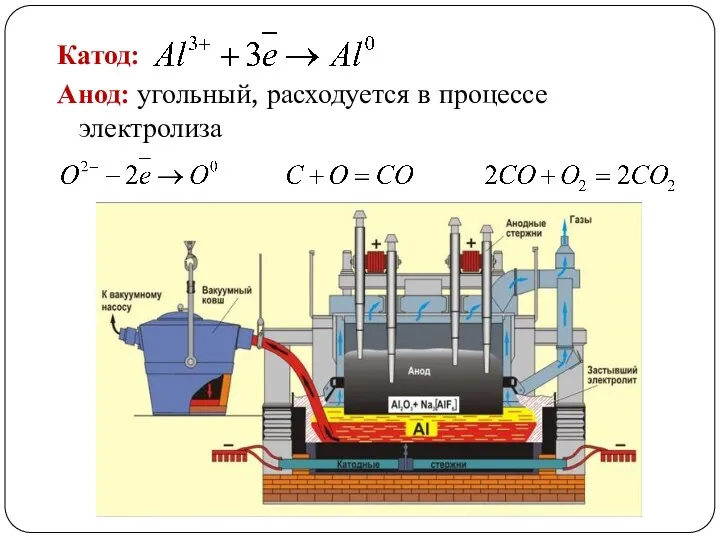
Катод:
Анод: угольный, расходуется в процессе электролиза
Слайд 10

Для получения 1000 кг алюминия, требуется 1920 кг глинозема, 65 кг
криолита, 35 кг фторида калия, 600 кг анодной массы и 17 тыс. кВт∙г электроэнергии.
Лабораторный способ
предложил Фридрих Велер
в 1827 году.
(при нагревании)
Слайд 11

Физические свойства.
Металл серебристо-белого цвета, очень пластичный. Обладает высокой тепло- и электропроводностью,
стойкостью к коррозии (оксидные пленки).
Плотность 2,7 кг/см3
Температура плавления 6600С
Температура кипения 25000С
Слайд 12

Химические свойства
Он химически активен.
Легко окисляется кислородом воздуха.
При обычной температуре реагирует с
хлором и бромом, с фтором при нагревании:
Слайд 13

При нагревании реагирует с неметаллами:
С серой, образуя сульфид алюминия
С азотом,
образуя нитрид алюминия
С углеродом, образуя карбид алюминия
Слайд 14

Алюминий растворяется в разбавленной серной и соляной кислотах, а также в
водных растворах щелочей
Пассивирует в концентрированной серной и азотной кислотах.
Слайд 15

Алюминий без оксидной пленки активно реагирует с водой.
Является сильным восстановителем других
металлов из их оксидов (алюминотермия).
Слайд 16

Сплавы алюминия.
Дюралюмин – сплав алюминия с медью (1,4-13%), марганцем.
Магналин – сплав
алюминия с магнием (5-13%).
Силумин – сплав алюминия,
содержащий кремний. Хорошо
подвергается литью.
Слайд 17
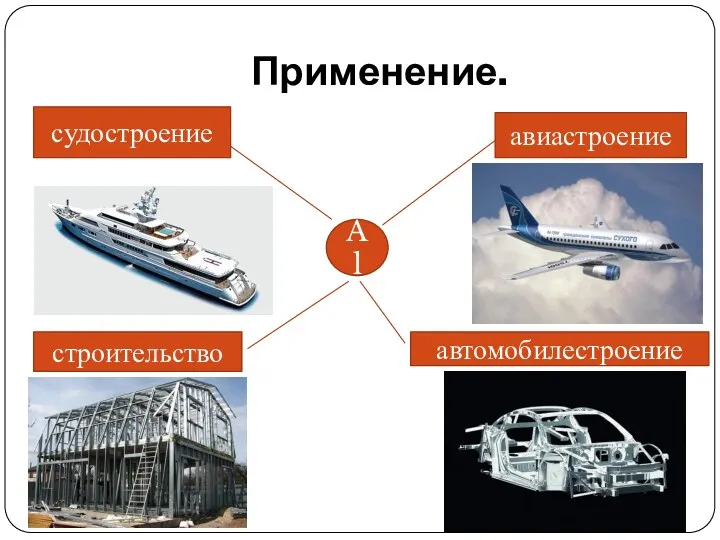
Применение.
Al
авиастроение
автомобилестроение
строительство
судостроение
Слайд 18
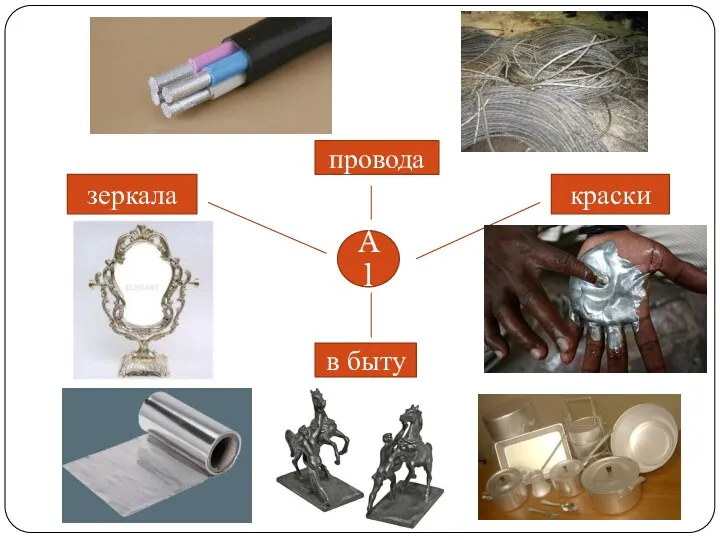
Al
провода
краски
зеркала
в быту
Слайд 19

Горючие и взрывчатые смеси.
Алюмотол – литая смесь тринитротолуола с порошком алюминия.
Промышленное взрывчатое вещество.
Аммонал – аммиачная селитра, тринитротолуол и порошок алюминия.
Термит – смесь порошков алюминия и оксида железа (Fe2O3 или Fe3O4). Используется для сварки рельсов и трубопроводов.


















 Фации метаморфизма
Фации метаморфизма Цинк и его соединения
Цинк и его соединения Материаловедение в полиграфическом и упаковочном производстве
Материаловедение в полиграфическом и упаковочном производстве Теплогенерация. Топливо и его горение
Теплогенерация. Топливо и его горение Phosphorus
Phosphorus Азотсодержащие органические соединения
Азотсодержащие органические соединения Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Молярна маса речовини
Молярна маса речовини Соединения железа
Соединения железа Конструкционные материалы на основе легких металлов: сплавы алюминия
Конструкционные материалы на основе легких металлов: сплавы алюминия Спирти та їх види
Спирти та їх види Алюминий и его соединения
Алюминий и его соединения Алкани
Алкани Електроліз. Найпоширеніші способи застосування
Електроліз. Найпоширеніші способи застосування Органические производные титана со связями Ti-O-C. Получение и свойства. Полимеры на их основе
Органические производные титана со связями Ti-O-C. Получение и свойства. Полимеры на их основе Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Классификация химических реакций
Классификация химических реакций Растворы
Растворы Скорость химической реакции
Скорость химической реакции Менделеевские уроки. День науки
Менделеевские уроки. День науки Электроотрицательность химических элементов
Электроотрицательность химических элементов Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів
Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів Карбоновые кислоты
Карбоновые кислоты Соли (12 класс)
Соли (12 класс) Разнообразие неметаллов
Разнообразие неметаллов Многообразие карбоновых кислот
Многообразие карбоновых кислот Задачи на смеси и сплавы
Задачи на смеси и сплавы Жуғыш заттардың адам өміріндегі маңызы. Химиялық өнімдердің адам өміріндері маңызы
Жуғыш заттардың адам өміріндегі маңызы. Химиялық өнімдердің адам өміріндері маңызы