Содержание
- 2. Аммиак. 9 класс.
- 3. Цели урока: 1. Рассмотреть строение молекулы аммиака. 2. Изучить получение и физические свойства аммиака. 3. Познакомиться
- 4. I.Строение молекулы аммиака.
- 5. 1.Степень окисления элементов в молекуле: N H 3 -3 +
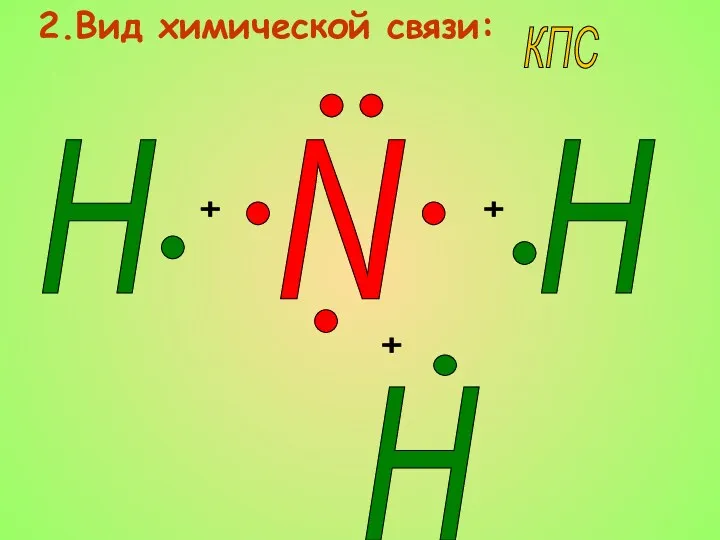
- 6. 2.Вид химической связи: N + + + H H H КПС
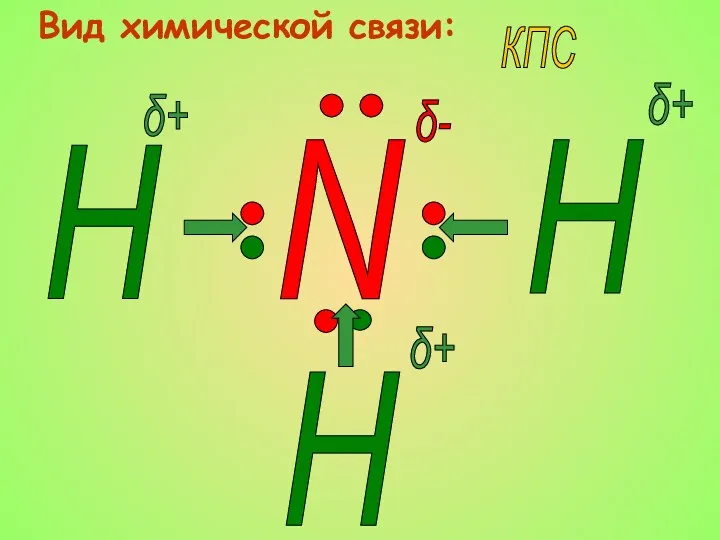
- 7. Вид химической связи: N H H H КПС δ+ δ+ δ+ δ-
- 8. II.Получение аммиака
- 9. а) В промышленности По уже известной вам реакции взаимодействия N2 и H2. Не забудьте расставить коэффициенты!
- 10. б) В лаборатории
- 12. б) В лаборатории N H 4 Cl + (OH) Ca 2 N H 3 + Cl
- 13. Посмотрим опыт получения аммиака из гидроксида аммония и его растворение в воде.
- 14. III.Физические свойства. N H 3 газ без цвета резкий запах едкий вкус t кип = 33,6
- 15. Почему аммиак так хорошо растворим в воде?
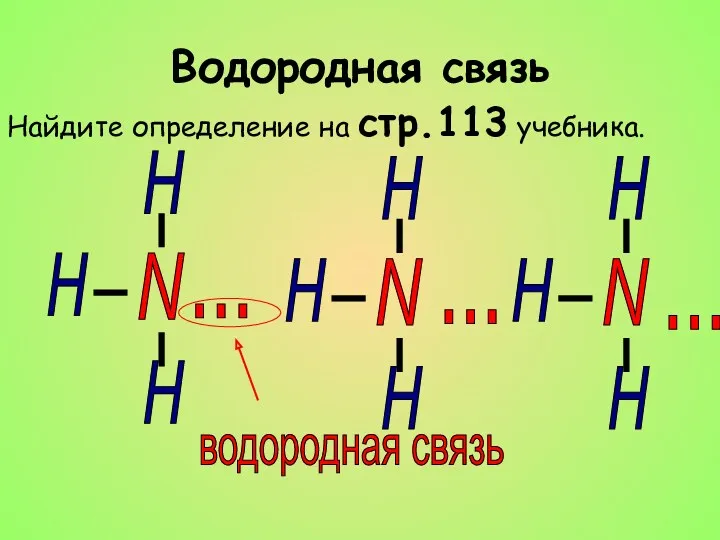
- 16. Водородная связь Найдите определение на стр.113 учебника. N водородная связь H ... H H N H
- 17. Следствия наличия водородной связи в молекуле аммиака: Очень хорошая растворимость в воде. в 1 л H2O
- 18. IV.Химические свойства. Взаимодействие аммиака с водой и кислотой.
- 19. Образование иона аммония по донорно-акцепторному механизму.
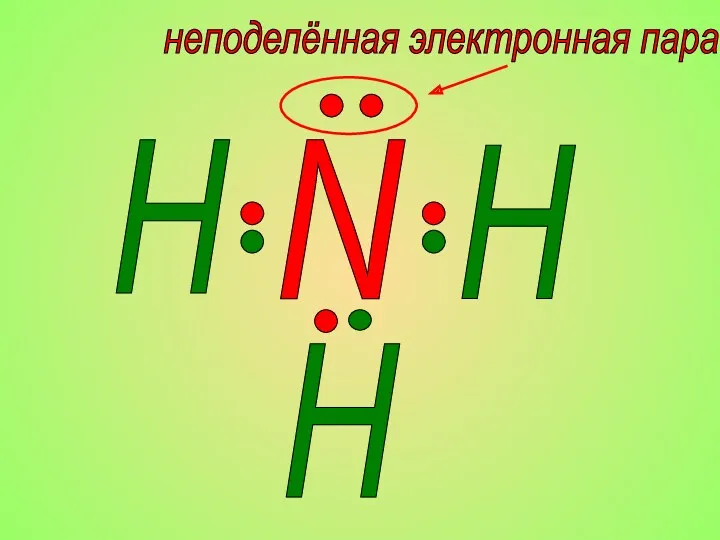
- 20. N H H H неподелённая электронная пара
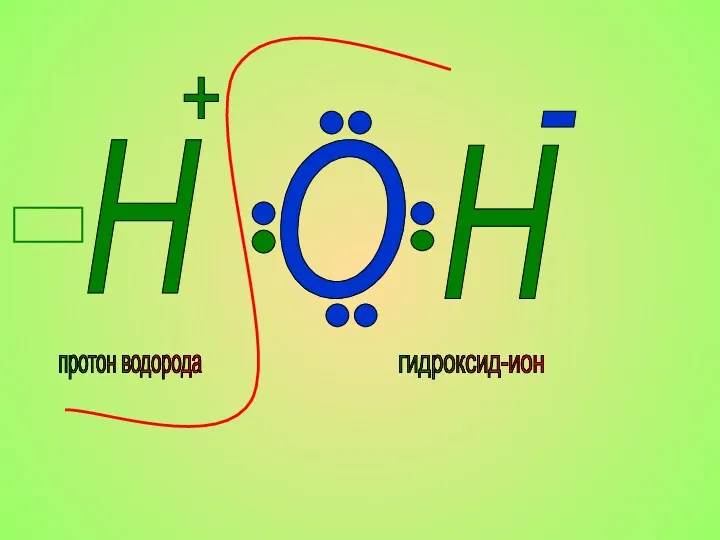
- 21. O H H + - гидроксид-ион протон водорода
- 22. N H H H + H + Донор Акцептор Ион аммония Образовалась ковалентная связь по донорно-акцепторному
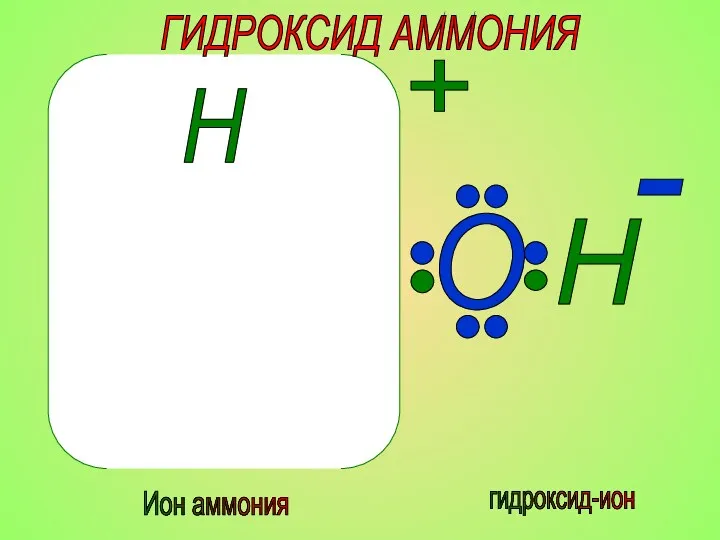
- 23. N H H H Ион аммония O H - гидроксид-ион ГИДРОКСИД АММОНИЯ H +
- 24. В результате взаимодействия аммиака с водой образуется ГИДРОКСИД АММОНИЯ (поэтому фенолфталеин окрашивался в малиновый цвет) Запишите
- 25. Аналогично аммиак реагирует и с соляной кислотой. Запишите уравнение реакции взаимодействия аммиака с HCl. Назовите образовавшуюся
- 26. Выводы: Вид химической связи в молекуле аммиака – КПС. Между молекулами устанавливается ВОДОРОДНАЯ СВЯЗЬ. Аммиак получают
- 28. Скачать презентацию



















 Обмен липидов
Обмен липидов Термопластичные полимеры
Термопластичные полимеры Неметаллы. Азот
Неметаллы. Азот Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів Химиялық кинетика және химиялық тепе-теңдік
Химиялық кинетика және химиялық тепе-теңдік Металлы и Неметаллы
Металлы и Неметаллы Соединения химических элементов. Урок-игра. 8 класс
Соединения химических элементов. Урок-игра. 8 класс Урок 25
Урок 25 Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс Реакции деструкции макромолекул
Реакции деструкции макромолекул Белки. 9 класс
Белки. 9 класс Тепловой эффект химических реакций
Тепловой эффект химических реакций Происхождение химических элементов
Происхождение химических элементов Степень окисления ОВР
Степень окисления ОВР Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Металдар
Металдар Бензен. Номенклатура. Хімічні властивості
Бензен. Номенклатура. Хімічні властивості Реакции элиминирование галогеналканов
Реакции элиминирование галогеналканов Классификация органических соединений. Теория химического строения вещества. 10 класс
Классификация органических соединений. Теория химического строения вещества. 10 класс Измерение и оценка химического фактора. Лекция 9
Измерение и оценка химического фактора. Лекция 9 Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Электрохимические процессы
Электрохимические процессы Кислоты. Электронное пособие для 8-го класса (по учебнику Рудзитис)
Кислоты. Электронное пособие для 8-го класса (по учебнику Рудзитис) Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки
Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки Комплексті қосылыстар
Комплексті қосылыстар Способы выражения состава раствора
Способы выражения состава раствора Изучение физико-химических показателей качества макаронных изделий
Изучение физико-химических показателей качества макаронных изделий