Содержание
- 2. Определение спиртов Классификация спиртов Номенклатура Изомерия Физические свойства Химические свойства Физиологическое действие спиртов Применение спиртов Получение
- 3. Спиртами называются органические вещества, молекулы которых содержат одну или несколько функциональных гидроксильных групп, соединенных с углеводородным
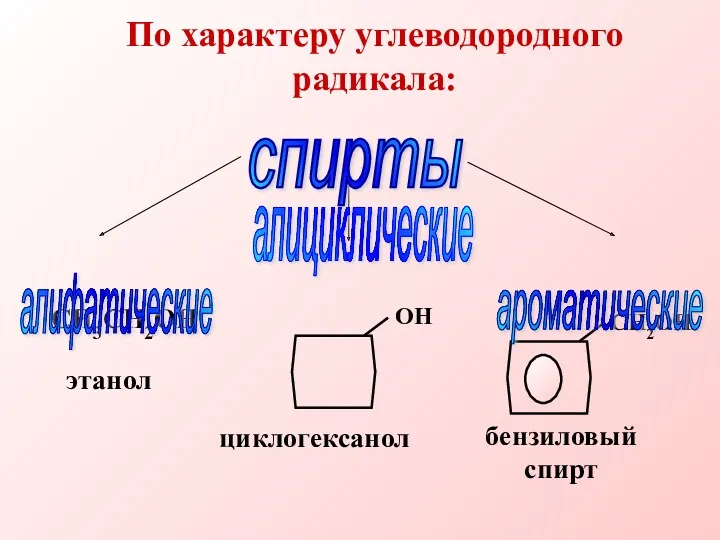
- 4. По характеру углеводородного радикала: СН3СН2ОН спирты алифатические алициклические ароматические циклогексанол бензиловый спирт этанол
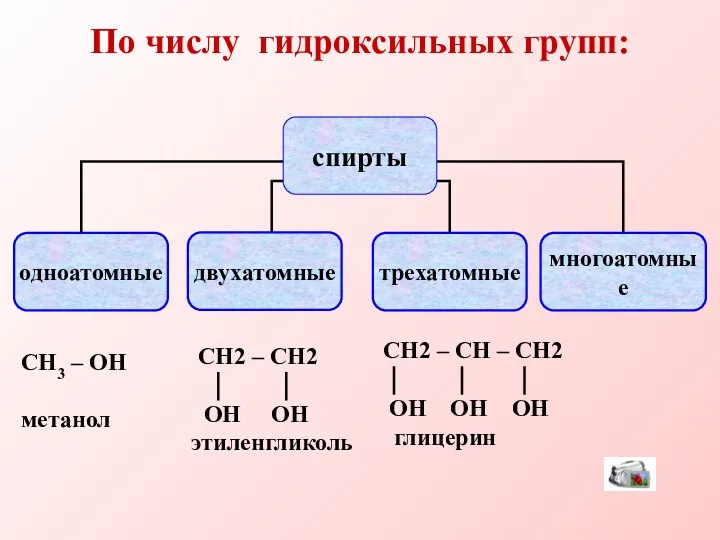
- 5. По числу гидроксильных групп: СН3 – ОН метанол СН2 – СН – СН2 ОН ОН ОН
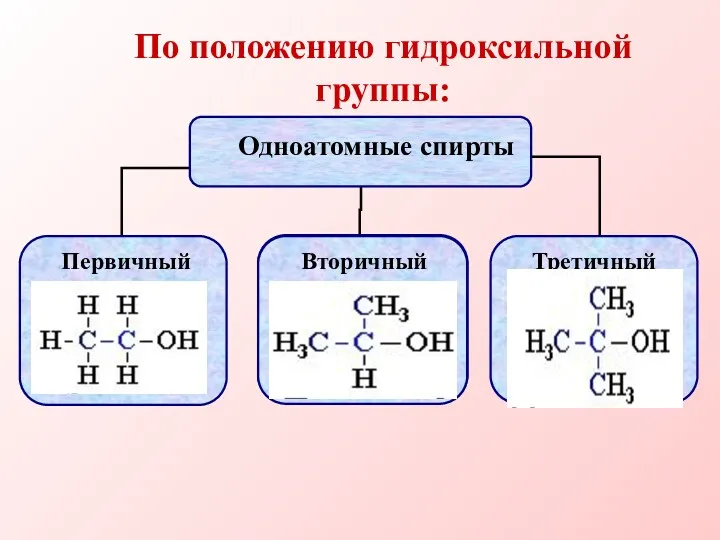
- 6. По положению гидроксильной группы:
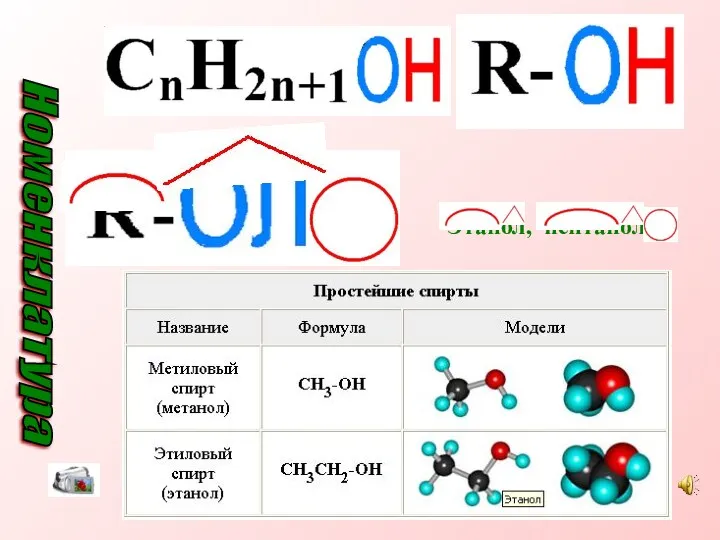
- 7. Этанол, пентанол-2 Номенклатура
- 8. Названия одноатомных спиртов образуются из названия углеводорода с самой длинной углеродной цепью, содержащей гидроксильную группу, путём
- 9. Виды изомерии спиртов Структурная 1. Углеродной цепи 2. Положения функциональной группы
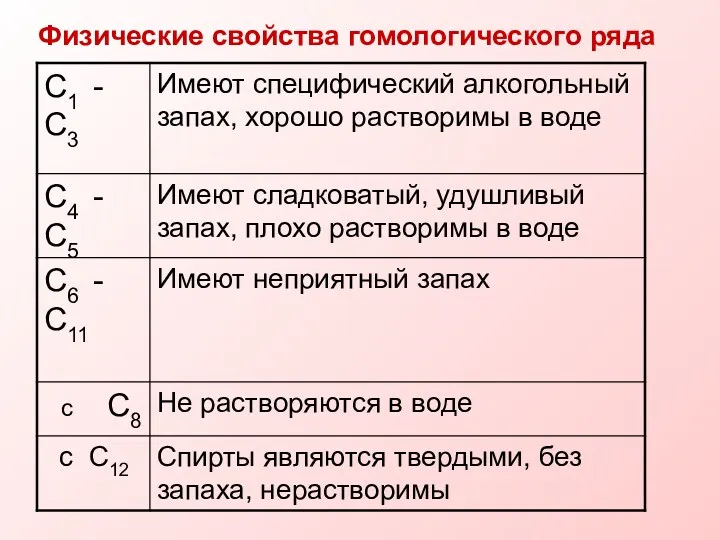
- 10. Физические свойства. Температура кипения спиртов выше температуры кипения соответствующих углеводородов. Среди спиртов нет газов. С увеличением
- 11. Это объясняется наличием межмолекулярной водородной связи, которая может образовываться как между молекулами спиртов, так и между
- 12. Физические свойства гомологического ряда
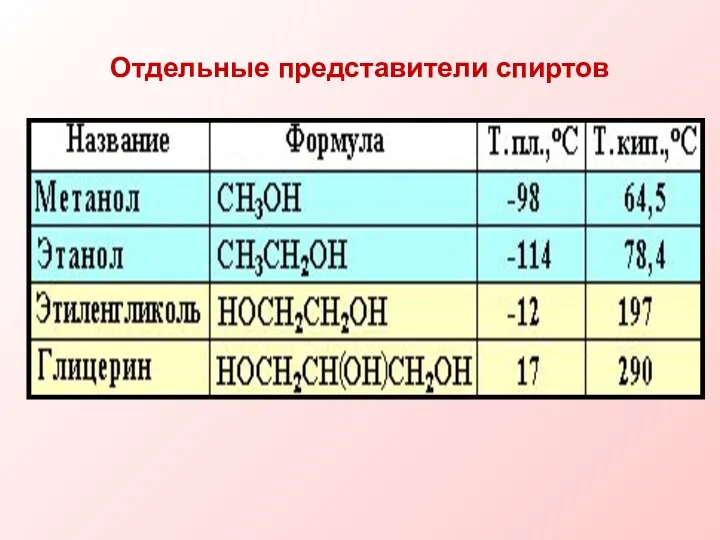
- 13. Отдельные представители спиртов
- 14. Химические свойства Спирты являются амфотерными соединениями. I По связи O – H. 1) Взаимодействие со щелочными
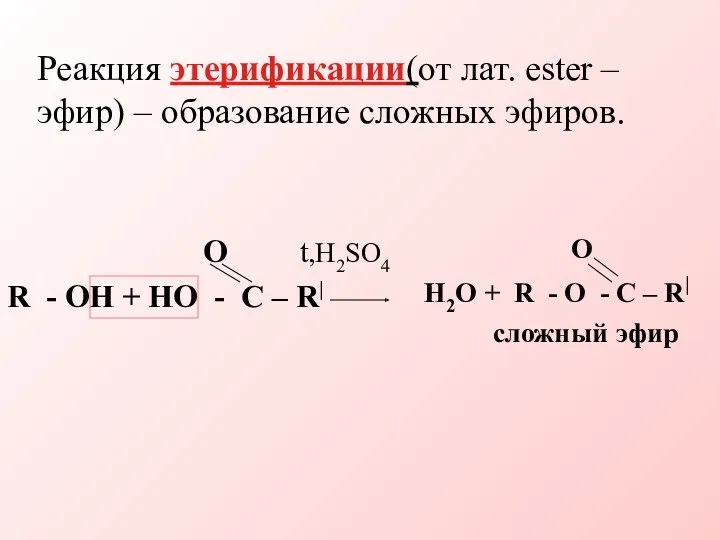
- 15. Реакция этерификации(от лат. ester – эфир) – образование сложных эфиров. O t,H2SO4 R - OH +
- 16. II По связи C – O. Спирты взаимодействуют с галогеноводородами: t° R - OH + H
- 17. Реакции, идущие по нескольким связям одновременно Реакция межмолекулярной дегидратации: H2SO4 (к), t R-OH + HO-R H2O
- 18. Взаимодействие спирта с оксидом меди(II) t O C2H5OH + CuO CH3 – C + Cu +
- 19. Вредное воздействие этанола Изменения структуры мозга, вызванные многолетней алкогольной интоксикацией, почти необратимы, и даже после длительного
- 20. Вредное воздействие этанола Алкоголь крайне неблагоприятно влияет на сосуды головного мозга. В начале опьянения они расширяются,
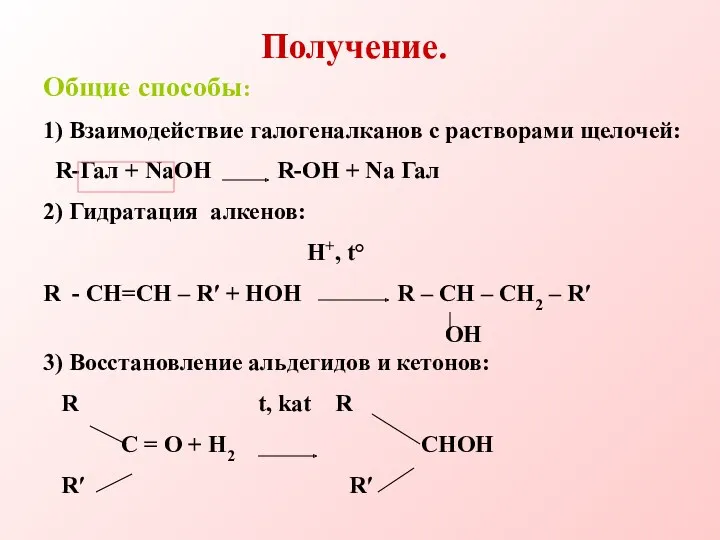
- 21. Получение. Общие способы: 1) Взаимодействие галогеналканов с растворами щелочей: R-Гал + NaOH R-OH + Na Гал
- 22. Получение Частные способы. Метанол получают из синтез – газа. t, P, ZnO CO + 2H2 CH3OH
- 24. Скачать презентацию













 Ртуть и цинк
Ртуть и цинк Драгоценные камни
Драгоценные камни Соли, их классификация и свойства
Соли, их классификация и свойства Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях Теория электролитической диссоциации
Теория электролитической диссоциации Химия и биологическая роль элементов VIIА-группы
Химия и биологическая роль элементов VIIА-группы Студенттің өзіндік жұмысы
Студенттің өзіндік жұмысы Составление уравнений химических реакций. Закон сохранения массы веществ
Составление уравнений химических реакций. Закон сохранения массы веществ Водород
Водород Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Алкени (етиленові вуглеводні, олефіни)
Алкени (етиленові вуглеводні, олефіни) Коррозия металлов
Коррозия металлов Строение, свойства и применение алкенов
Строение, свойства и применение алкенов Дистилляция в химической промышленности
Дистилляция в химической промышленности Хлорид натрия (NaCI)
Хлорид натрия (NaCI) Кислород. Озон. Получение кислорода
Кислород. Озон. Получение кислорода Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар
Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар 20230802_stroenie_atoma_avtosohranennyy_2
20230802_stroenie_atoma_avtosohranennyy_2 Хімічні властивості алкенів
Хімічні властивості алкенів Биоразлагаемые ПАВ. Лекция 2
Биоразлагаемые ПАВ. Лекция 2 Принципы наноармирования волокнистых композитов
Принципы наноармирования волокнистых композитов Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Альдегиды и кетоны
Альдегиды и кетоны Искусственная и синтетическая резина
Искусственная и синтетическая резина Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Задачи на избыток-недостаток
Задачи на избыток-недостаток Синтетический каучук и его применение
Синтетический каучук и его применение