Слайд 2
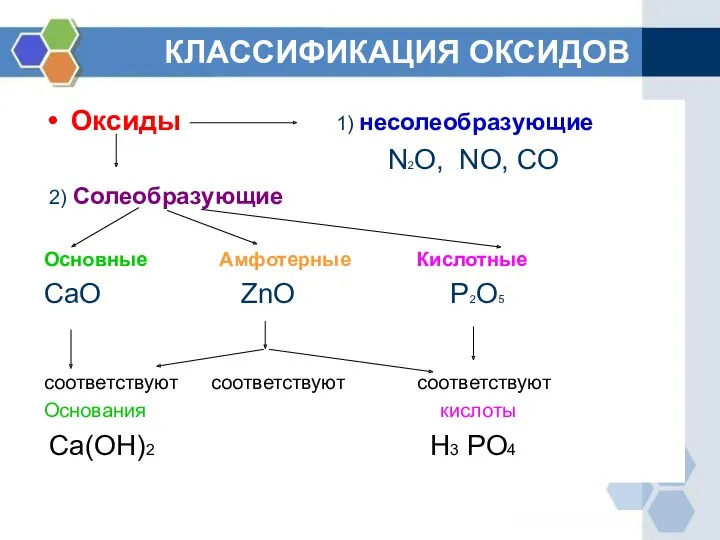
КЛАССИФИКАЦИЯ ОКСИДОВ
Оксиды 1) несолеобразующие
N2O, NO, CO
2) Солеобразующие
Основные Амфотерные Кислотные
CaO
ZnO P2O5
соответствуют соответствуют соответствуют
Основания кислоты
Ca(OH)2 H3 PO4
Слайд 3

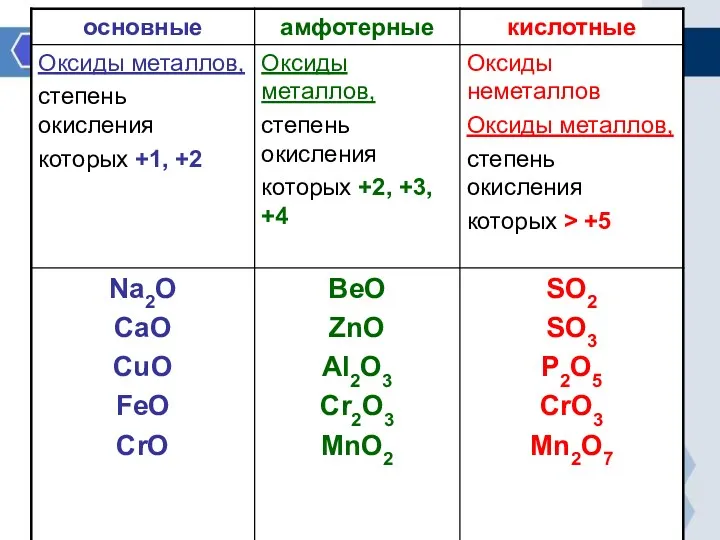
ОПРЕДЕЛЕНИЕ ГРУПП ОКСИДОВ
Основными называются оксиды, которые образуют соли при взаимодействии с
кислотами или кислотными оксидами.
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами.
Амфотерными оксидами, называют оксиды которые проявляют свойства как кислот, так и оснований.
Слайд 4
Слайд 5

НАПИСАТЬ ХИМИЧЕСКИЕ ФОРМУЛЫ ОКСИДОВ
1)Оксид серы(IV)
2)Оксид азота(V)
3)Оксид калия (I)
4)Оксид железа(II)
5)Оксид фосфора(V)
6) оксид натрия (I)
Слайд 6
ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
ТВЕРДЫЕ
ЖИДКИЕ
ГАЗООБРАЗНЫЕ
Слайд 7

ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.)
1) О.О. + кислота =соль + вода
(реакция обмена)
CaO + H2 SO4 → CaSO4 + H2O
2) О.О. + кислотный оксид = соль
(реакция соединения)
СaO + SiO2 = CaSiO3
3) О.О.(раств) + вода = основание (щелочь)
(реакция соединения)
Na2O + H2O → 2NaOH
Слайд 8
![Основный оксид + H2O = щелочь [p] Запомни! Li2O +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/589288/slide-7.jpg)
Основный оксид + H2O = щелочь [p]
Запомни!
Li2O + H2O = 2LiOH
Na2O
+ H2O = 2NaOH едкий натр, каустик
K2O + H2O = 2KOH едкое кали
СаО + Н2О = Са(ОН)2 гашеная известь
негашеная известь известковая вода
ВаО + Н2О = Ва(ОН)2 баритовая вода
Слайд 9
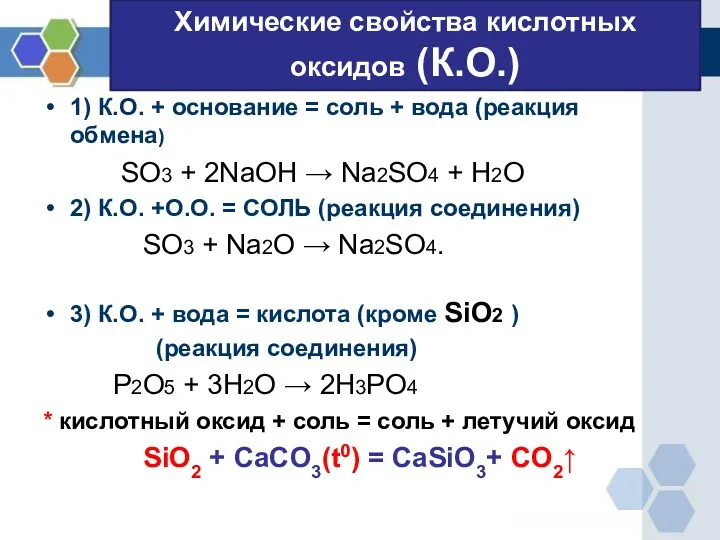
Химические свойства кислотных оксидов (К.О.)
1) К.О. + основание = соль +
вода (реакция обмена)
SO3 + 2NaOH → Na2SO4 + H2O
2) К.О. +О.О. = СОЛЬ (реакция соединения)
SO3 + Na2O → Na2SO4.
3) К.О. + вода = кислота (кроме SiO2 )
(реакция соединения)
P2O5 + 3H2O → 2H3PO4
* кислотный оксид + соль = соль + летучий оксид
SiO2 + CaCO3(t0) = CaSiO3+ CO2↑
Слайд 10

Кислотный оксид + вода = кислота
Запомни!
СО2 + Н2О ↔ Н2СО3
(Н2О + СО2↑)
SО2 + Н2О ↔ Н2SО3 (Н2О + SО2↑)
SО3 + Н2О → Н2SО4
N2O5 + Н2О → 2HNO3
P2O5 + 3Н2О → 2H3PO4
Эти оксиды реагируют с водой и образуют кислоты!
-------------------------------------------------------------------------
SiО2 (песок, кварц, кремнезем ← Н2SiО3↓ не взаимодействует с водой)
Слайд 11

Амфотерные оксиды
1) с кислотами как основные
ZnO + 2HCl = ZnCl2
+ H2O
2) с основаниями как кислотные
ZnO + 2NaOH = Na2ZnO + H2O
(цинкат натрия)
Слайд 12
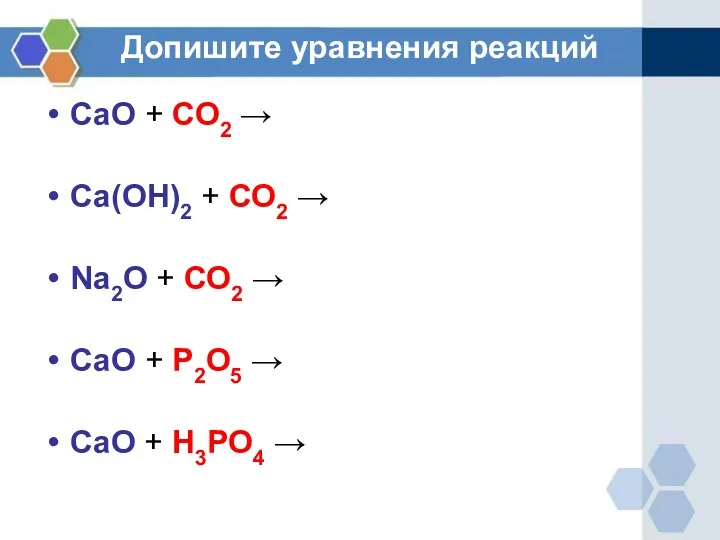
Допишите уравнения реакций
СаО + СО2 →
Са(ОН)2 + СО2 →
Nа2О
+ СО2 →
СаО + P2О5 →
CaO + H3PO4 →
Слайд 13
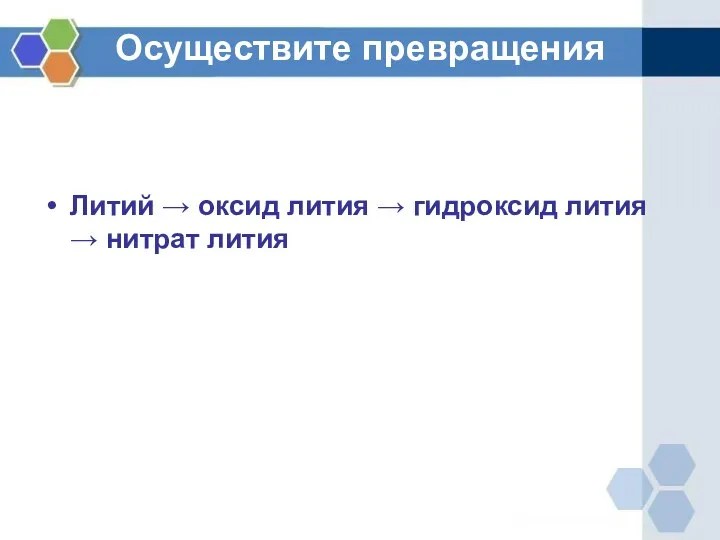
Осуществите превращения
Литий → оксид лития → гидроксид лития → нитрат лития
Слайд 14
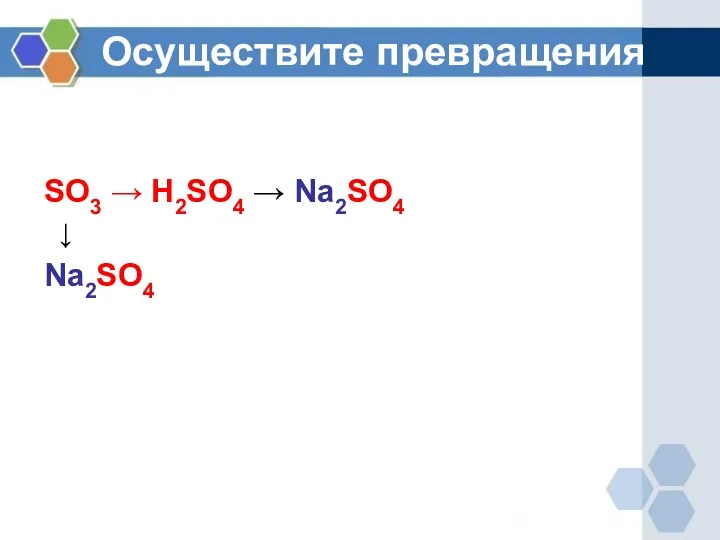
Осуществите превращения
SO3 → H2SO4 → Na2SO4
↓
Na2SO4
Слайд 15
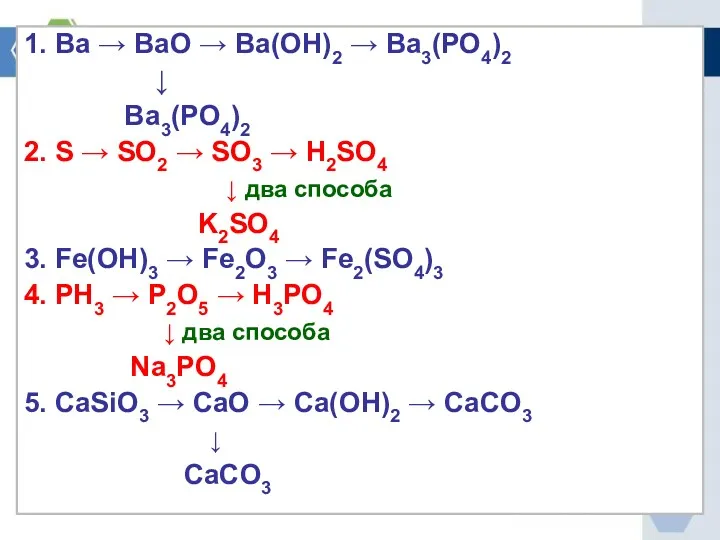
1. Ва → ВаО → Ва(ОН)2 → Ва3(РО4)2
↓
Ва3(РО4)2
2. S
→ SO2 → SO3 → H2SO4
↓ два способа
K2SO4
3. Fe(OH)3 → Fe2O3 → Fe2(SO4)3
4. РН3 → Р2О5 → Н3РО4
↓ два способа
Na3PO4
5. CaSiO3 → CaO → Ca(OH)2 → CaCO3
↓
CaCO3
Слайд 16
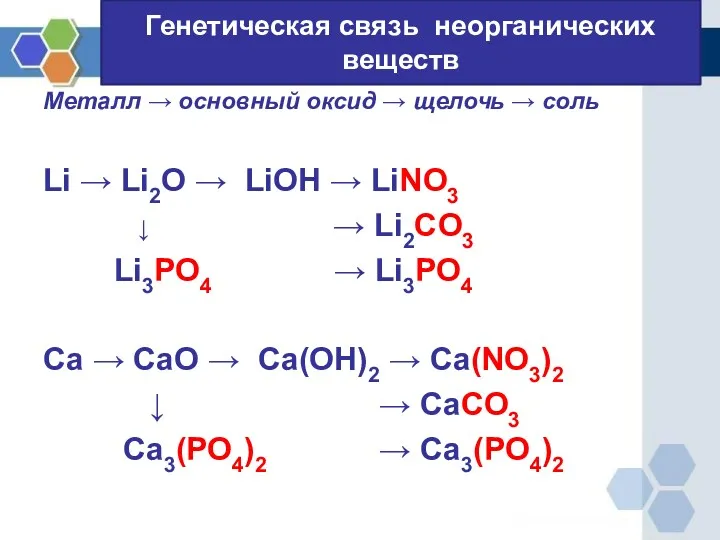
Генетическая связь неорганических веществ
Металл → основный оксид → щелочь → соль
Li
→ Li2O → LiOH → LiNO3
↓ → Li2CO3
Li3PO4 → Li3PO4
Ca → CaO → Ca(OH)2 → Ca(NO3)2
↓ → CaCO3
Ca3(PO4)2 → Ca3(PO4)2
Слайд 17
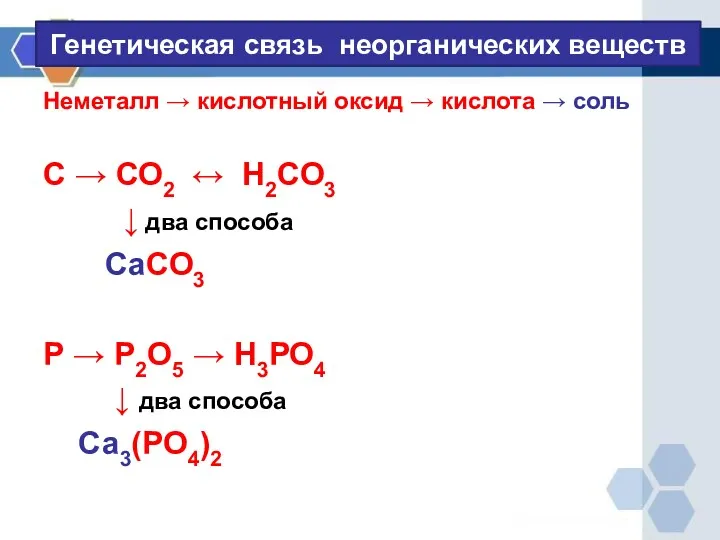
Генетическая связь неорганических веществ
Неметалл → кислотный оксид → кислота → соль
С
→ СО2 ↔ Н2СО3
↓ два способа
СаСО3
Р → Р2О5 → Н3РО4
↓ два способа
Са3(РО4)2






![Основный оксид + H2O = щелочь [p] Запомни! Li2O +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/589288/slide-7.jpg)









 Углеводы. Моносахариды
Углеводы. Моносахариды Реакции ионного обмена
Реакции ионного обмена Индикаторные ошибки кислотно-основного титрования
Индикаторные ошибки кислотно-основного титрования Донорно-акцепторний механізм утворення ковалентного зв’язку
Донорно-акцепторний механізм утворення ковалентного зв’язку История развития и предмет исследования супрамолекулярной химии. Классификация супрамолекулярных соединений
История развития и предмет исследования супрамолекулярной химии. Классификация супрамолекулярных соединений Кислород и озон
Кислород и озон Углеводороды из Башкортостана
Углеводороды из Башкортостана Электролиз. Области использования электролиза
Электролиз. Области использования электролиза Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях Производные фенантренизохинолина
Производные фенантренизохинолина Строение, свойства и классификация аминокислот. Лекция 2
Строение, свойства и классификация аминокислот. Лекция 2 Ионная химическая связь
Ионная химическая связь Строение и переваривание липидов. Классификация и роль жирных кислот. Нутриомика. Липофильных соединений
Строение и переваривание липидов. Классификация и роль жирных кислот. Нутриомика. Липофильных соединений Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі
Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі О проекте концепции преподавания химии в РФ
О проекте концепции преподавания химии в РФ Обратимость химических реакций. Химическое равновесие и способы его смещения
Обратимость химических реакций. Химическое равновесие и способы его смещения Открытие новых химических элементов с атомными номерами 113, 115, 117 и 118
Открытие новых химических элементов с атомными номерами 113, 115, 117 и 118 Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас
Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас Реакции ионного обмена
Реакции ионного обмена Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів Термические процессы нефтепереработки
Термические процессы нефтепереработки Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом Медь, цинк, хром. Обобщающий урок
Медь, цинк, хром. Обобщающий урок Общая характеристика металлов. Металлическая связь
Общая характеристика металлов. Металлическая связь Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары
Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары Алкены. Химические свойства алкенов
Алкены. Химические свойства алкенов Основания (3)
Основания (3)