Содержание
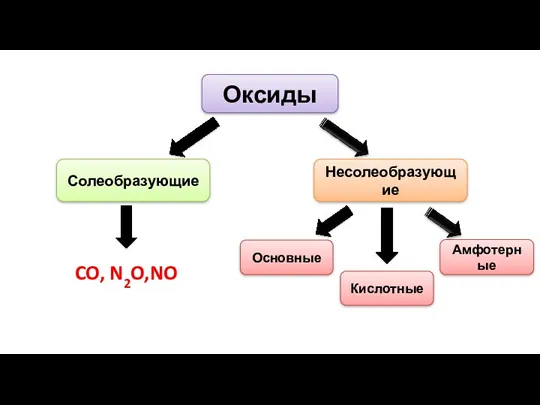
- 2. Оксиды Солеобразующие Несолеобразующие CO, N2O,NO Основные Амфотерные Кислотные
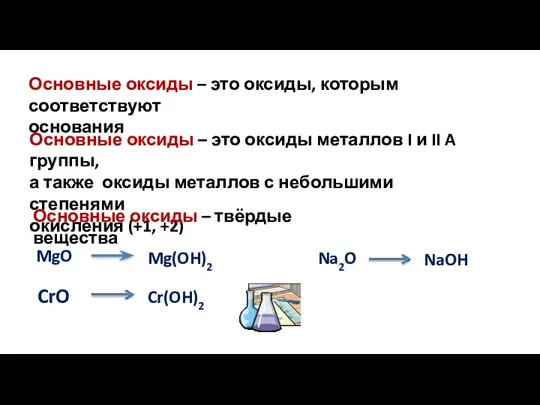
- 3. Основные оксиды – это оксиды, которым соответствуют основания Основные оксиды – это оксиды металлов I и
- 4. CuO + H2SO4 = CuSO4 + H2O Реакция основных оксидов с кислотами Основный оксид + кислота
- 5. CO2 + Ca(OH)2 = CaCO3↓ + H2O CO2 + Ca2+ + 2OH- = CaCO3↓ + H2O
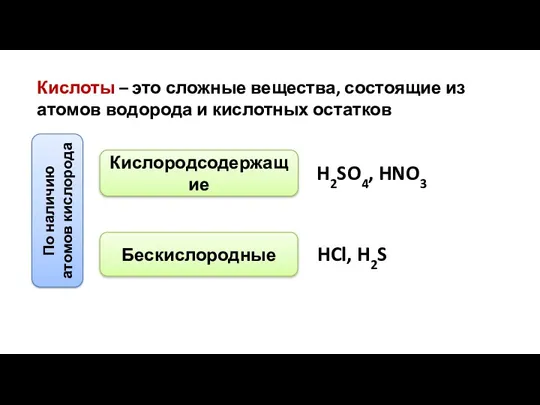
- 6. Кислоты – это сложные вещества, состоящие из атомов водорода и кислотных остатков По наличию атомов кислорода
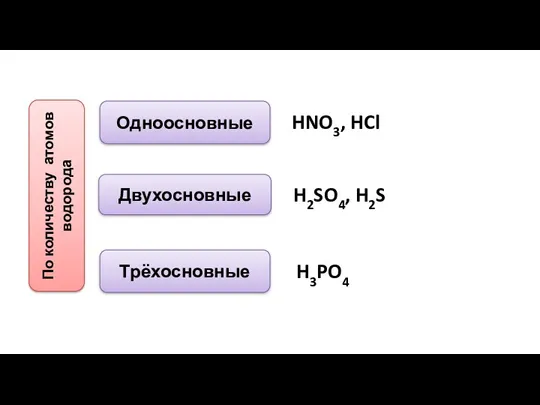
- 7. По количеству атомов водорода Одноосновные Двухосновные Трёхосновные HNO3, HCl H2SO4, H2S H3PO4
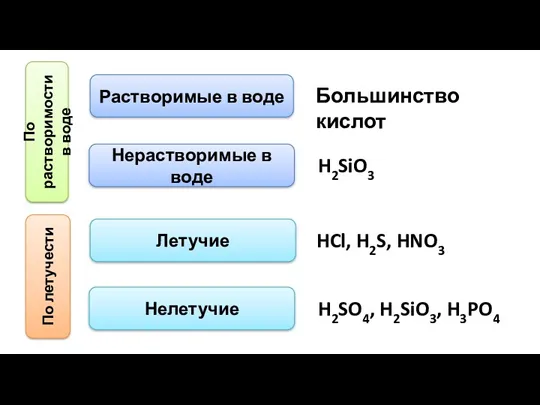
- 8. По растворимости в воде Растворимые в воде Нерастворимые в воде Большинство кислот H2SiO3 По летучести Летучие
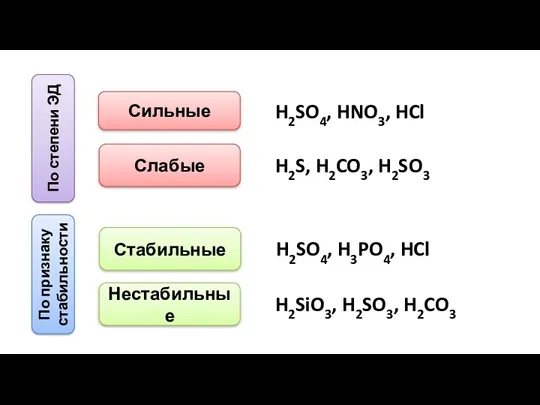
- 9. По степени ЭД Сильные Слабые H2SO4, HNO3, HCl H2S, H2CO3, H2SO3 По признаку стабильности Стабильные Нестабильные
- 10. Реакция с основаниями Кислота + основание = соль + вода NaOH + HCl = NaCl +
- 11. Основания – это электролиты, при диссоциации которых в качестве катионов выступают катионы металла (или аммония), а
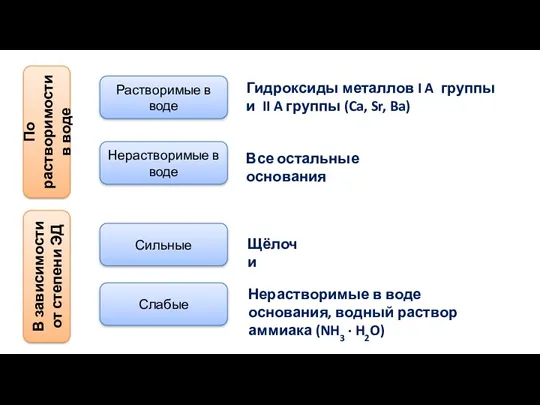
- 12. По растворимости в воде Растворимые в воде Нерастворимые в воде Гидроксиды металлов I A группы и
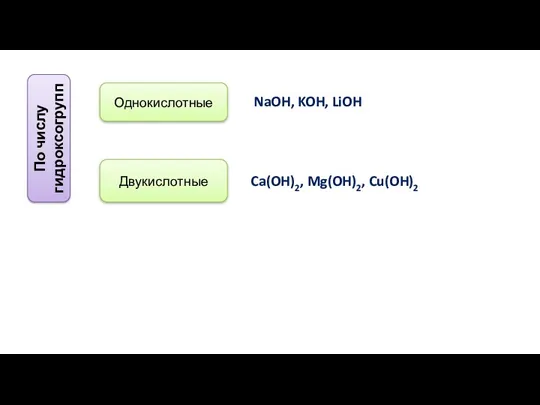
- 13. По числу гидроксогрупп Однокислотные Двукислотные NaOH, KOH, LiOH Ca(OH)2, Mg(OH)2, Cu(OH)2
- 14. Реакции оснований с кислотами (реакции обмена) Основание + кислота = соль + вода NaOH + HCl
- 15. Na2CO3 – карбонат натрия Al2(SO4)3 – сульфат алюминия Ba(NO3)2 – нитрат бария CaCl2 – хлорид кальция
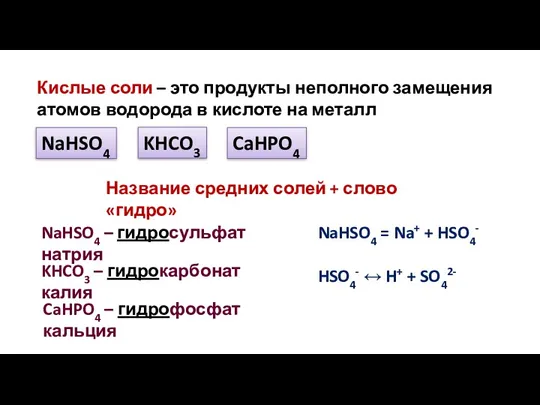
- 16. Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл NaHSO4 KHCO3 CaHPO4
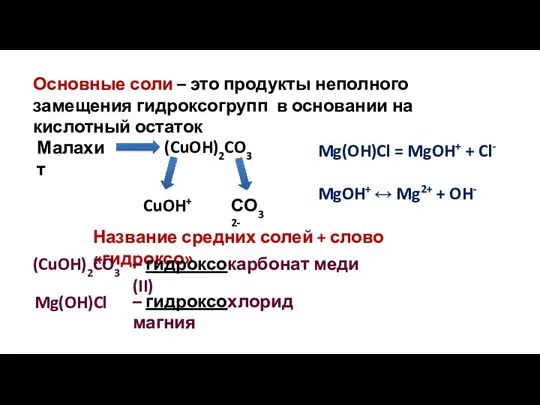
- 17. Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток (CuOH)2CO3 Малахит CuOH+
- 18. Реакция солей с кислотами Соль + кислота = новая соль + новая кислота Na2SiO3 + H2SO4
- 19. Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4 Fe3+ + 3OH- = Fe(OH)3↓ (NH4)2SO4 + 2KOH =
- 20. Реакция солей с металлами Соль + металл = другая соль + другой металл
- 22. Скачать презентацию









 Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Магия кристаллов
Магия кристаллов Пластмаси. Види пластмас. (11 клас)
Пластмаси. Види пластмас. (11 клас) Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ Производство полимеров
Производство полимеров Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте
Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте Геохимия гидротермального процесса
Геохимия гидротермального процесса Защита металлоконструкций от коррозии
Защита металлоконструкций от коррозии Химия металлов: влияние металлов на организм человека
Химия металлов: влияние металлов на организм человека Типы химических реакций
Типы химических реакций Органическая химия
Органическая химия Химия титанорганических соединений
Химия титанорганических соединений Соли и их свойства
Соли и их свойства Соединения серы
Соединения серы Химическая связь
Химическая связь Нанотехнологии в школьном образовании. Семинар учителей химии
Нанотехнологии в школьном образовании. Семинар учителей химии Генетическая связь между классами веществ
Генетическая связь между классами веществ Беломорская соль, проектная работа
Беломорская соль, проектная работа Химические свойства спиртов
Химические свойства спиртов Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока
Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока Арилалкиламины, гидроксифенилалкиламины и их производные
Арилалкиламины, гидроксифенилалкиламины и их производные Значение органической химии в жизни человека
Значение органической химии в жизни человека Классификация химических реакций
Классификация химических реакций Полезные геологические химические соединения. Получение меди из малахита
Полезные геологические химические соединения. Получение меди из малахита Механическая смесь и растворы
Механическая смесь и растворы Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений
Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений Применение солей
Применение солей Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс