Слайд 2

Ответьте на вопросы:
Охарактеризуйте положение металлов в ПС и особенности строения их
атомов.
Что такое металлическая связь? Какие электроны называют свободными? Особенности металлической кристаллической решётки.
Перечислите основные физические свойства металлов. Чем они обусловлены?
Назовите: самый тяжелый и самый лёгкий металл; самый легкоплавкий и тугоплавкий; мягкий и самый твёрдый металл; самый блестящий; самый пластичный; лучшие проводники тепла и электричества.
Слайд 3

Взаимодействие металлов с неметаллами и водой
Реакции соединения, экзотермические, для большинства требуется
нагревание, -ид
Закончите уравнения, назовите продукты:
Ag + O2 → Li + N2 →
Al + C → Mg + Si →
Zn + S → Ca + P →
Ва + H2 → Fe + Cl2 →
Составьте по два уравнения реакций взаимодействия металлов с водой (до и после Al), укажите окислитель и восстановитель.
Слайд 4

Взаимодействие металлов с кислотами
Закончите уравнения возможных реакций, составьте ионные уравнения:
Ca +
HCl → Ag + HF →
Al + H2SO4 (p-p) → Fe + HBr →
Ba + H3PO4 → Mg + H2SO4 (p-p) →
Взаимодействие с азотной и серной конц.
Cu + HCl + O2 →
Au + HNO3 + HCl →
Слайд 5

Взаимодействие металлов с растворами солей
Закончите уравнения возможных реакций, укажите окислитель и
восстановитель, составьте ионные уравнения:
Mg + CoCl2 → Cu + AgCl →
Sn + FeCl2 → Ni + AgNO3 →
Fe + Cu(NO3)2 → Pb + CrSO4 →
Взаимодействие с солями-окислителями:
за счет аниона: Mg + KClO3 →
Al + KNO3 →
за счет катиона: Cu + FeCl3 →
Слайд 6

Взаимодействие со щелочами
Al, Zn, Be; Fe с трудом (длительное кипячение с
концентрированным раствором)
Al + NaOH + H2O → NaAlO2 + H2 (сплавление)
Al + NaOH + H2O → Na[Al(OH)4] + H2 (при недостатке щелочи)
Al + NaOH + H2O → Na3[Al(OH)6] + H2 (в избытке щелочи)
Взаимодействие с оксидами
Mg + SiO2 →
Al + Cr2O3 →
Слайд 7

Взаимодействие с органическими веществами
С веществами с кислотными свойствами:
Ацетиленовые углеводороды
Спирты
Фенолы
Карбоновые кислоты
С галогенпроизводными
углеводородов
Реакция Вюрца (внутри- и межмолекулярная)
Получение реактива Гриньяра
Получение тетраэтилсвинца
С2Н5Cl + Pb(Na) (сплав) → Pb(C2H5)4 + NaCl






 Алкани. Ізомерія та номенклатура алканів
Алкани. Ізомерія та номенклатура алканів Карбоновые кислоты
Карбоновые кислоты Organic molecules
Organic molecules Прикладные аспекты химии поверхностно-активных веществ
Прикладные аспекты химии поверхностно-активных веществ Щелочноземельные металлы
Щелочноземельные металлы Комплексные соединения
Комплексные соединения Оксиды. 8 класс
Оксиды. 8 класс Альдегиды и кетоны
Альдегиды и кетоны Метал конструкциялық материалдар
Метал конструкциялық материалдар Роль полимеров в нашей жизни
Роль полимеров в нашей жизни Формы залегания метаморфических пород
Формы залегания метаморфических пород Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості Классификация кристаллов по типу химической связи
Классификация кристаллов по типу химической связи Соли как производные кислот и оснований
Соли как производные кислот и оснований Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Алкены. Пропилен (пропен)
Алкены. Пропилен (пропен) Бензин. Физико-химические свойства бензина
Бензин. Физико-химические свойства бензина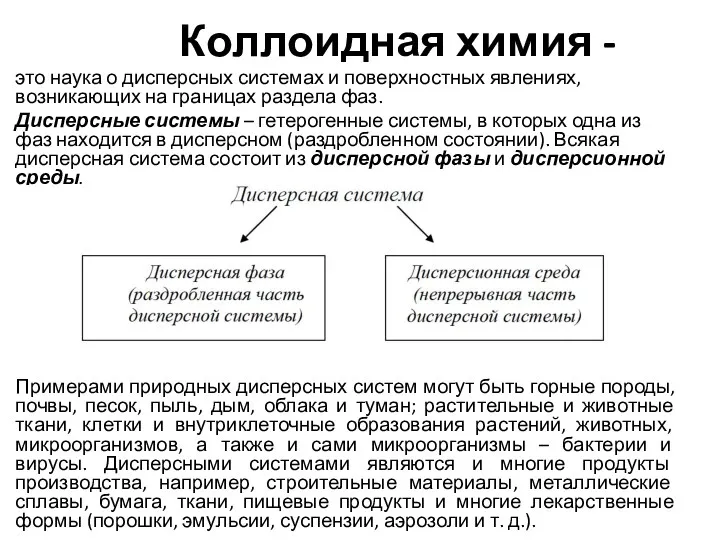 Коллоидная химия
Коллоидная химия Химическая кинетика
Химическая кинетика Колебания кристаллической решетки и ее тепловые свойства. Тепловые свойства
Колебания кристаллической решетки и ее тепловые свойства. Тепловые свойства Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Химия и сельское хозяйство
Химия и сельское хозяйство Вычисление массовой доли растворенного вещества. 8 класс
Вычисление массовой доли растворенного вещества. 8 класс Тема 9 - Азотсодержащие и гетероциклические органические соединения
Тема 9 - Азотсодержащие и гетероциклические органические соединения Соляные породы
Соляные породы Каталитический риформинг
Каталитический риформинг Химико-лесной комплекс
Химико-лесной комплекс Коррозия металлов
Коррозия металлов