Содержание
- 2. Карбоновые кислоты – органические соединения, имеющие в качестве старшей функциональной группы группу -СOOH Классификация : По
- 3. Номенклатура: Систематическая Заместители с указанием местоположения (по возрастанию позиции) + корень названия углеводорода основной цепи +
- 4. 2. Рациональная а) На базе второго гомолога ряда (уксусная кислота) путем перечисления связанных со скелетом уксусной
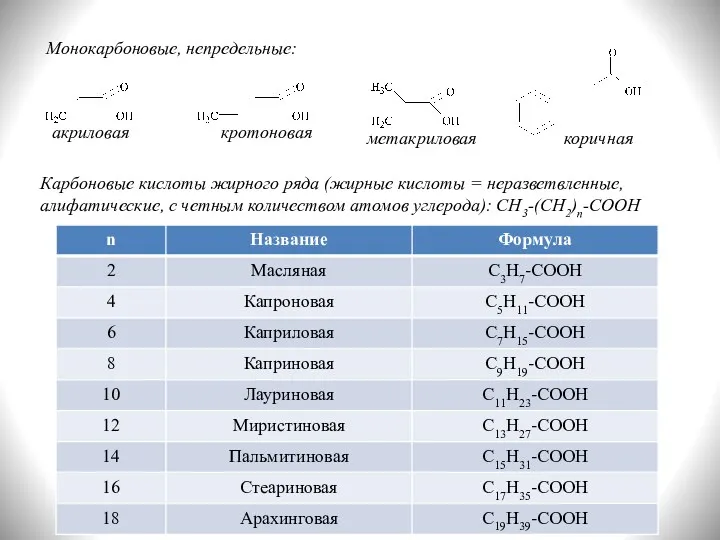
- 5. Монокарбоновые, непредельные: акриловая кротоновая метакриловая коричная Карбоновые кислоты жирного ряда (жирные кислоты = неразветвленные, алифатические, с
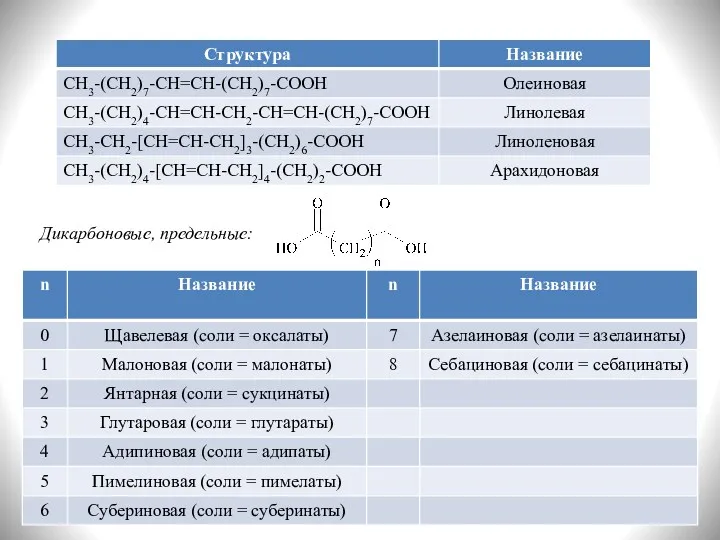
- 6. Дикарбоновые, предельные:
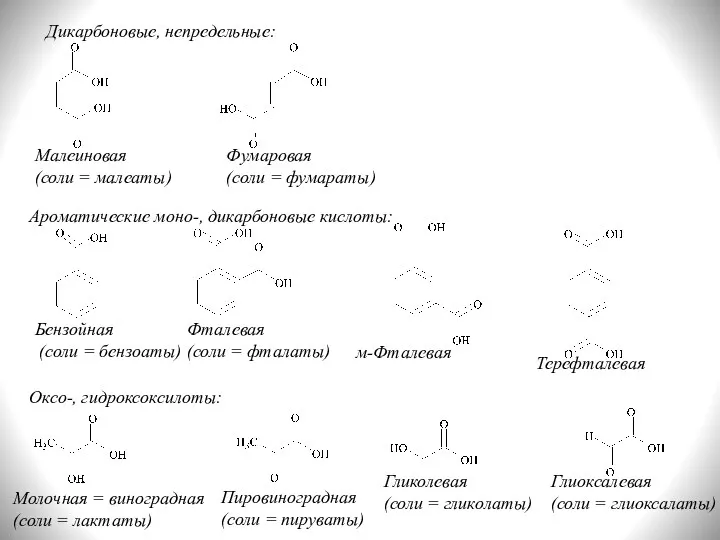
- 7. Дикарбоновые, непредельные: Малеиновая (соли = малеаты) Фумаровая (соли = фумараты) Ароматические моно-, дикарбоновые кислоты: Бензойная (соли
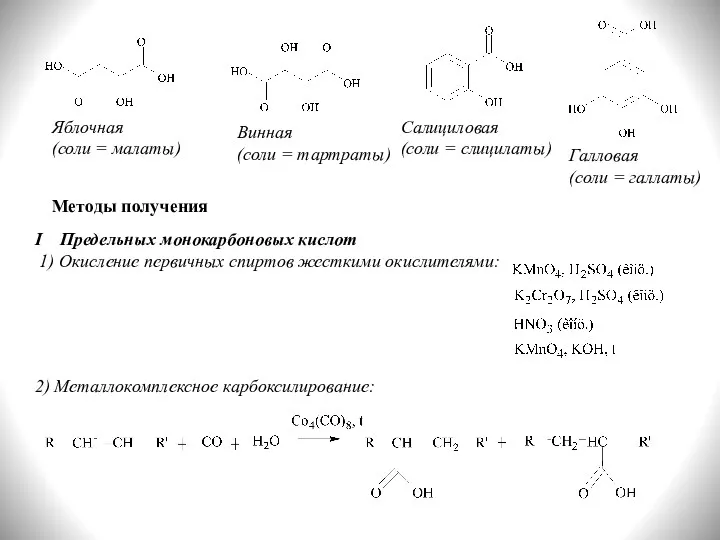
- 8. Методы получения I Предельных монокарбоновых кислот 1) Окисление первичных спиртов жесткими окислителями: Яблочная (соли = малаты)
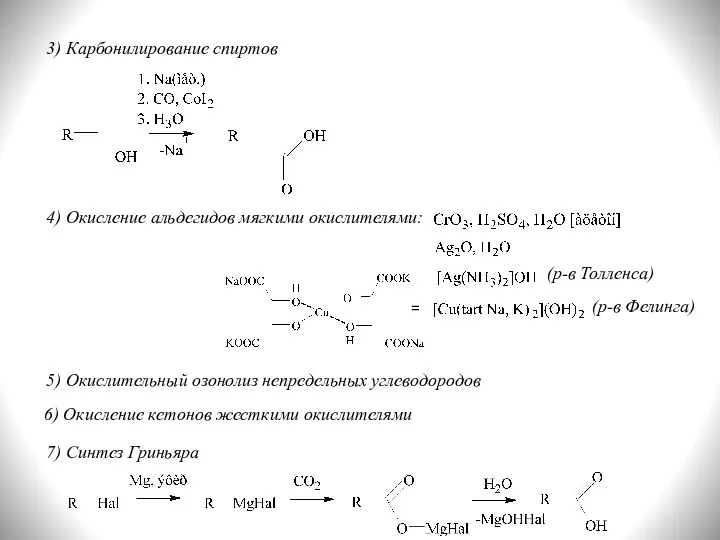
- 9. 3) Карбонилирование спиртов 4) Окисление альдегидов мягкими окислителями: (р-в Толленса) (р-в Фелинга) = 5) Окислительный озонолиз
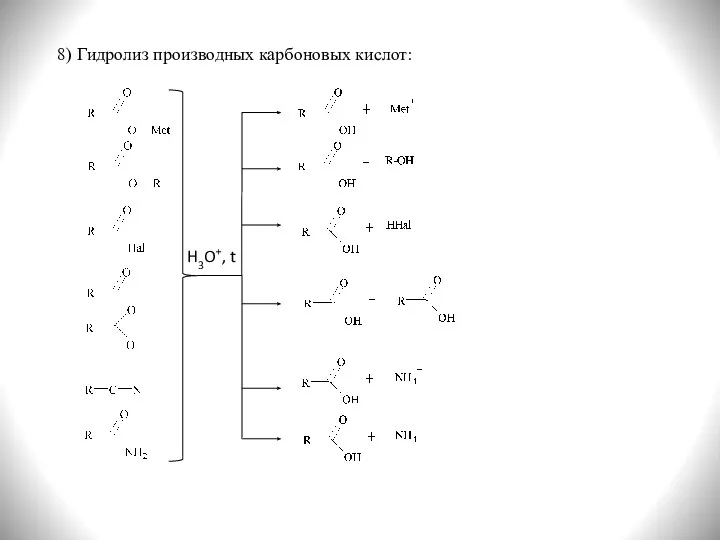
- 10. 8) Гидролиз производных карбоновых кислот: H3O+, t
- 11. 9) Гидролиз геминальных тригалогенпроизводных 10) Промышленное получение муравьиной кислоты 11) Промышленное получение уксусной кислоты
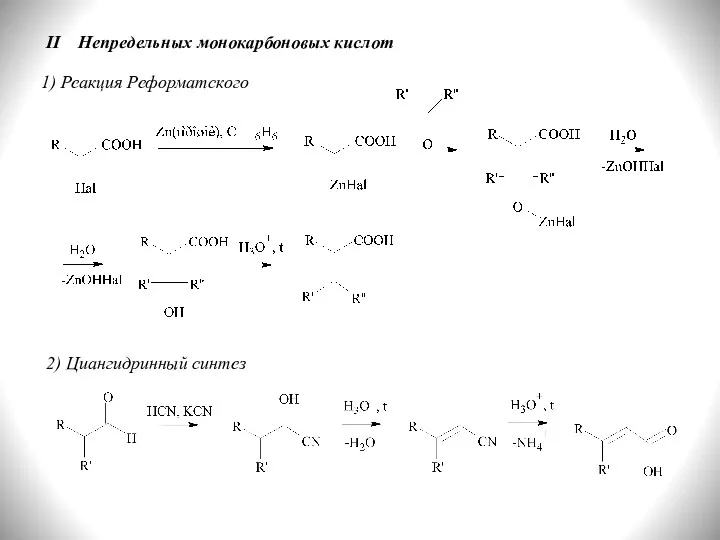
- 12. II Непредельных монокарбоновых кислот 1) Реакция Реформатского 2) Циангидринный синтез
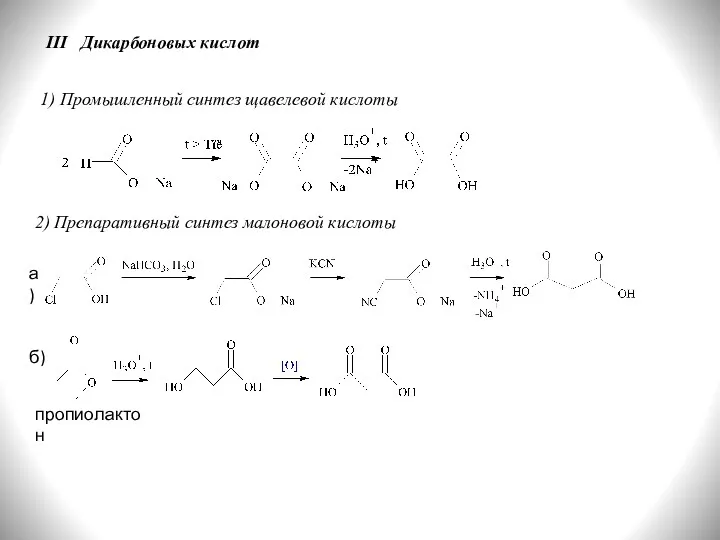
- 13. III Дикарбоновых кислот 1) Промышленный синтез щавелевой кислоты 2) Препаративный синтез малоновой кислоты а) б) пропиолактон
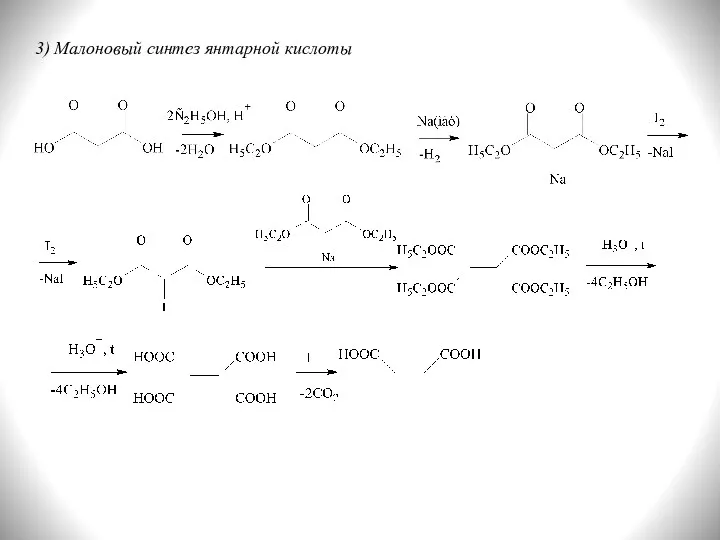
- 14. 3) Малоновый синтез янтарной кислоты
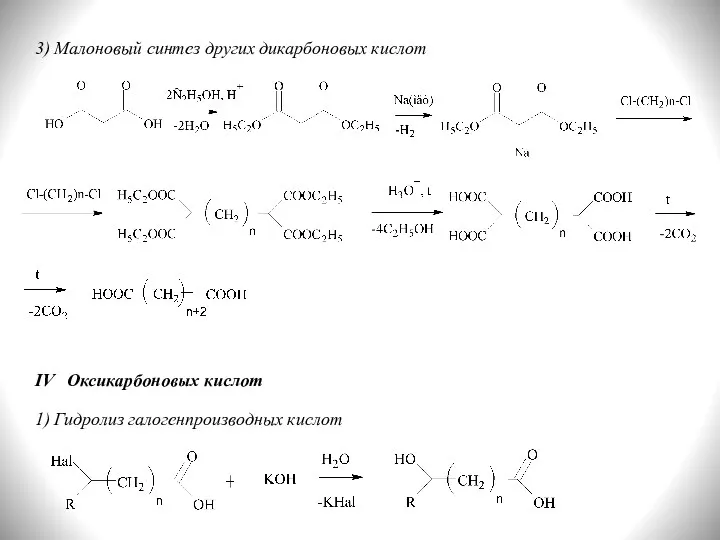
- 15. 3) Малоновый синтез других дикарбоновых кислот IV Оксикарбоновых кислот 1) Гидролиз галогенпроизводных кислот
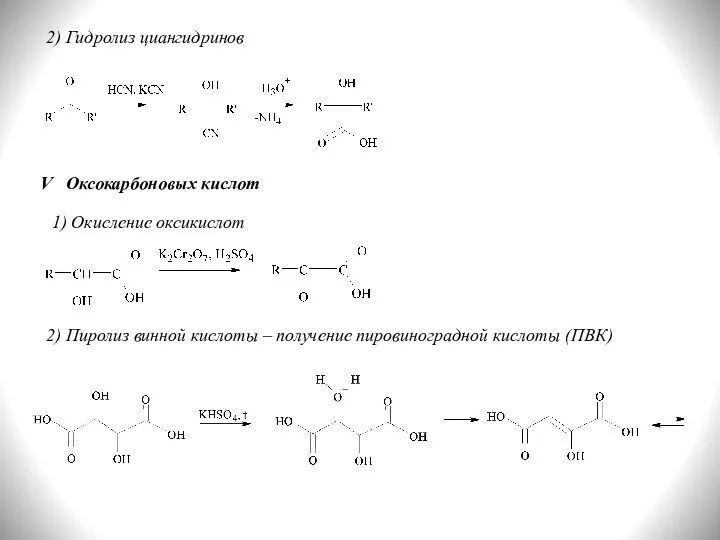
- 16. 2) Гидролиз циангидринов V Оксокарбоновых кислот 1) Окисление оксикислот 2) Пиролиз винной кислоты – получение пировиноградной
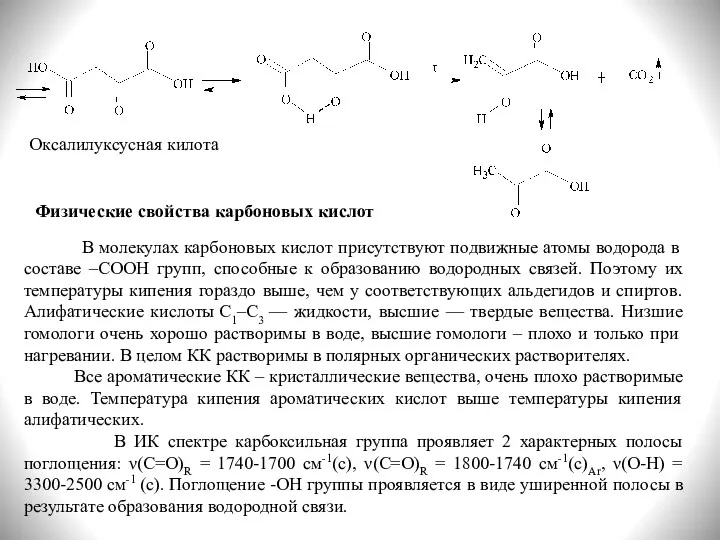
- 17. Оксалилуксусная килота Физические свойства карбоновых кислот В молекулах карбоновых кислот присутствуют подвижные атомы водорода в составе
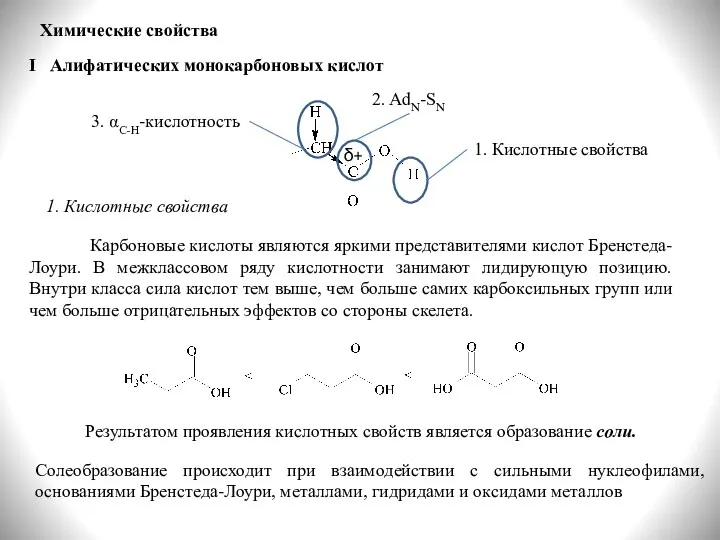
- 18. Химические свойства 1. Кислотные свойства δ+ 2. AdN-SN 3. αС-Н-кислотность 1. Кислотные свойства Карбоновые кислоты являются
- 19. 2. Реакции AdN-SN AdN-SN - нуклеофильное присоединение с последующим замещением. Осуществляется при взаимодействии со слабыми нуклеофилами
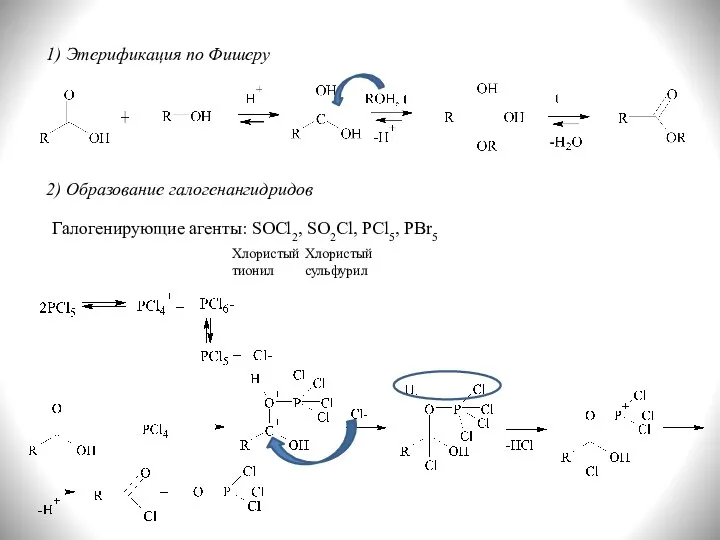
- 20. 1) Этерификация по Фишеру 2) Образование галогенангидридов Галогенирующие агенты: SOCl2, SO2Cl, PCl5, PBr5 Хлористый сульфурил Хлористый
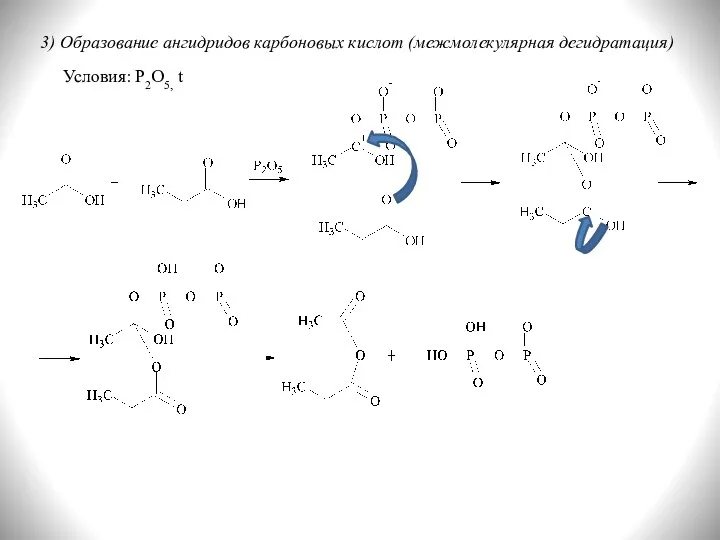
- 21. 3) Образование ангидридов карбоновых кислот (межмолекулярная дегидратация) Условия: P2O5, t
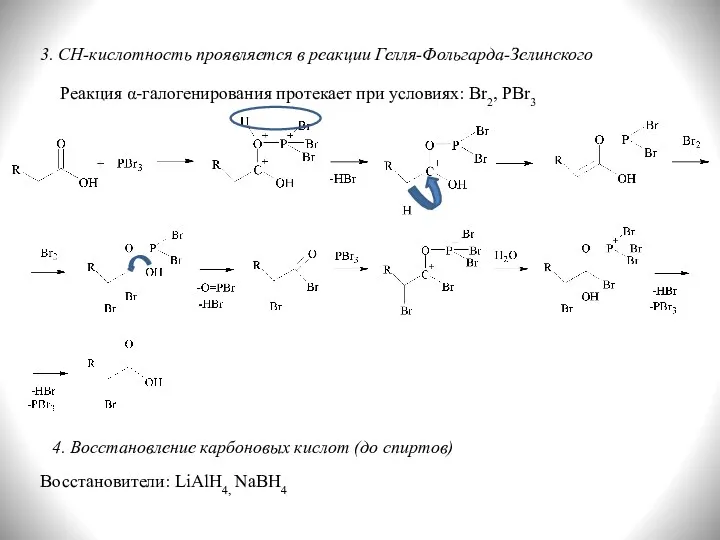
- 22. 3. СН-кислотность проявляется в реакции Гелля-Фольгарда-Зелинского Реакция α-галогенирования протекает при условиях: Br2, PBr3 4. Восстановление карбоновых
- 23. II Алифатических дикарбоновых кислот 1. Щавелевая кислота Прямая связь карбоксильных групп приводит к эффекту взаимного стягивания
- 24. в) Окислительное 2) Образование оксалилхлорида Оксалилхлорид склонен к гомолитическому типу расщепления С-С связи, что используется в
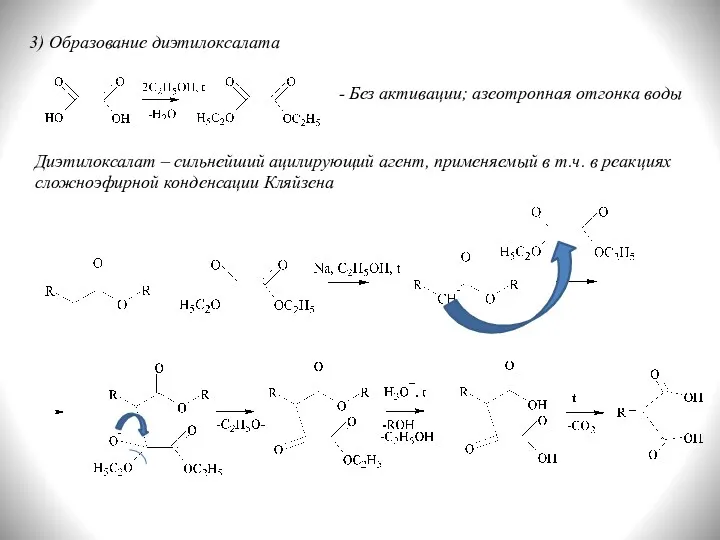
- 25. 3) Образование диэтилоксалата - Без активации; азеотропная отгонка воды Диэтилоксалат – сильнейший ацилирующий агент, применяемый в
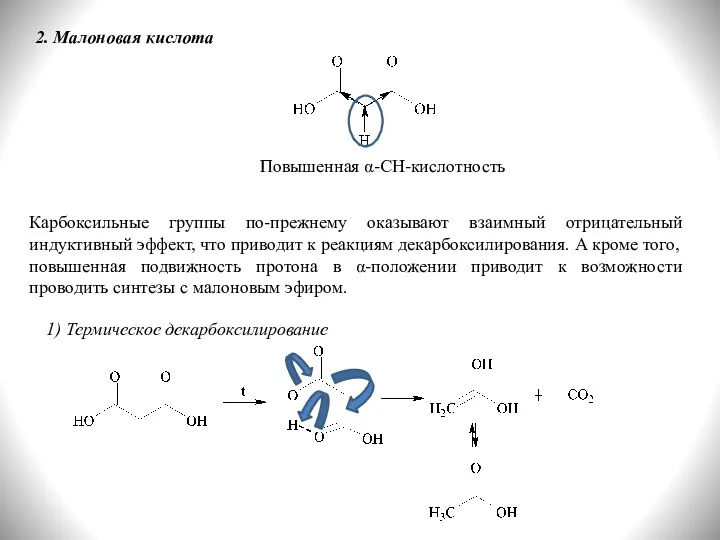
- 26. 2. Малоновая кислота Повышенная α-СН-кислотность Карбоксильные группы по-прежнему оказывают взаимный отрицательный индуктивный эффект, что приводит к
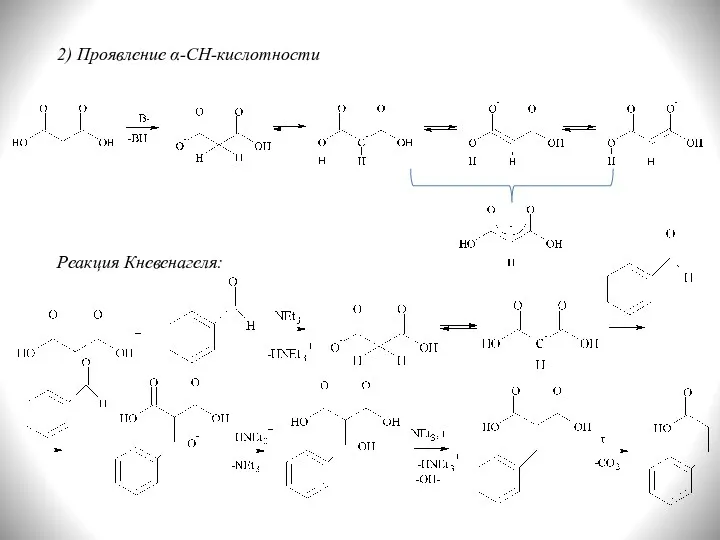
- 27. 2) Проявление α-СН-кислотности Реакция Кневенагеля:
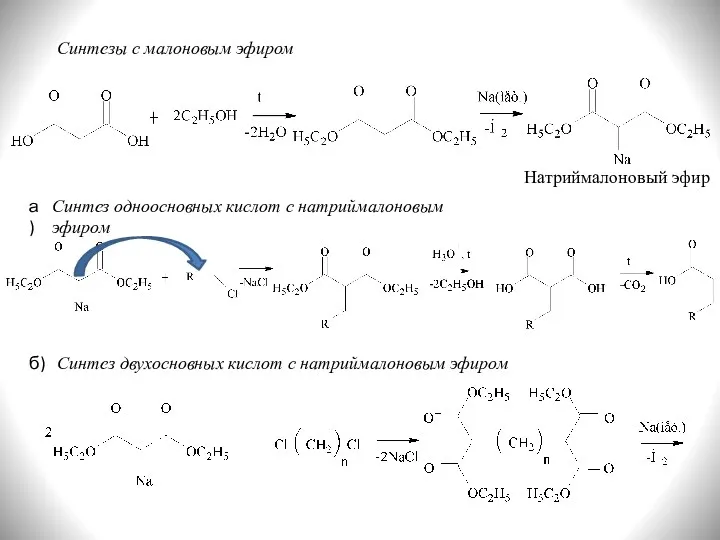
- 28. Синтезы с малоновым эфиром Натриймалоновый эфир а) Синтез одноосновных кислот с натриймалоновым эфиром Синтез двухосновных кислот
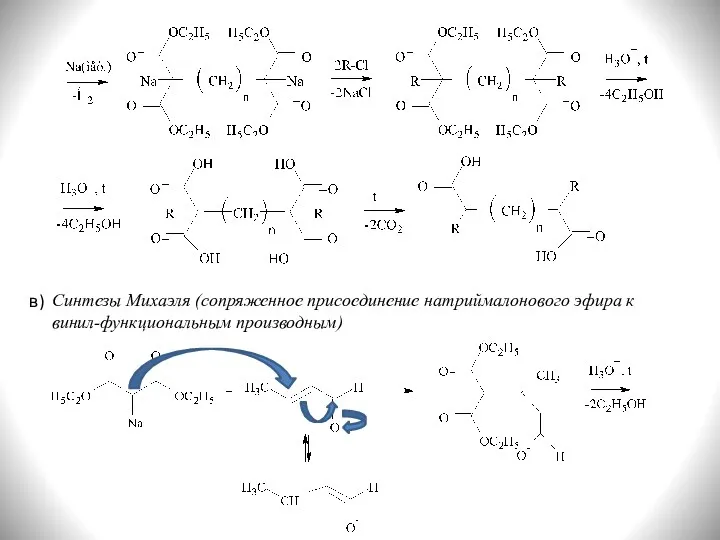
- 29. Синтезы Михаэля (сопряженное присоединение натриймалонового эфира к винил-функциональным производным) в)
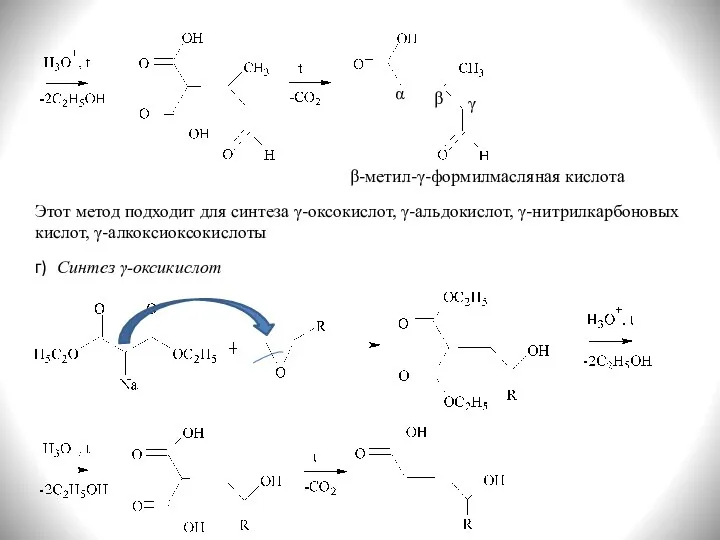
- 30. α β γ β-метил-γ-формилмасляная кислота Синтез γ-оксикислот г) Этот метод подходит для синтеза γ-оксокислот, γ-альдокислот, γ-нитрилкарбоновых
- 31. 3. Янтарная кислота Во многом свойства янтарной кислоты схожи со свойствами монокарбоновых кислот. Начиная с янтарной
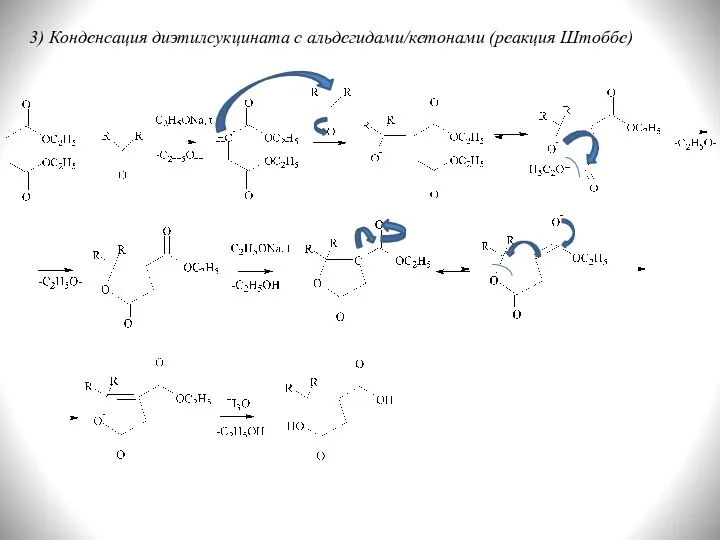
- 32. 3) Конденсация диэтилсукцината с альдегидами/кетонами (реакция Штоббе)
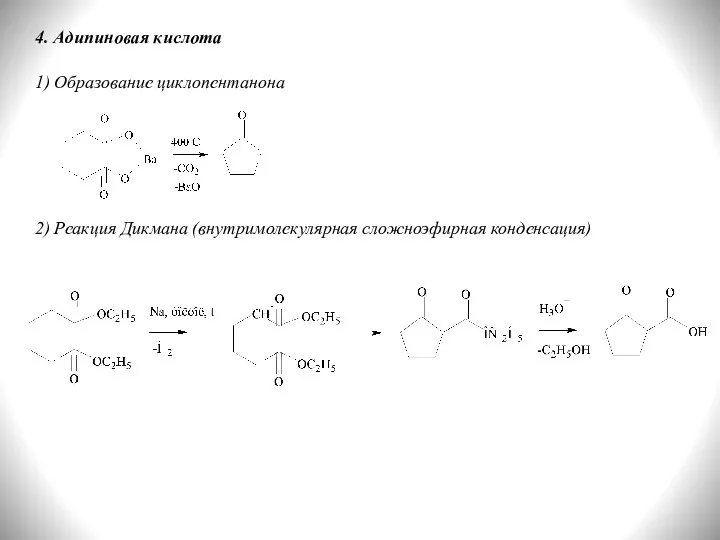
- 33. 4. Адипиновая кислота 1) Образование циклопентанона 2) Реакция Дикмана (внутримолекулярная сложноэфирная конденсация)
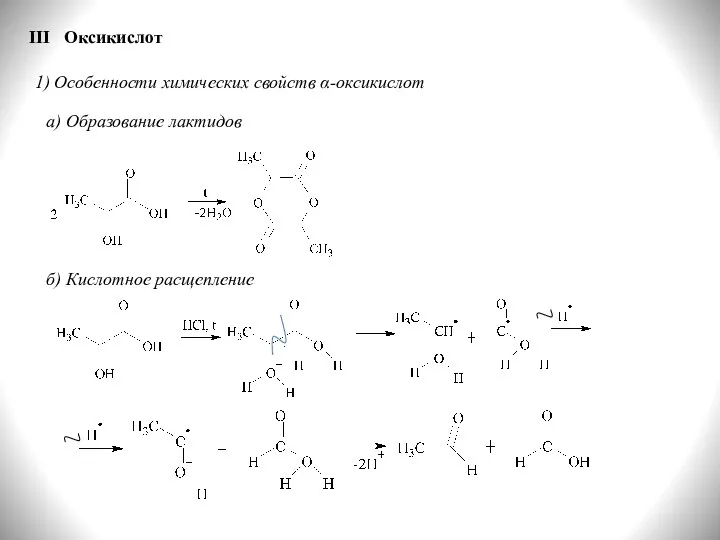
- 34. III Оксикислот 1) Особенности химических свойств α-оксикислот а) Образование лактидов б) Кислотное расщепление
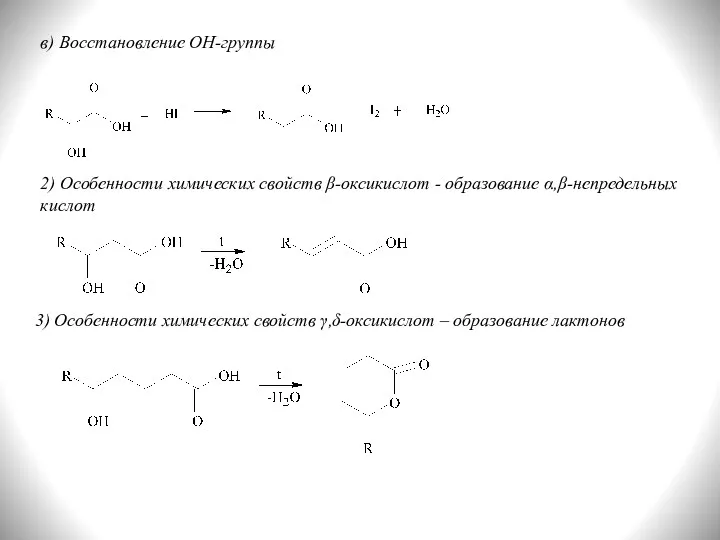
- 35. в) Восстановление ОН-группы 2) Особенности химических свойств β-оксикислот - образование α,β-непредельных кислот 3) Особенности химических свойств
- 36. В целом для всех оксикислот характерны реакции, связанные с проявлением свойств вторичных спиртов (SN, образование простых
- 38. Скачать презентацию









 Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс Химические формулы
Химические формулы Углерод и его оксиды
Углерод и его оксиды Классификация химических реакций
Классификация химических реакций Углеводы. Моносахариды
Углеводы. Моносахариды Неоднородные системы (процессы и аппараты химической технологии, 8 лекция)
Неоднородные системы (процессы и аппараты химической технологии, 8 лекция) Химическая кинетика
Химическая кинетика Парфюмерно-косметическая продукция
Парфюмерно-косметическая продукция Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Адсорбция на границе твердое тело - раствор
Адсорбция на границе твердое тело - раствор Амины. Анилин
Амины. Анилин Природный газ
Природный газ Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Тотығутотықсыздану титрлеу әдістері. Дәріс № 7
Тотығутотықсыздану титрлеу әдістері. Дәріс № 7 Пиролиз углеводородов
Пиролиз углеводородов Теория строения органических соединений. Лекция 17
Теория строения органических соединений. Лекция 17 Табиғаттағы биологиялық азотофиксация мәні мен масштабы
Табиғаттағы биологиялық азотофиксация мәні мен масштабы Фации метаморфизма
Фации метаморфизма Композиционные материалы – материалы будущего
Композиционные материалы – материалы будущего Химические свойства неорганических соединений
Химические свойства неорганических соединений Uses of chlorine and its compounds
Uses of chlorine and its compounds Материаловедение. Лекция 1
Материаловедение. Лекция 1 Химическая промышленность
Химическая промышленность Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Курс лекций: Методы диагностики и анализа микро- и наносистем
Курс лекций: Методы диагностики и анализа микро- и наносистем Фенолы+
Фенолы+ Комплексні сполуки. Комплексоутворення в біологічних системах
Комплексні сполуки. Комплексоутворення в біологічних системах