Содержание
- 2. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ (ММО) Молекулярные орбитали (МО) – линейная комбинация атомных орбиталей (ЛКАО) Основные положения ММО
- 3. Основные положения ММО ЛКАО: 4. МО отличаются по энергии и по симметрии; каждой МО соответствует общепринятое
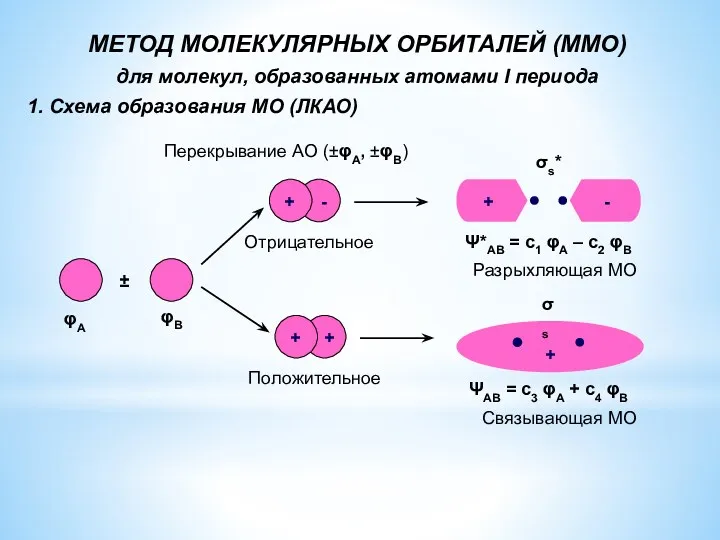
- 4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ (ММО) для молекул, образованных атомами I периода 1. Схема образования МО (ЛКАО) Разрыхляющая
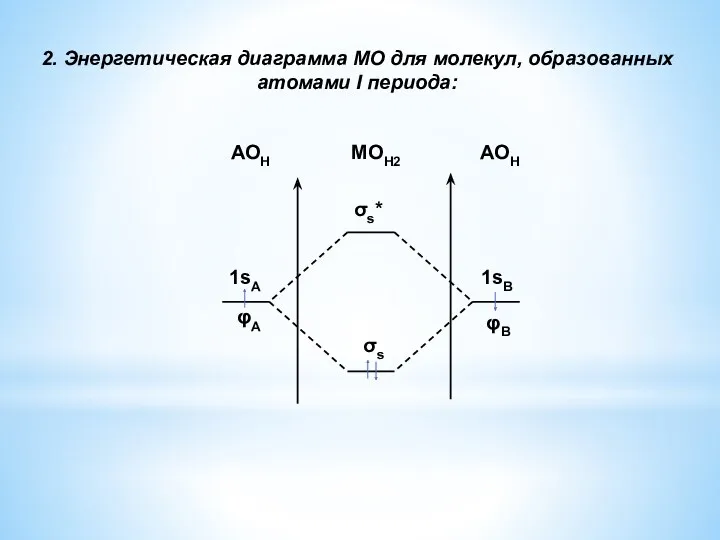
- 5. 2. Энергетическая диаграмма МО для молекул, образованных атомами I периода:
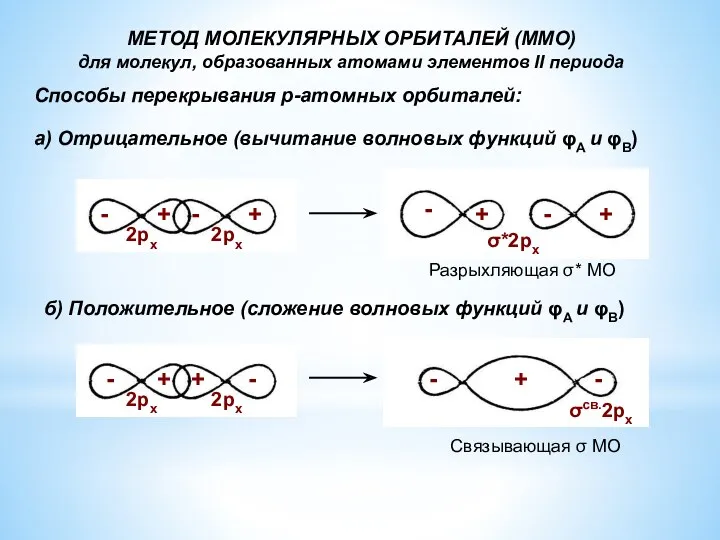
- 6. Способы перекрывания р-атомных орбиталей: а) Отрицательное (вычитание волновых функций φА и φВ) б) Положительное (сложение волновых
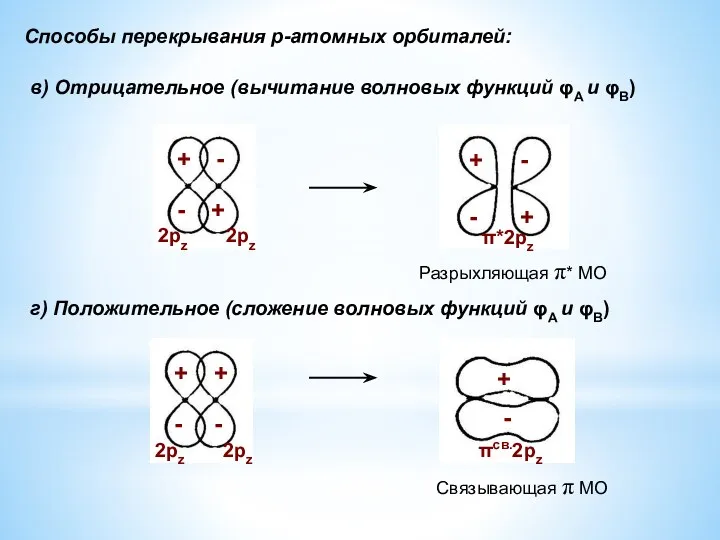
- 7. Способы перекрывания р-атомных орбиталей: в) Отрицательное (вычитание волновых функций φА и φВ) г) Положительное (сложение волновых
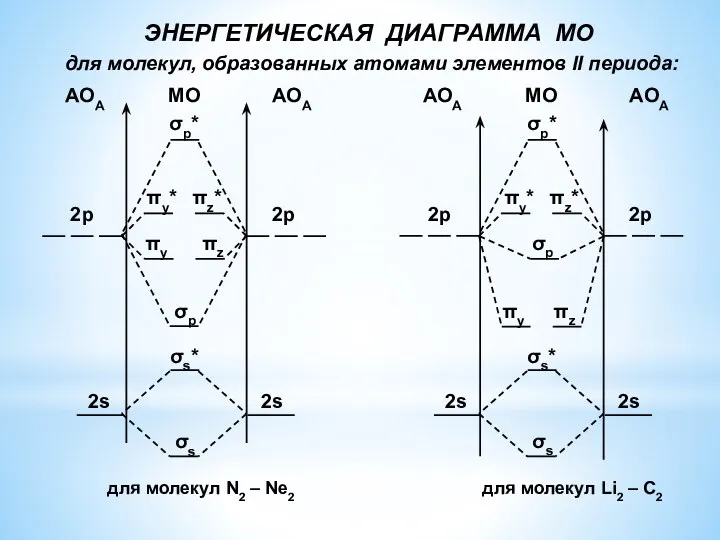
- 8. ЭНЕРГЕТИЧЕСКАЯ ДИАГРАММА МО для молекул, образованных атомами элементов II периода: σs σs* МО σs σs* МО
- 9. ПОРЯДОК СВЯЗИ в двухатомной молекуле, определяемый из диаграммы МО:
- 10. ИОННАЯ СВЯЗЬ Ионная связь (И. с.) – это связь, которая образуется в результате электростатического притяжения ионов
- 11. ИОННАЯ ХИМИЧЕСКАЯ СВЯЗЬ Степень ионности связи – это доля ионного характера связи в соединении; – количественная
- 12. ИОННАЯ СВЯЗЬ Свойства соединений с ионным типом связи: Высокие температуры плавления (Тпл) и кипения (Ткип) (в
- 13. МЕТАЛЛИЧЕСКАЯ ХИМИЧЕСКАЯ СВЯЗЬ Связь между атомами и положительно заряженными ионами осуществляют делокализованные электроны (так называемый «электронный
- 14. МЕТАЛЛИЧЕСКАЯ ХИМИЧЕСКАЯ СВЯЗЬ Свойства металлической связи, ее особенности: ненаправленность ненасыщаемость небольшое число валентных электронов у атомов
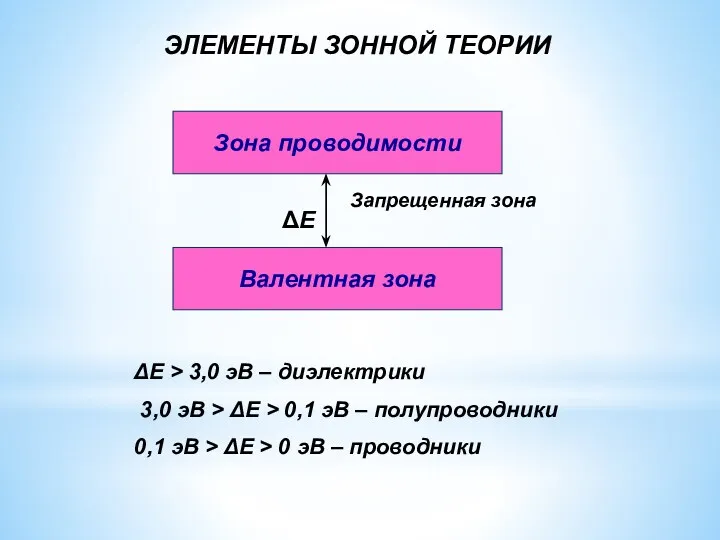
- 15. ЭЛЕМЕНТЫ ЗОННОЙ ТЕОРИИ энергия электронов в металле может принимать только дискретные значения распределение электронов по уровням
- 16. Зона проводимости Валентная зона Запрещенная зона ΔЕ ΔЕ > 3,0 эВ – диэлектрики 3,0 эВ >
- 17. КОМПЛЕКСНЫЕ (КООРДИНАЦИОННЫЕ) СОЕДИНЕНИЯ, КС Принцип координации: координационный ион или атом металла окружен противоположно заряженными ионами или
- 18. КОМПЛЕКСНЫЕ (КООРДИНАЦИОННЫЕ) СОЕДИНЕНИЯ Основные понятия: центральный атом лиганды противоионы внутренняя сфера внешняя сфера [PtCl2(NH3)4]Cl2
- 19. Примеры комплексных (координационных) соединений K4[Fe(CN)6] [Fe(CN)6]4‾ – внутренняя сфера, собственно комплекс; К+ – ионы внешней сферы;
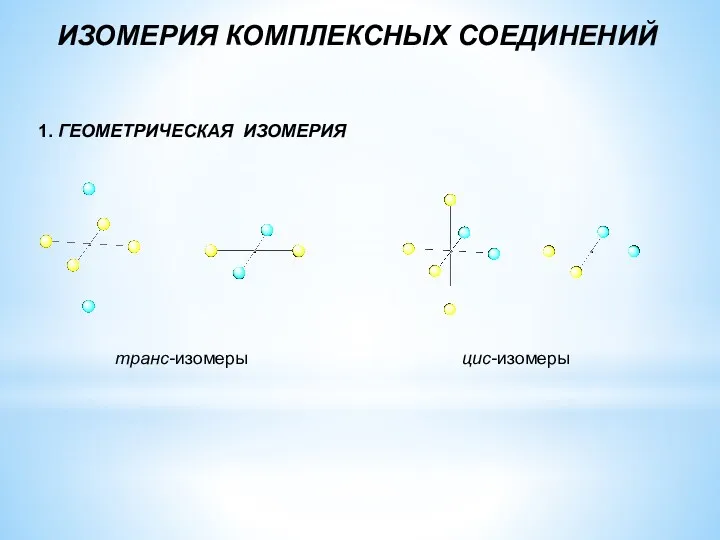
- 20. ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 1. ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ транс-изомеры цис-изомеры
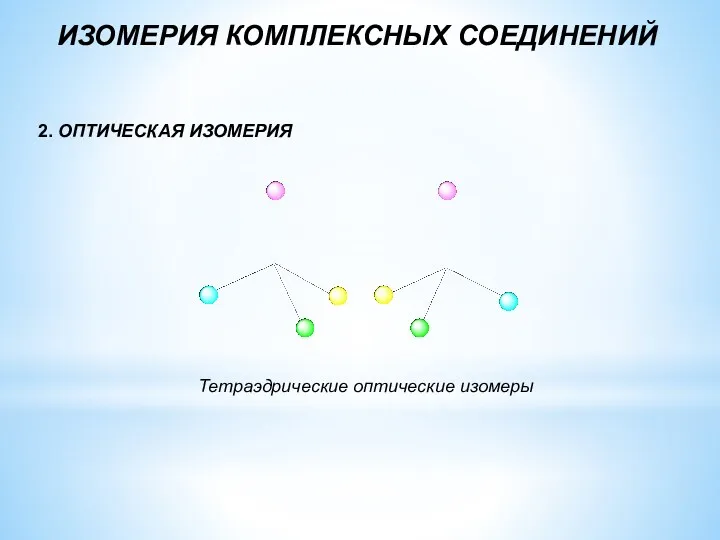
- 21. ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2. ОПТИЧЕСКАЯ ИЗОМЕРИЯ Тетраэдрические оптические изомеры
- 22. ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 3. ИОНИЗАЦИОННАЯ ИЗОМЕРИЯ [Co(H2O)6]Cl3 и [Co(H2O)5Cl]Cl2.H2O 4. КООРДИНАЦИОННАЯ ИЗОМЕРИЯ [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6] 5.
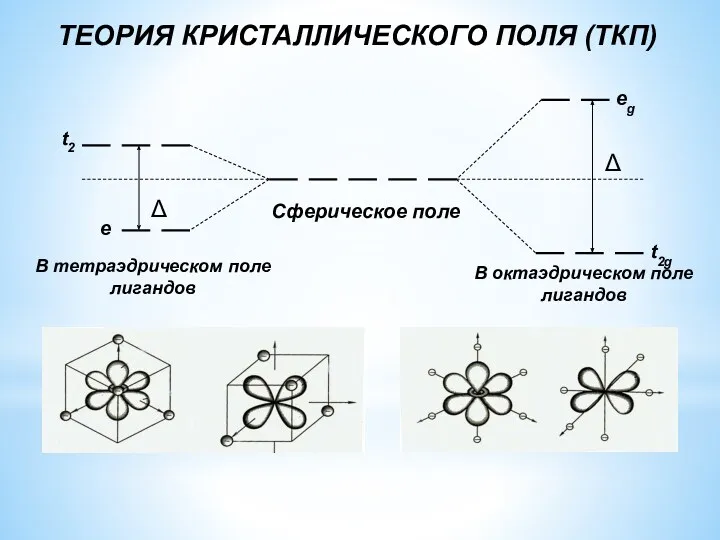
- 23. ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ (ТКП) Положения ТКП Связь в комплексе осуществляется за счёт электростатического взаимодействия положительно заряженного
- 24. ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ (ТКП) В тетраэдрическом поле лигандов В октаэдрическом поле лигандов Сферическое поле
- 25. Величина энергии расщепления d-подуровня ц. а. (Δ) типа (способа) координации центрального атома заряда центрального иона электронного
- 27. Скачать презентацию










![КОМПЛЕКСНЫЕ (КООРДИНАЦИОННЫЕ) СОЕДИНЕНИЯ Основные понятия: центральный атом лиганды противоионы внутренняя сфера внешняя сфера [PtCl2(NH3)4]Cl2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/408661/slide-17.jpg)
![Примеры комплексных (координационных) соединений K4[Fe(CN)6] [Fe(CN)6]4‾ – внутренняя сфера, собственно](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/408661/slide-18.jpg)
![ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 3. ИОНИЗАЦИОННАЯ ИЗОМЕРИЯ [Co(H2O)6]Cl3 и [Co(H2O)5Cl]Cl2.H2O 4.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/408661/slide-21.jpg)


 Цеолиты. Свойства и область применения
Цеолиты. Свойства и область применения Массообменные процессы
Массообменные процессы Степень загрязнения почвы по химическому составу снежного покрова на разном удалении от источника загрязнения
Степень загрязнения почвы по химическому составу снежного покрова на разном удалении от источника загрязнения Щелочные металлы
Щелочные металлы Химическое равновесие
Химическое равновесие Дисперсные системы
Дисперсные системы Азотсодержащие соединения
Азотсодержащие соединения Кислородсодержащие органические соединения. Лабораторная работа
Кислородсодержащие органические соединения. Лабораторная работа Неорганические полимеры
Неорганические полимеры Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота
Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота Азот қышқылын өндіру
Азот қышқылын өндіру Алкадиены (диены, диеновые углеводороды)
Алкадиены (диены, диеновые углеводороды) Шестичленные гетероциклические соединения с одним и двумя гетероатомами. Конденсированные системы гетероциклов
Шестичленные гетероциклические соединения с одним и двумя гетероатомами. Конденсированные системы гетероциклов Cromatografia ionică
Cromatografia ionică Алкены. Номенклатура. Строение молекулы
Алкены. Номенклатура. Строение молекулы Метанол. Фізичні властивості
Метанол. Фізичні властивості Энергетика химических реакций
Энергетика химических реакций Классификация химических реакций
Классификация химических реакций Основні класи неорганічних сполук
Основні класи неорганічних сполук Уральские самоцветы
Уральские самоцветы Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Конструкционные материалы
Конструкционные материалы Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Оксид меди
Оксид меди Электроповерхностные явления. Строение двойного электрического слоя
Электроповерхностные явления. Строение двойного электрического слоя Ароматические соединения (арены)
Ароматические соединения (арены) λ-MnO2 as material with pseudocapacitive properties
λ-MnO2 as material with pseudocapacitive properties Svante Arrhenius and the theory of electrolytic and non-electrolytic dissociation
Svante Arrhenius and the theory of electrolytic and non-electrolytic dissociation