Основы биосигнализации: сигнальный путь митоген-активируемой протеинкиназы (MAПК). Лекция 8 презентация
Содержание
- 2. Митоген-активируемая протеиникназа (МАП-киназа, МАПК) Mitogen-activated protein kinase pathway (MAPK-pathway) Одним из элементов адаптации метаболизма клеток является
- 3. Сигнальный путь (каскад) МАП-киназы – основной путь переда-чи пролиферативных сигналов. Он действует во всех известных типах
- 4. Этапы и механизмы формирования Ras/MAPK – сигнального пути 1. Взаимодействие лиганда (митогена) с рецептором, относя-щемся к
- 5. 3. Белок Grb2, через свой SH2-домен связан с фосфотирозином цитозольного домена рецептора. С помощью своего второго
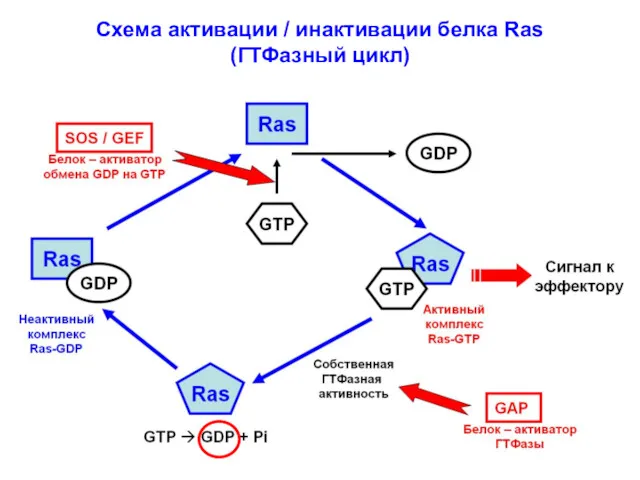
- 6. Инактивация мономерного белка Ras происходит благодаря его собственной ГТФазной активности: гидролиз ГТФ до ГДФ + Фн
- 7. Схема активации / инактивации белка Ras (ГТФазный цикл)
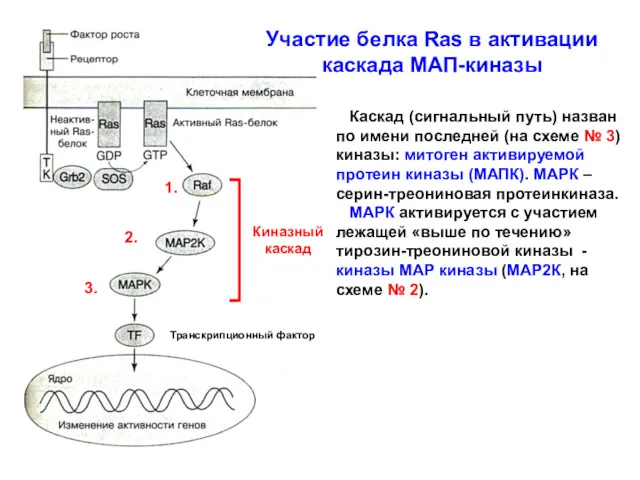
- 8. Участие белка Ras в активации каскада МАП-киназы Транскрипционный фактор Киназный каскад Каскад (сигнальный путь) назван по
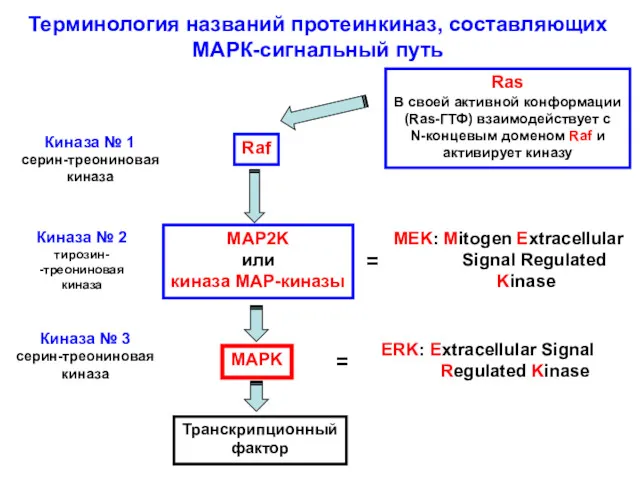
- 9. Терминология названий протеинкиназ, составляющих МАРК-сигнальный путь Ras В своей активной конформации (Ras-ГТФ) взаимодействует с N-концевым доменом
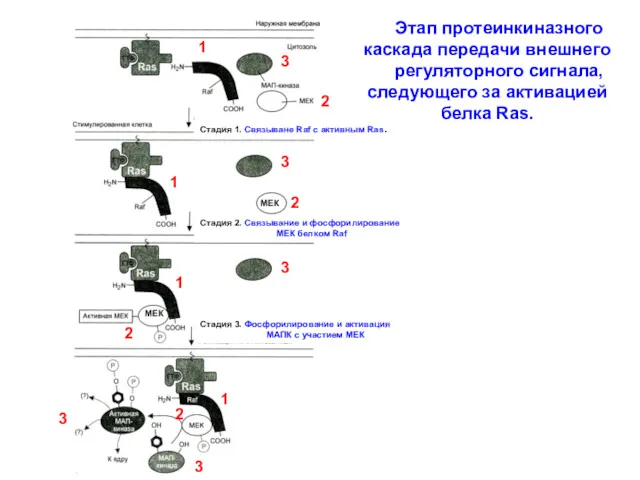
- 10. Этап протеинкиназного каскада передачи внешнего регуляторного сигнала, следующего за активацией белка Ras. Стадия 1. Связыване Raf
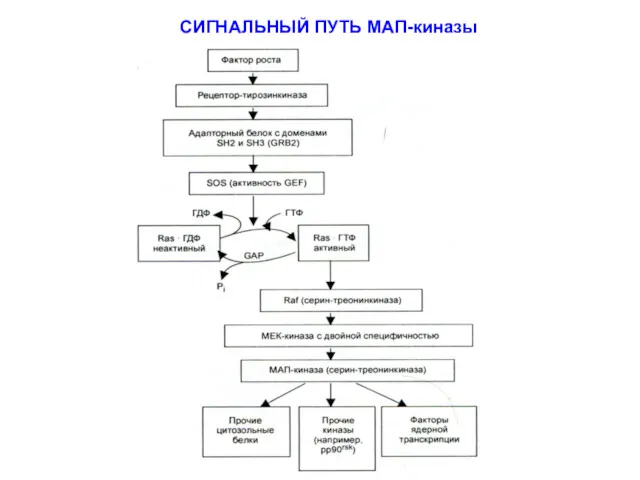
- 11. СИГНАЛЬНЫЙ ПУТЬ МАП-киназы
- 12. Активация МАРК приводит к её транслокации в ядро и последу-ющему фосфорилированию транскрипционных факторов, кото-рые отвечают за
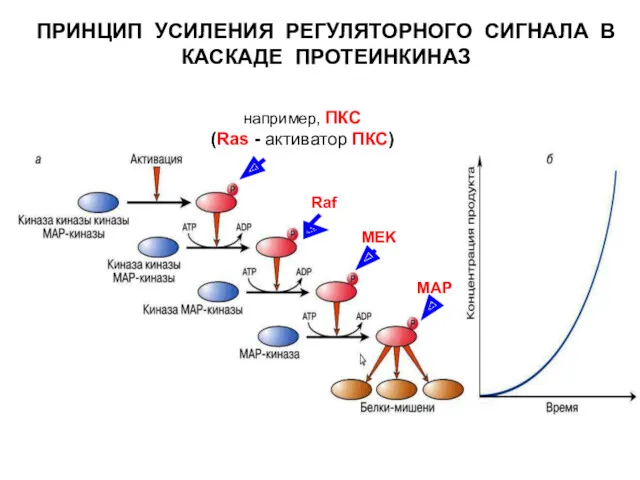
- 13. ПРИНЦИП УСИЛЕНИЯ РЕГУЛЯТОРНОГО СИГНАЛА В КАСКАДЕ ПРОТЕИНКИНАЗ Raf MEK MAP например, ПКС (Ras - активатор ПКС)
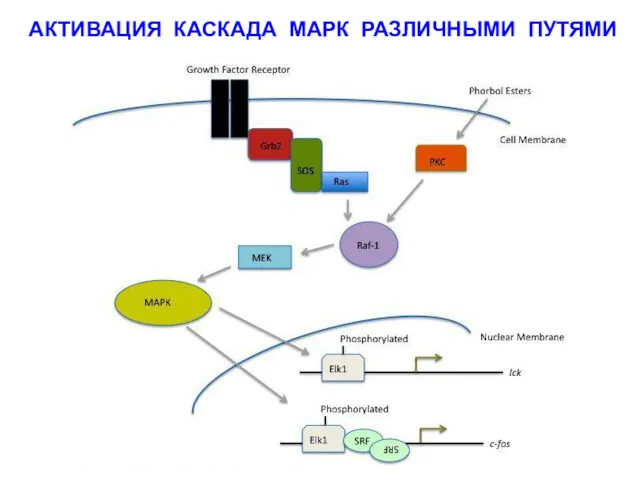
- 14. АКТИВАЦИЯ КАСКАДА МАРК РАЗЛИЧНЫМИ ПУТЯМИ
- 15. «Выключение» митогенной сигнализации: диссоциация комплекса лиганд – рецептор; дефосфорилирование цитозольных доменов рецептора клето- чными фосфатазами; фосфорилирование
- 16. Некоторые типы опухолей возникают при нарушении регуля-ции МАРК-сигнального каскада. Мутации генов, кодирующих цитоплазматический домен рецепторов с
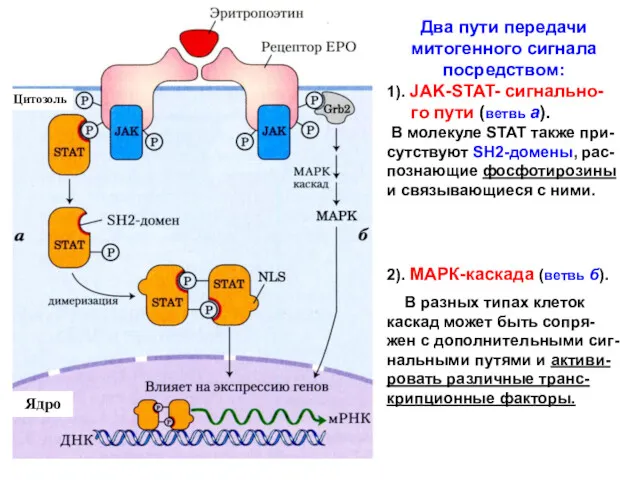
- 17. Цитозоль Ядро Два пути передачи митогенного сигнала посредством: 1). JAK-STAT- сигнально- го пути (ветвь а). В
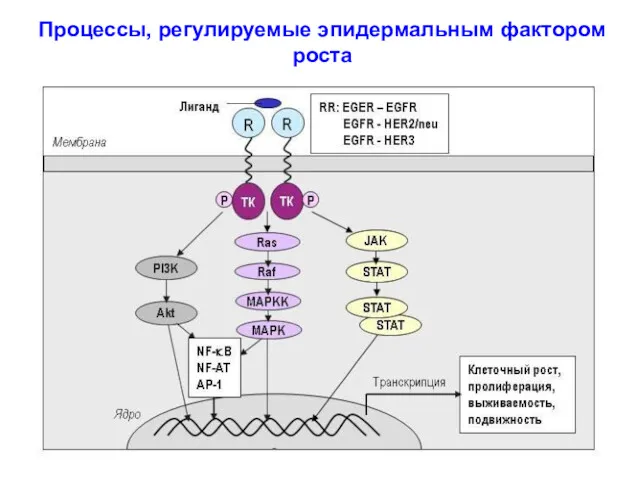
- 18. Процессы, регулируемые эпидермальным фактором роста
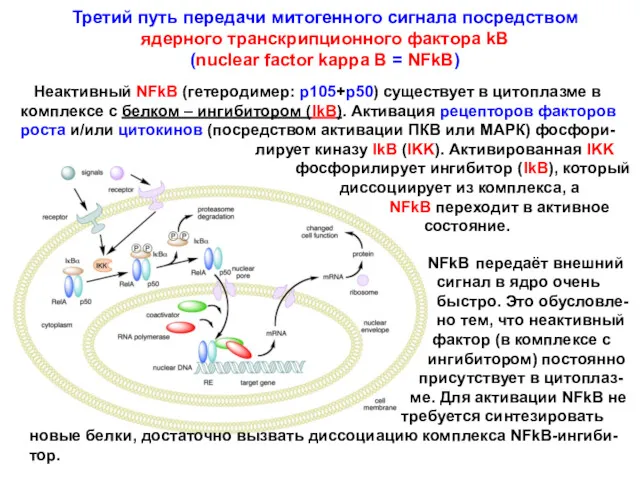
- 19. Третий путь передачи митогенного сигнала посредством ядерного транскрипционного фактора kB (nuclear factor kappa B = NFkB)
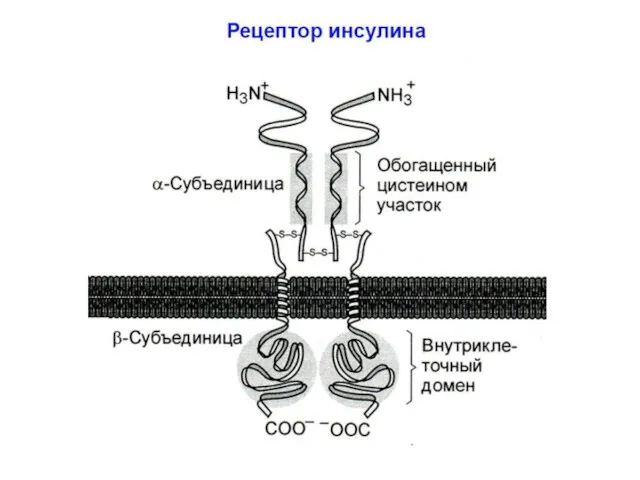
- 20. СИГНАЛЬНЫЕ ПУТИ ИНСУЛИНА Строение рецептора инсулина и механизм его активации Рецептор инсулина изначально является димером: состоит
- 22. Активированный рецептор инсулина фосфорилирует по тирозину молекулу субстрат рецептора инсулина-1 (IRS-1 – insulin receptor substrate-1). IRS-1
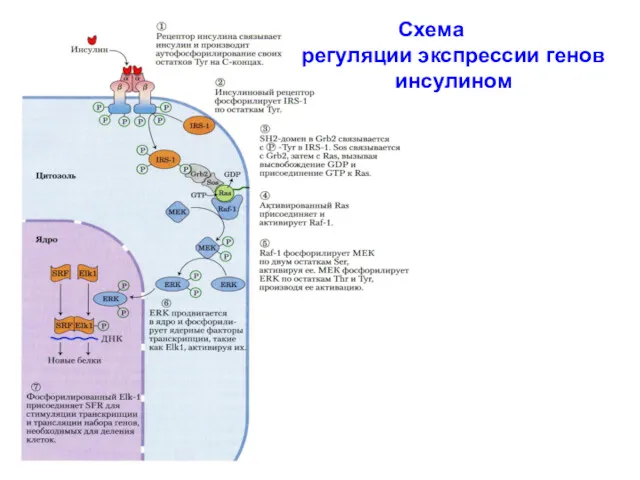
- 23. Схема регуляции экспрессии генов инсулином
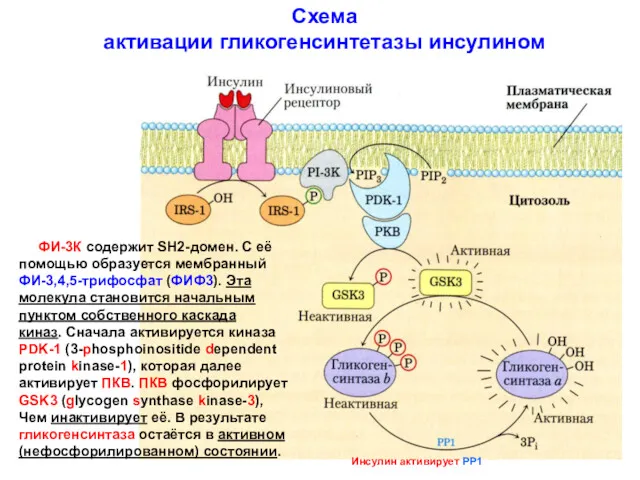
- 24. Схема активации гликогенсинтетазы инсулином ФИ-3К содержит SH2-домен. С её помощью образуется мембранный ФИ-3,4,5-трифосфат (ФИФ3). Эта молекула
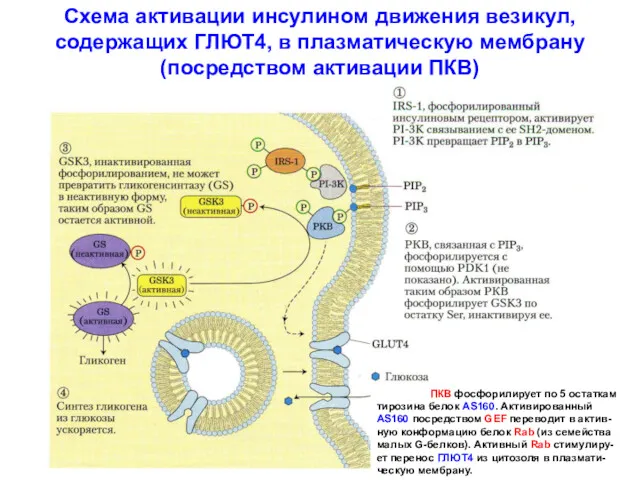
- 25. Схема активации инсулином движения везикул, содержащих ГЛЮТ4, в плазматическую мембрану (посредством активации ПКВ) ПКВ фосфорилирует по
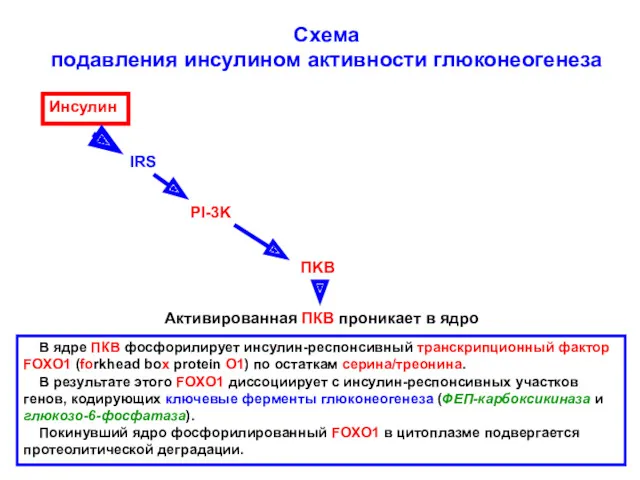
- 26. Схема подавления инсулином активности глюконеогенеза Инсулин IRS PI-3K ПKB Активированная ПКВ проникает в ядро В ядре
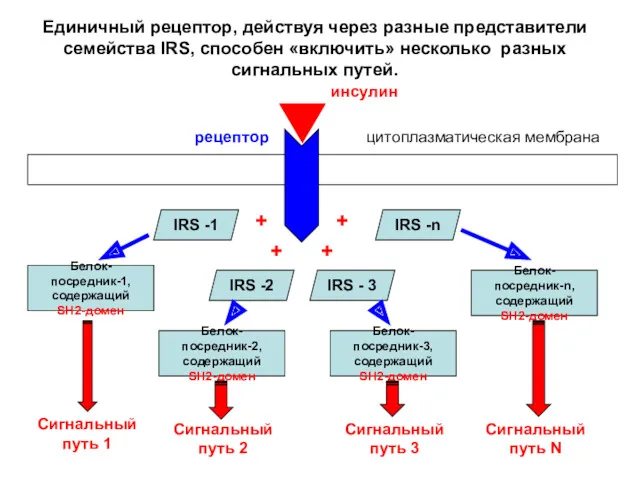
- 27. IRS -1 IRS -2 IRS - 3 IRS -n Белок-посредник-1, содержащий SH2-домен цитоплазматическая мембрана инсулин рецептор
- 29. Скачать презентацию










 Внеклеточные формы жизни: вирусы и бактериофаги
Внеклеточные формы жизни: вирусы и бактериофаги Этология с основами зоопсихологии
Этология с основами зоопсихологии Гигиена одежды и обуви
Гигиена одежды и обуви Обмен веществ и превращение энергии
Обмен веществ и превращение энергии Морфофункциональная характеристика скелета и аппарата движения туловища
Морфофункциональная характеристика скелета и аппарата движения туловища Использование ферментов в медицине. (Лекция 8)
Использование ферментов в медицине. (Лекция 8) Своя игра. Мир растений
Своя игра. Мир растений Гименолепидоз. Возбудители
Гименолепидоз. Возбудители Kakie_byvayut_zhivotnye
Kakie_byvayut_zhivotnye Типы экологических взаимодействий
Типы экологических взаимодействий Полимеразная цепная реакция
Полимеразная цепная реакция Приспособленность организмов к условиям внешней среды как результат действия естественного отбора (1)
Приспособленность организмов к условиям внешней среды как результат действия естественного отбора (1) Презентация Школьные учебники по биологии в настоящее время
Презентация Школьные учебники по биологии в настоящее время Lophophorata Deuterostomia. Щупальцевые
Lophophorata Deuterostomia. Щупальцевые Экология как наука
Экология как наука Тип членистоногие. Класс ракообразные
Тип членистоногие. Класс ракообразные Повторительно- обобщающий урок по теме: “Стебель”
Повторительно- обобщающий урок по теме: “Стебель” Анатомия органа зрения
Анатомия органа зрения Ұтымды тамақтану және оны ұйымдастыруға қойылатын гигиеналық талаптар
Ұтымды тамақтану және оны ұйымдастыруға қойылатын гигиеналық талаптар Клонування
Клонування Обмін води, його регуляція
Обмін води, його регуляція охорона первоцвітів. Збереження ранніх квітучих рослин
охорона первоцвітів. Збереження ранніх квітучих рослин С какого дерева листок?
С какого дерева листок? Ищите доктора в природе
Ищите доктора в природе Закономерности эволюции
Закономерности эволюции Циклы развития растений. Подготовка к выполнению заданий ЕГЭ С5
Циклы развития растений. Подготовка к выполнению заданий ЕГЭ С5 Ластоногі. Група водних хижих ссавців
Ластоногі. Група водних хижих ссавців Классификация гормонов
Классификация гормонов