Особенности молекулярно-генетической и морфологической идентификации грибов подотдела Glomeromycotina презентация
Содержание
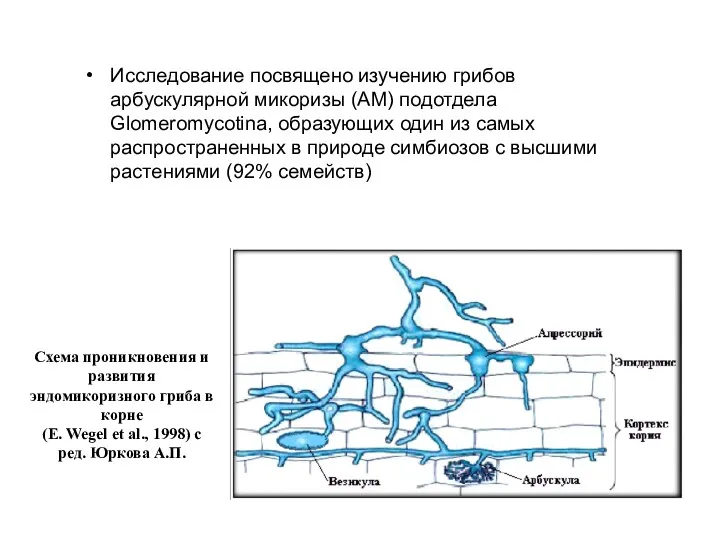
- 2. Схема проникновения и развития эндомикоризного гриба в корне (E. Wegel et al., 1998) с ред. Юркова
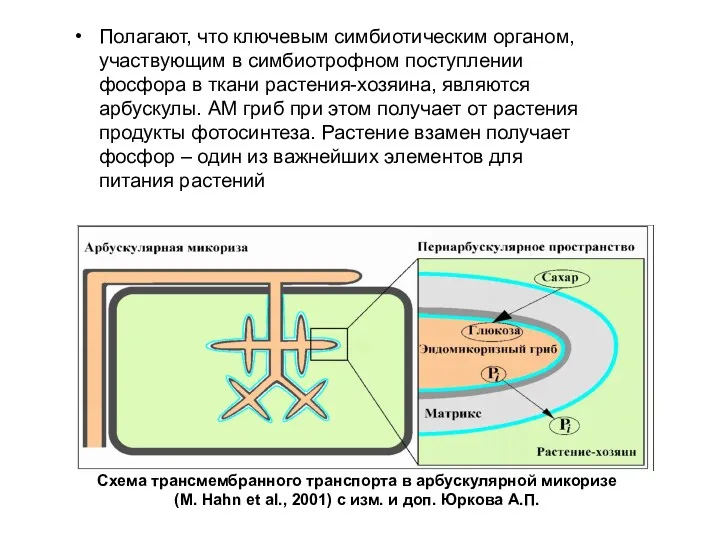
- 3. Полагают, что ключевым симбиотическим органом, участвующим в симбиотрофном поступлении фосфора в ткани растения-хозяина, являются арбускулы. АМ
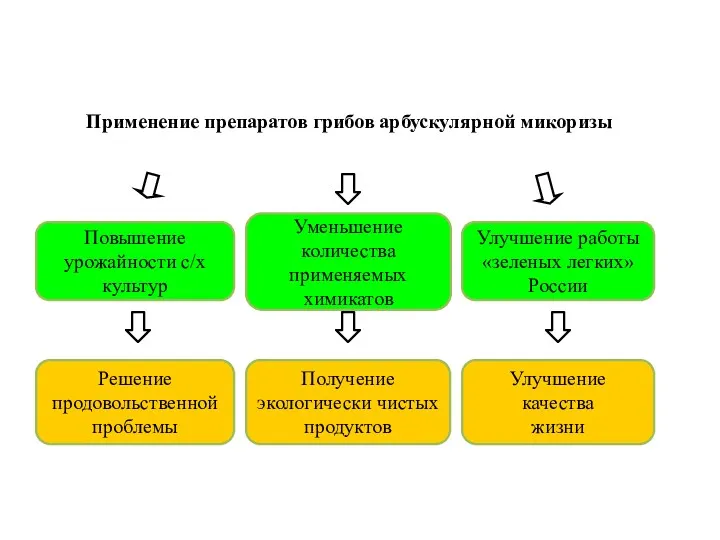
- 4. Повышение урожайности с/х культур Улучшение работы «зеленых легких» России Уменьшение количества применяемых химикатов Улучшение качества жизни
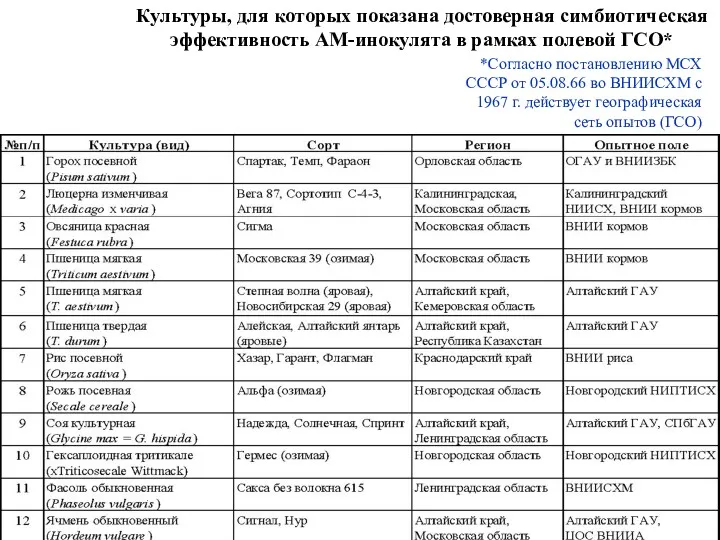
- 5. *Согласно постановлению МСХ СССР от 05.08.66 во ВНИИСХМ с 1967 г. действует географическая сеть опытов (ГСО)
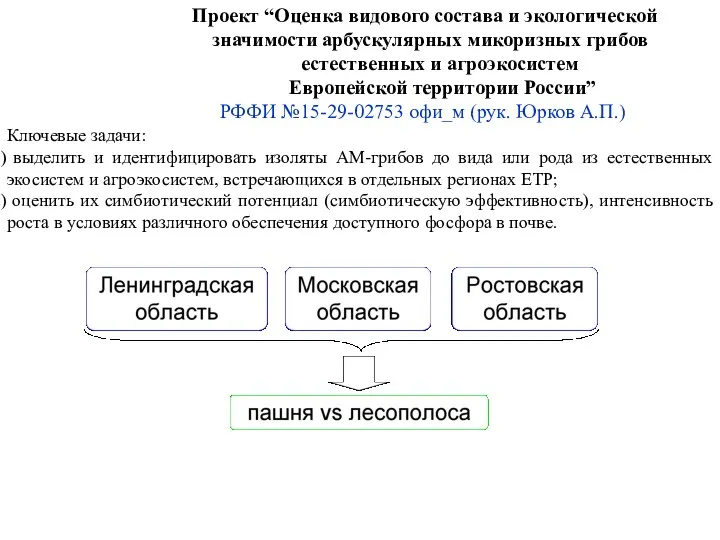
- 6. Проект “Оценка видового состава и экологической значимости арбускулярных микоризных грибов естественных и агроэкосистем Европейской территории России”
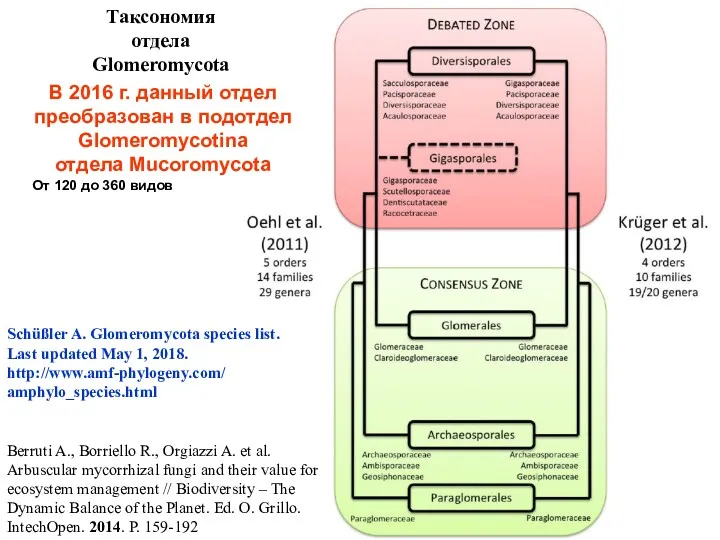
- 7. Мировые коллекции грибов арбускулярной микоризы International Culture Collection of Vesicular-Arbuscular Mycorrhizal Fungi (INVAM), США http://invam.wvu.edu/the-fungi/classification Banque
- 8. Проблемы идентификации грибов арбускулярной микоризы облигатный статус АМ-грибов по отношению к растению-хозяину; высокий генетический полиморфизм грибов
- 9. Berruti A., Borriello R., Orgiazzi A. et al. Arbuscular mycorrhizal fungi and their value for ecosystem
- 10. Масштабная линейка равна 500 мкм (фото слева) и 100 мкм (фото по центру и справа). Цвет
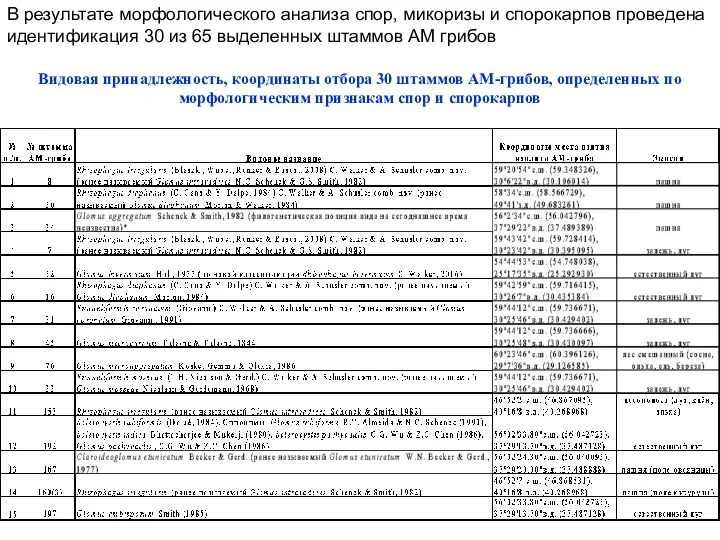
- 11. В результате морфологического анализа спор, микоризы и спорокарпов проведена идентификация 30 из 65 выделенных штаммов АМ
- 12. Видовая принадлежность, координаты отбора 30 штаммов АМ-грибов, определенных по морфологическим признакам спор и спорокарпов (продолжение)
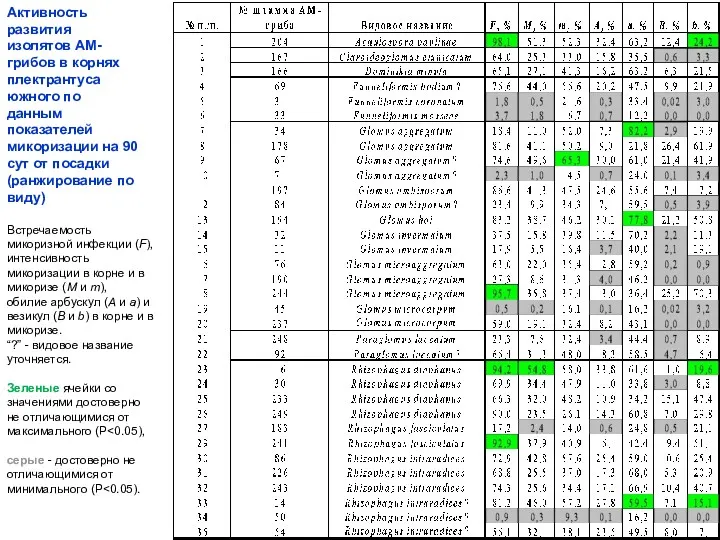
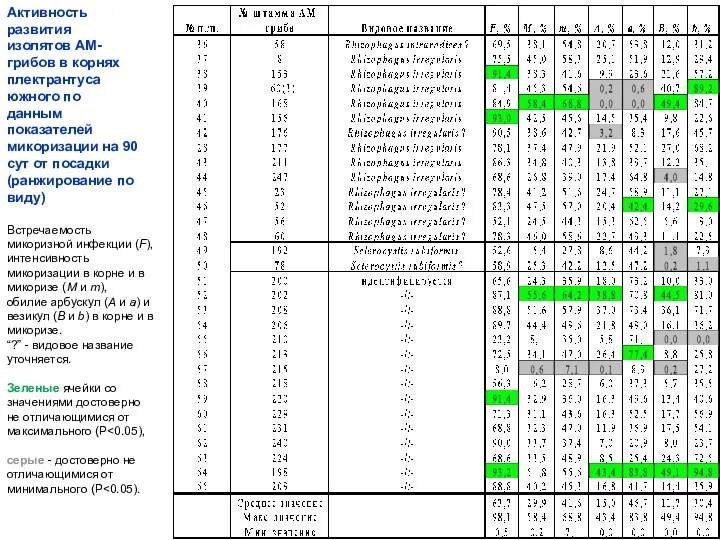
- 13. Встречаемость микоризной инфекции (F), интенсивность микоризации в корне и в микоризе (M и m), обилие арбускул
- 14. Активность развития изолятов АМ-грибов в корнях плектрантуса южного по данным показателей микоризации на 90 сут от
- 15. Система тестирования симбиотической эффективности грибов арбускулярной микоризы инокуляция контроль Селектированная облигатно микотрофная линия MlS-1 Medicago lupulina
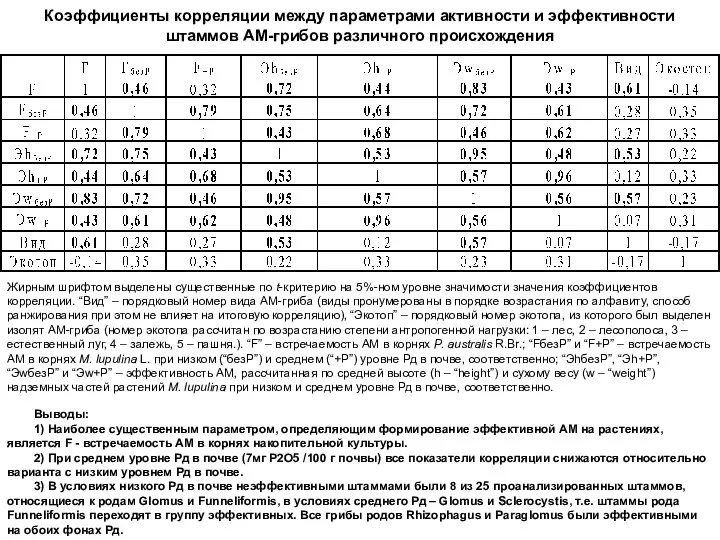
- 16. Коэффициенты корреляции между параметрами активности и эффективности штаммов АМ-грибов различного происхождения Жирным шрифтом выделены существенные по
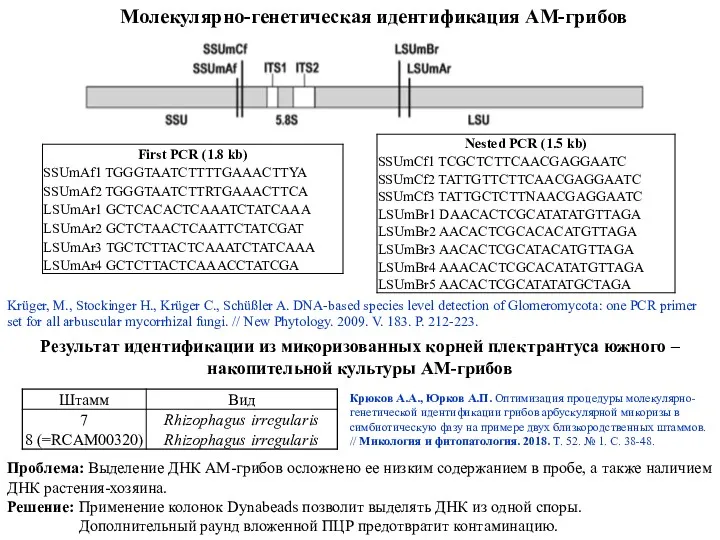
- 18. Молекулярно-генетическая идентификация АМ-грибов Проблема: Выделение ДНК АМ-грибов осложнено ее низким содержанием в пробе, а также наличием
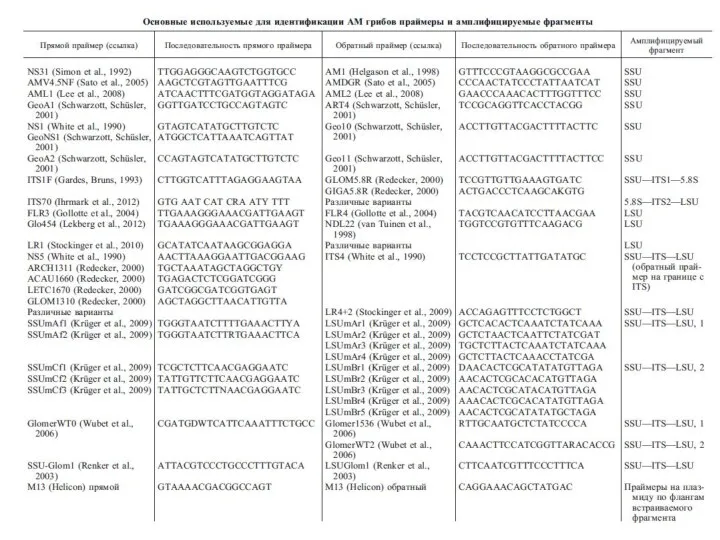
- 19. В качестве ДНК-маркеров для идентификации видов АМ-грибов за последние 10 лет использовались несколько участков ядерного и
- 23. С 2009 г. методы NGS начали использоваться в практике идентификации АМ-грибов. С использованием универсальных грибных праймеров
- 24. В работе К. Сенес-Гуэрреро с соавт. использовали метод 454 GS-FLX+ для идентификации по LSU региону. Интересным
- 25. Выравнивание удаленных по филогении родов грибов АМ
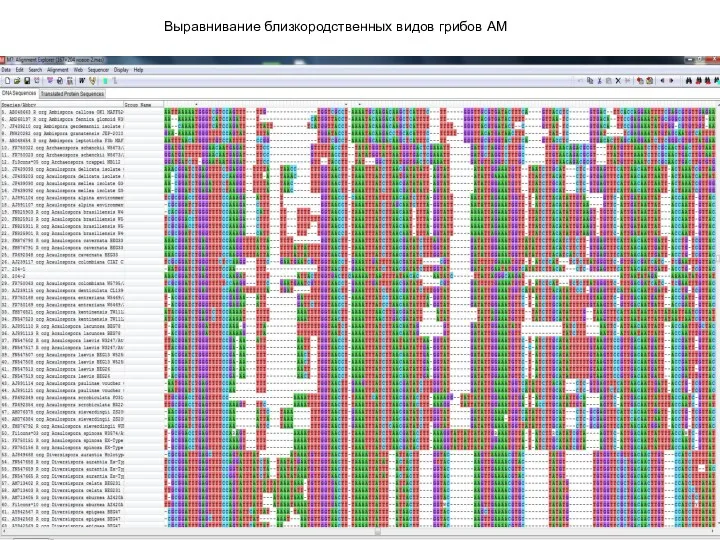
- 26. Выравнивание близкородственных видов грибов АМ
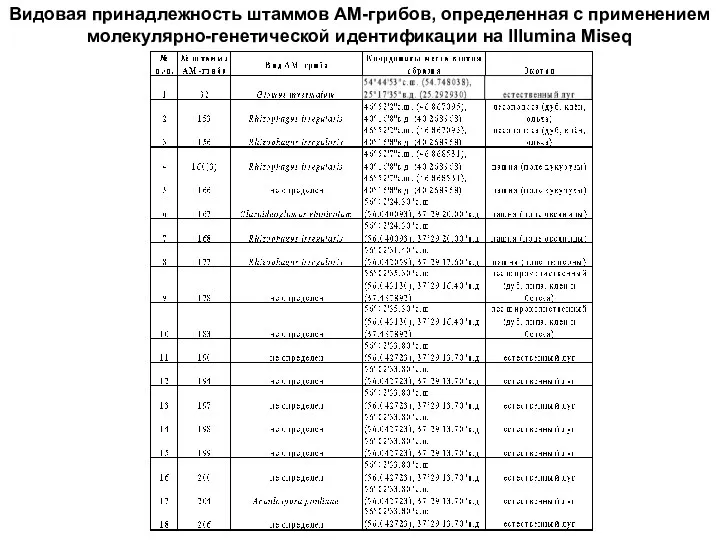
- 28. Видовая принадлежность штаммов АМ-грибов, определенная с применением молекулярно-генетической идентификации на Illumina Miseq
- 29. По данным Опик с соавт. 2014 года было известно, что широко распространенный и включающий наибольшее количество
- 31. Скачать презентацию













 Анатомо-физиологические особенности дыхательной системы
Анатомо-физиологические особенности дыхательной системы Организация и технология промышленного семеноводства
Организация и технология промышленного семеноводства Весна воды, тепла и цвета
Весна воды, тепла и цвета отдел моховидные
отдел моховидные Царство Животные. 5 класс
Царство Животные. 5 класс Рамапитек. Антропогенез. Эволюция человека. Часть 2
Рамапитек. Антропогенез. Эволюция человека. Часть 2 Предмет и структура ихтиологической науки
Предмет и структура ихтиологической науки Тип Моллюски
Тип Моллюски Зрительная сенсорная система. Особенности зрительного анализатора у детей. Диагностика, нарушения, гигиена зрения
Зрительная сенсорная система. Особенности зрительного анализатора у детей. Диагностика, нарушения, гигиена зрения Местообитание и внешнее строение рыб
Местообитание и внешнее строение рыб Генетические методы исследования
Генетические методы исследования Жизнь животных зимой
Жизнь животных зимой Выступление на методическом объединении учителей биологии на тему Формирование приемов учебной деятельности в условиях проектного обучения на уроках естественно-научного цикла.
Выступление на методическом объединении учителей биологии на тему Формирование приемов учебной деятельности в условиях проектного обучения на уроках естественно-научного цикла. Sistemul excretor
Sistemul excretor Общее знакомство с цветковыми растениями. Интерактивный кроссворд
Общее знакомство с цветковыми растениями. Интерактивный кроссворд Проблемы сокращения биологического разнообразия
Проблемы сокращения биологического разнообразия Эволюция мочеполовой системы
Эволюция мочеполовой системы Закономерности наследования на организменном уровне. Моно- и полигенное наследование
Закономерности наследования на организменном уровне. Моно- и полигенное наследование Архейская эра. Развитие органического мира
Архейская эра. Развитие органического мира Флора бассейна реки Водлы
Флора бассейна реки Водлы Растения в народной медицине. Лекарственные растения Башкортостана
Растения в народной медицине. Лекарственные растения Башкортостана Анатомия, физиология и патология органа слуха
Анатомия, физиология и патология органа слуха Нервная система
Нервная система Культивирлеу және микроорганизмдердің өсуі
Культивирлеу және микроорганизмдердің өсуі Клеточная теория. История изучения клетки
Клеточная теория. История изучения клетки Теория И.П. Павлова о типах высшей нервной деятельности
Теория И.П. Павлова о типах высшей нервной деятельности Возрастная физиология и психофизиология
Возрастная физиология и психофизиология Оплодотворение. Что такое оплодотворение
Оплодотворение. Что такое оплодотворение