Особенности новейших технологий производства ферментных препаратов: амилаз, протеаз, липаз, лактаз, глюкоксидаз 1 часть презентация
Содержание
- 2. Амилазы Амилолитические ферменты гидролизуют крахмал и другие полисахариды, состоящие из амилозы и амилопектина, мономерные глюкозные единицы
- 3. Амилазы К амилолитическим ферментам в целом принадлежат 85 ферментов, которые гидролизуют гликозидные связи как в полисахаридах,
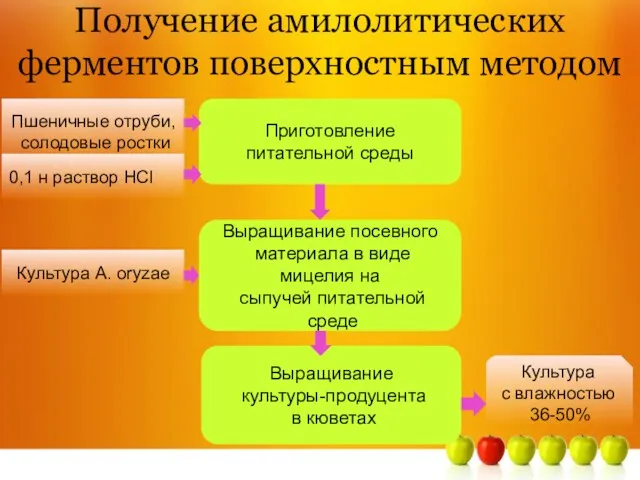
- 4. Получение амилолитических ферментов поверхностным методом Пшеничные отруби, солодовые ростки 0,1 н раствор НCl Приготовление питательной среды
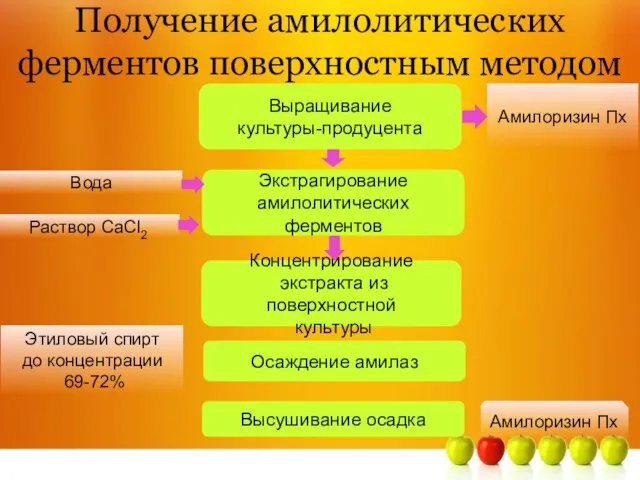
- 5. Получение амилолитических ферментов поверхностным методом Амилоризин Пх Выращивание культуры-продуцента Раствор CaCl2 Концентрирование экстракта из поверхностной культуры
- 6. Технология получения амилолических ферментов поверхностным способом В случае использования поверхностного культивирования продуцентами могут быть: Aspergillus oryzae,
- 7. Технология получения кристаллической α-амилазы Препарат со степенью очистки 3х растворяют в воде очищенной. Суспензию после растворения
- 8. Технология получения кристаллической α-амилазы Фракционирование риванолом (соль молочной кислоты) осуществляют двумя этапами: Вносят 50% расчетного количества
- 9. ПРОТЕАЗЫ Субстратами для протеолитических ферментов являются пептиды и белки (протеины и протеиды). Все протеазы делятся на
- 10. ПРОТЕАЗЫ Ацидин-пепсин Таблетки, содержащие пепсин:ацидин (бетаин гидрохлорид)=1:4. Назначают для лечения гипо- и анацидных гастритов Вобензим Комбинированный
- 11. ТЕХНОЛОГИЯ Микроорганизмы – главные источники протеолитических ферментов. В промышленности чаще получают комплекс протеолитических ферментов, преимущества которого
- 12. ТЕХНОЛОГИЯ поверхностный способ культивирования Продуценты - Aspergillus oryzae, Aspergillus flavus, Aspergillus terricola. Питательная среда – увлажненные
- 13. ТЕХНОЛОГИЯ глубинный способ культивирования Продуценты - в основном род Bacillus: Bacillus subtilis, Bacillus mesentericus. Препараты –
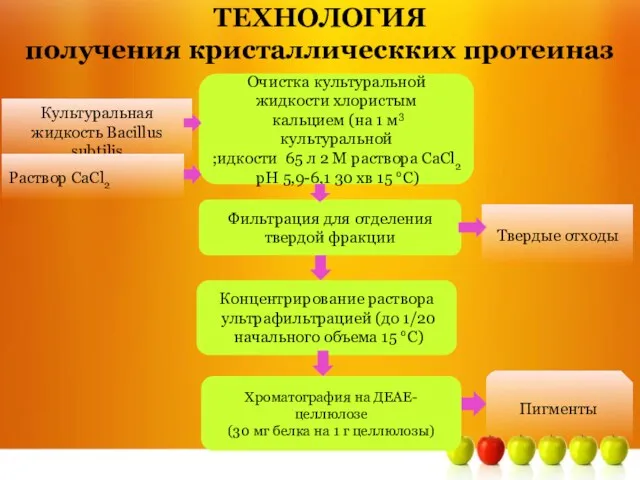
- 14. Культуральная жидкость Bacillus subtilis Раствор СаCl2 Очистка культуральной жидкости хлористым кальцием (на 1 м3 культуральной ;идкости
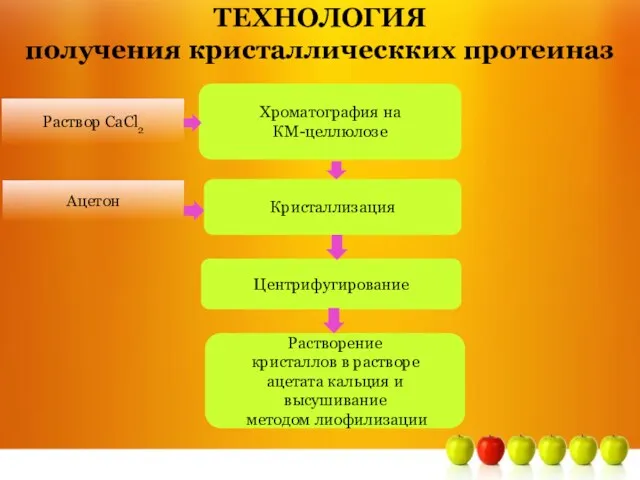
- 15. Раствор СаСl2 Хроматография на КМ-целлюлозе Ацетон Кристаллизация Центрифугирование ТЕХНОЛОГИЯ получения кристаллическких протеиназ Растворение кристаллов в растворе
- 16. ТЕХНОЛОГИЯ получения кристаллическких протеиназ Ультрафильтрация. Экспериментально установлено, что луше использовать мембраны с порами размером 54∙10-10 м,
- 17. ТЕХНОЛОГИЯ получения кристаллическких протеиназ Протеолитический комплекс ферментов B. Subtilis не сорбируется на ДЕАЕ-целлюлозе и выходит из
- 19. Скачать презентацию












 Тип Членистоногие (Arthropoda). Класс Скрыточелюстные насекомые (Insecta - Entognatha)
Тип Членистоногие (Arthropoda). Класс Скрыточелюстные насекомые (Insecta - Entognatha) Эволюционное учение (урок обобщающего повторения для 10 класса)
Эволюционное учение (урок обобщающего повторения для 10 класса) Цветковые растения
Цветковые растения История развития биологических знаний. Предмет, задачи и методы биологии. Основные концепции современной биологии
История развития биологических знаний. Предмет, задачи и методы биологии. Основные концепции современной биологии Гідрологія. Показники якості води
Гідрологія. Показники якості води Сердечно-сосудистая система. Сердце. Кровеносные сосуды. Лимфатическая система
Сердечно-сосудистая система. Сердце. Кровеносные сосуды. Лимфатическая система Презентация к уроку биологии Царство: грибы 6 класс Часть 2 Диск
Презентация к уроку биологии Царство: грибы 6 класс Часть 2 Диск Цитоскелет
Цитоскелет Физиология ЦНС. Промежуточный мозг и ретикулярная формация
Физиология ЦНС. Промежуточный мозг и ретикулярная формация Урок-презентация по теме :Бабочки.
Урок-презентация по теме :Бабочки. Происхождение человека (антропогенез)
Происхождение человека (антропогенез) Розовый слон
Розовый слон Гепард
Гепард Презентация по биологии 6 класс Мхи
Презентация по биологии 6 класс Мхи Генетика человека
Генетика человека Живые организмы весной
Живые организмы весной Видоизменения побегов
Видоизменения побегов Cellular Respiration
Cellular Respiration 20230330_genetika_obnov_wecompress.com_
20230330_genetika_obnov_wecompress.com_ Применение проектной технологии на уроках биологии и во внеурочной деятельности
Применение проектной технологии на уроках биологии и во внеурочной деятельности Зоология позвоночных. Надкласс четвероногие. (Лекция 7)
Зоология позвоночных. Надкласс четвероногие. (Лекция 7) Гортензия метельчатая Bombshell
Гортензия метельчатая Bombshell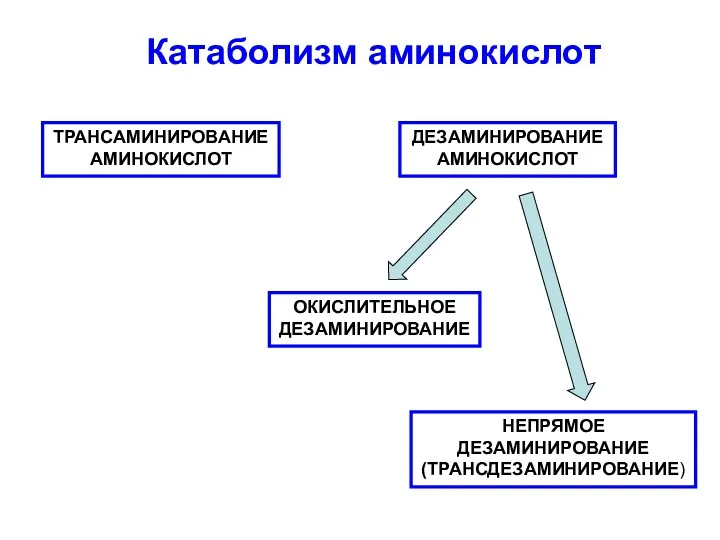 Катаболизм аминокислот
Катаболизм аминокислот Разнообразие рептилий
Разнообразие рептилий Digestion
Digestion Перелетные птицы
Перелетные птицы Популяция. Свойства популяций
Популяция. Свойства популяций Красная книга Крыма
Красная книга Крыма