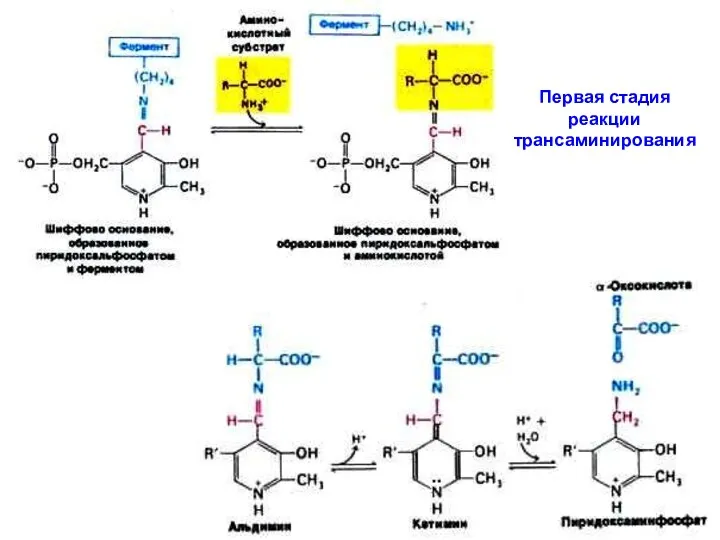
Трансаминирование катализируют аминотрансферазы; кофер-мент – пиридоксальфосфат (предшественник – витамин В6,
пири-доксин).
Пиридоксальфосфат ковалентно связан с остатком лизина-258
в каталитическом центре фермента. Ключевую роль играет альдегидная группа пиридоксальфосфата. Трансаминирование протекает в 2 стадии:
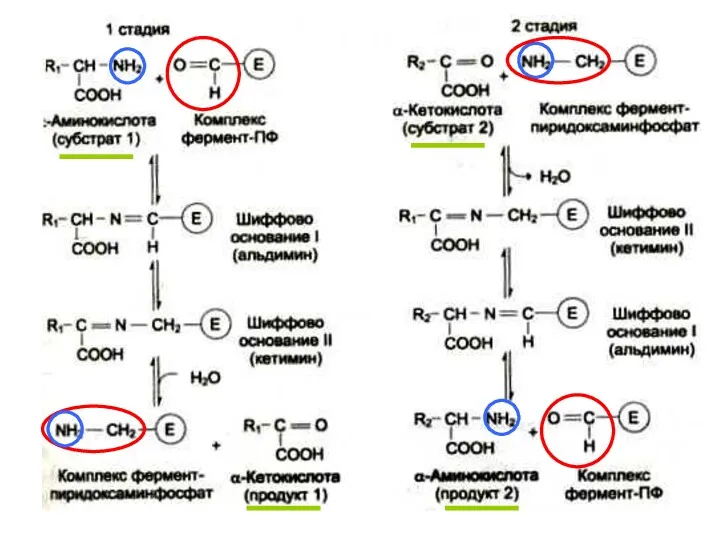
1-я стадия: α-аминогруппа (из субстрата 1) отделяется и ковален-тно связывается с альдегидной группой кофермента – происхо-дит обратимая ковалентная модификация каталитического центра фермента + новая кетокислота (продукт 1). Пиридоксаль-фосфат превращается в пиридоксаминфосфат.
2-я стадия: α-кетокислота (из субстрата 2) взаимодействует с пиридоксаминфосфатом: аминогруппа переходит на кетокислоту + новая аминокислота (продукт 2), а пиридоксаминфосфат возвращается в свою исходную форму - пиридоксальфосфат.
Это типичная двухсубстратная ферментативная реакция. Один каталити-
ческий центр в данный момент времени может взаимодействовать с од-
ной молекулой субстрата. Если субстратов два, то они реагируют с цент-
ром последовательно.







 Значение фотосинтеза и биологического круговорота веществ в развитии жизни
Значение фотосинтеза и биологического круговорота веществ в развитии жизни В гости к весне. (2 класс)
В гости к весне. (2 класс) Цитоскелет. Включения
Цитоскелет. Включения Презентация к уроку биологии 6 кл.
Презентация к уроку биологии 6 кл. Неорганические вещества клетки
Неорганические вещества клетки Рыбы Онежского озера
Рыбы Онежского озера зрительный_анализатор
зрительный_анализатор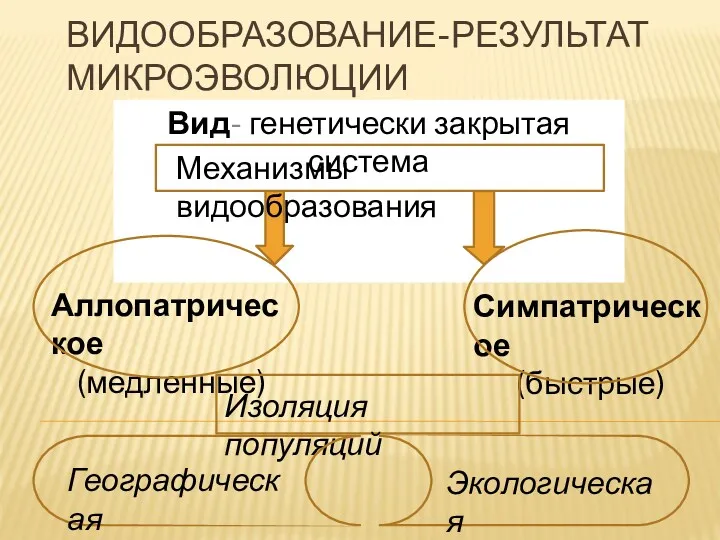 Видообразование. Результат макроэволюции
Видообразование. Результат макроэволюции Лекция. Витамины
Лекция. Витамины Класс птицы
Класс птицы Терморегуляция
Терморегуляция Развитие и устойчивость экосистем
Развитие и устойчивость экосистем Викторина Животные
Викторина Животные Строение амёбоидной клетки, на примере Amoeba proteus и Arcella sp
Строение амёбоидной клетки, на примере Amoeba proteus и Arcella sp Маленькая система большого значения или вся правда об эндокринной системе
Маленькая система большого значения или вся правда об эндокринной системе Патогенность микроорганизмов. Вирулентность. Факторы адгезии, мимикрия, ферменты, токсины
Патогенность микроорганизмов. Вирулентность. Факторы адгезии, мимикрия, ферменты, токсины Ритмы здоровья. Витаминно-минеральный комплекс
Ритмы здоровья. Витаминно-минеральный комплекс Бионика. Виды бионики
Бионика. Виды бионики Губки. Происхождение многоклеточных
Губки. Происхождение многоклеточных Отряд Парнокопытные
Отряд Парнокопытные Отряд Опоссумы (Didelphimorphia)
Отряд Опоссумы (Didelphimorphia) Водоросли – низшие растения
Водоросли – низшие растения Плоские черви
Плоские черви Немного о лецитине
Немного о лецитине Строение и функции белков – 2
Строение и функции белков – 2 Насекомые. Отличительные признаки насекомых (1 класса)
Насекомые. Отличительные признаки насекомых (1 класса) Пищеварительная система
Пищеварительная система Тайны лесного царства. Игра
Тайны лесного царства. Игра