Слайд 2

Радиобиологические эффекты
— это функциональные и морфологические изменения, развивающиеся в организме
в результате воздействия на него ионизирующего излучения. Биологические эффекты различны, и зависят от вида и интенсивности облучения.
К биологическим эффектам ионизирующего излучения относятся:
1. Эффект естественного радиационного фона.
2. Эффект малых доз.
3. Эффект больших доз
Слайд 3

Отдаленные последствия облучения
— детерминированные и стохастические эффекты, проявляющиеся через длительное
время (несколько месяцев или лет) после одноразового или в результате хронического облучения.
В основе отдаленных последствий облучения лежат 3 типа нарушений, возникающих в клетках под непосредственным воздействием ионизирующих излучений:
1) Гибель части стволовых клеток в системах клеточного самообновления – невосполнимая утрата части их приводит к развитию гипопластических прцессов. (Анемия, анацидный гастрит, атрофические изменения в гонадах)
2) Длительное хранение (консервация) ненаследственных изменений в клетках таких как нервная, мышечная.
3) Нелетальные наследственные нарушения, затрагивающие один из гомологичных локусов.
Слайд 4

Отдалённые эффекты можно разделить на:
* По тому, у кого проявляются признаки:
1.
Соматические (проявляющиеся в облученном организме)
2. Генетические (наблюдаемые у потомства)
* Пороговые или беспороговые.
Стохастические эффекты — последствия, носящие вероятностный, случайный характер. Вероятность их проявления существует при облучении в малых дозах ИИ. С их увеличением она возрастает, но при этом тяжесть течения процесса от них не зависит. К ним относятся:
1. Генетические последствия
2. Опухолевые эффекты
2.1 Гормонозависимые опухоли(матки, молочных желёз, щитовидной железы, яичника, гипофиза)
2.2 Гормононезависимые опухоли( печени, лёгких, костей и лейкозы)
Нестохастические (детерминированные) эффекты — последствия, проявляющиеся после накопления в организме дозы облучения, превышающей пороговую. В этом случае тяжесть поражения зависит от дозы. К ним относятся:
1. Гипопластические и апластические процессы
2. Склеротические процессы (цирроз печени, нефросклероз, пневмосклероз (>40-50 Гр, сначала через 4-6 мес развивается пневмония, затем склероз (что имеет место после радиотерапии)),очаговая или диффузная глиальная реакция в головном мозге, артериосклероз, кожные фиброзы – хронический лучевой дерматит, лучевая катаракта)
3. Дисгормональные состояния (ожирение, эстрогенизм, альдостерониз )
4. Преждевременное старение и сокращение продолжительности жизни
Слайд 5

Генетические (наследственные) эффекты облучения
вызванные ионизирующим излучением биологические эффекты, обусловленные повреждением генома
(появление доминантных и рецессивных генных мутаций) половых клеток облученного организма и проявляющиеся у его потомства.
Ионизирующее излучение вызывает мутации любого рода — от точечных замен до хромосомных аберраций и разрывов.
Слайд 6

Опухолевые эффекты.
Основной причиной злокачественной трансформации облученной клетки являются нелетальные повреждения генетического
материала. Наиболее распространена гипотеза, в соответствии с которой под влиянием облучения повышается нестабильность ядерной ДНК. В процессе репарации ее нелетальных повреждений возникают условия, способствующие включению онковируса в геном соматической клетки или активации онковируса, уже находившегося в репрессированном состоянии в составе генома, с последующей раковой трансформацией.
Слайд 7

Лейкозы.
Проявляются раньше других, они становятся виновниками летальных исходов уже через 10
лет после обучения. Среди людей, подвергшихся действию проникающей радиации после бомбардировок Хиросимы и Нагасаки, смертность от лейкозов пошла на убыль только после 1970 года. Согласно данным НКДАР ООН (Научного комитета по действию атомной радиации), вероятность заболевания лейкозом составляет 1 шанс из 500 при получении дозы облучения 1 Гр.
Слайд 8

Среди наиболее впечатляющих цифр могут быть приведены данные о заболеваемости лейкозом
японцев всех возрастных групп на 1945 г. — 12,8 на млн. жителей в год, и данные о заболеваемости лейкозом пострадавших, находившихся на расстоянии до 1500 м от эпицентра — 458 на 1 млн. Заболеваемость среди находившихся на расстоянии до 1000 м оказалась еще в 3 раза выше. Имеется указание, что для детей 0—9 лет при расстоянии от 1000 до 1 1500 м показатель заболеваемости оказался в 1,5 раза выше, чем средний, и составлял 673 на 1 млн.
Вторым важным выводом, сделанным на основании изучения атомных бомбардировок, были данные о длительности латентного периода для радиационных лейкозов. Оказалось, что он имеет значительную протяженность во времени. Минимальные сроки латентного периода приближались к трем годам, средние составляли от 4 до 8 лет, а точные границы максимальных сроков еще не могут быть установлены с точностью, так как до настоящего времени среди лиц, переживших атомную бомбардировку, наблюдаются лейкозы.
Третьим важным выводом, сделанным при изучении лейкозов в Хиросиме и Нагасаки, явилось приблизительное определение дозы облучения, удваивающей частоту лейкозов в группе облученных людей. Эта доза составляет около 50 р. В то же время не удалось установить минимальной дозы облучения, приводящей к лейкозогенному эффекту.
Выявлена закономерность: чем в более молодом возрасте облучается человек, тем короче латентный период до возможного развития лейкоза или другой опухоли. С повышением дозы облучения частота лейкозов нарастает.
Слайд 9
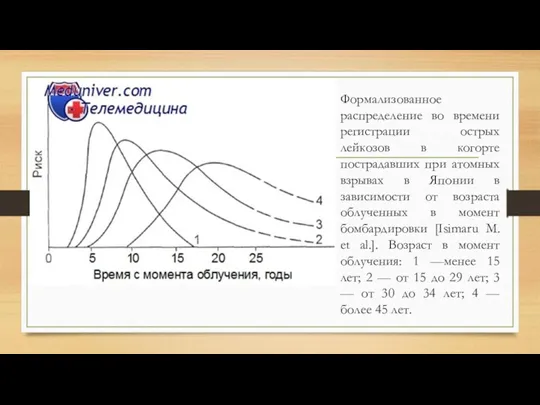
Формализованное распределение во времени регистрации острых лейкозов в когорте пострадавших при
атомных взрывах в Японии в зависимости от возраста облученных в момент бомбардировки [Isimaru M. et al.]. Возраст в момент облучения: 1 —менее 15 лет; 2 — от 15 до 29 лет; 3 — от 30 до 34 лет; 4 — более 45 лет.
Слайд 10

Среди ликвидаторов рассматривались два периода наблюдения: 1986-1996 годы и 1997-2003 годы.
Если сравнить по частоте заболеваемости лейкозами только две группы ликвидаторов, получивших дозы внешнего облучения до 150 мГр и более 150 мГр, то можно обнаружить, что в течение первых десяти лет наблюдения заболеваемость лейкозами во второй группе, (при дозах более 150 мГр) была в 2,2 раза выше, чем в первой. Вместе с тем во второй период наблюдения (1997-2003 годы) отличия между указанными выше группами по частоте заболеваемости лейкозами не выявлено. Среди детей и взрослых людей, проживающих в зараженных районах, такое возрастание не было четко продемонстрировано. На основе данных о людях, выживших после взрывов бомб в Японии, можно предположить, что сейчас, спустя более 30 лет после катастрофы, большинство случаев лейкемии, которые могут быть связаны с Чернобыльской аварией, уже произошло. Тем не менее, необходимы дальнейшие исследования для получения более точных данных.
Слайд 11

Рак щитовидной железы.
Еще чаще развивается рак щитовидной железы – по информации
того же НКДАР он поражает 10 человек из каждой тысячи облученных (в расчете на индивидуальную поглощенную дозу 1 Гр). С такой же частотой развивается и рак груди у женщин. Правда, оба этих заболевания, несмотря на злокачественность, приводят к смерти далеко не всегда: выжить удается 9 из 10 человек, перенесших рак щитовидной железы, и каждой второй заболевшей раком молочной железы женщине.
Слайд 12

Значительное увеличение заболеваемости раком щитовидной железы произошло у людей, которые были
детьми и подростками во время аварии на ЧАЭС и проживали в наиболее зараженных районах Беларуси, Российской Федерации и Украины. Это было вызвано высокими уровнями радиоактивного йода, который вырвался из реактора Чернобыльской атомной электростанции в первые дни после аварии. Радиоактивный йод осел на пастбищах, где паслись коровы, и затем сконцентрировался в их молоке, впоследствии употребляемом детьми. К тому же, положение усугублялось общим дефицитом йода в местном рационе питания, что привело к еще большему аккумулированию радиоактивного йода в щитовидной железе. Поскольку срок жизни радиоактивного йода является коротким, если бы люди прекратили давать местное зараженное молоко детям в течение нескольких месяцев после аварии, вероятно, в большинстве случае не произошло бы увеличения рака щитовидной железы, индуцированного радиацией. В Российской Федерации в наибольшей степени подверглись радиационному загрязнению 4 области: Брянская, Калужская, Орловская и Тульская.
Слайд 13
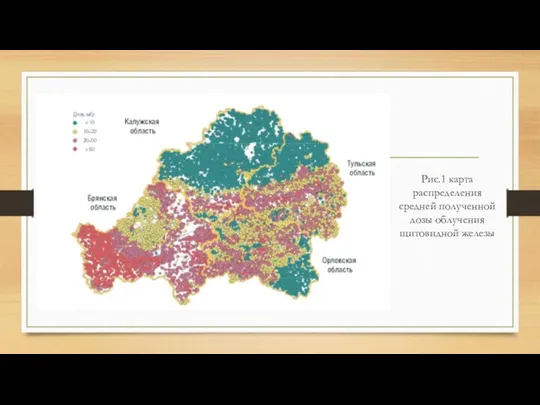
Рис.1 карта распределения средней полученной дозы облучения щитовидной железы
Слайд 14
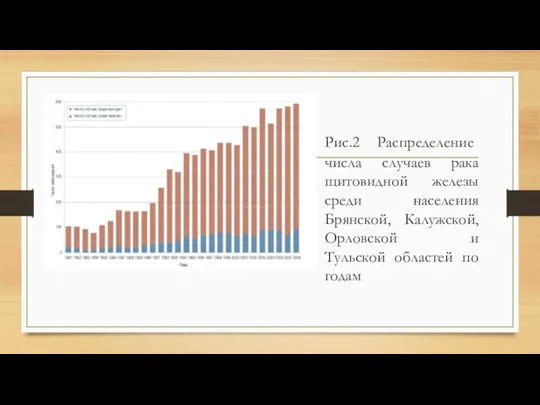
Рис.2 Распределение числа случаев рака щитовидной железы среди населения Брянской, Калужской,
Орловской и Тульской областей по годам
Слайд 15

Рак легких.
Одно из самых грозных отдаленных последствий, которое проникающая радиация может
вызвать у людей, – это рак легких. Рак легкого развивается под влиянием длительного вдыхания радиоактивной пыли, а также газообразных радиоактивных веществ - радона и его продуктов.
Согласно исследованиям, наиболее высока вероятность заболеть им у шахтеров урановых родников – в 4-7 раз выше, чем у тех, кто пережил атомную бомбардировку. По мнению специалистов НКДАР, одна из причин этого – возраст шахтеров, которые в подавляющем большинстве старше облученного населения японских городов.
Слайд 16

Гипопластическая (апластическая) анемия
- резкое угнетении костномозгового кроветворения, что сопровождается снижением
количества эритроцитов, лейкоцитов и тромбоцитов.
Предполагают несколько механизмов развития АА:
1. поражение полипотентной стволовой клетки костного мозга (стволовые клетки-активно делящиеся клетки). Эта причина является основной;
2. подавление кроветворения, связанное с воздействием иммунных механизмов (клеточных, гуморальных); (лимфоциты наиболее радиочувствительные клетки в периферической крови)
3. нарушения функционирования элементов микроокружения;
4. дефицит факторов, стимулирующих кроветворение.
Слайд 17

Радиационный энтерит и колит
Воздействие массивного облучения может вызывать энтерит и
колит спустя длительное время (иногда - годы) после завершения лучевой терапии. Пороговая доза для отсроченного повреждения слизистой оболочки находится в диапазоне 40 Гр. Она не связана с острым повреждением слизистой оболочки, а является следствием лучевого поражения мелких сосудов: эндартериит, микротромбы и ишемия кишки. Все это приводит к возникновению фиброза, отека стенки кишки с формированием сужения, непроходимости сосудов слизистой оболочки с ее вторичным повреждением.
Слайд 18

Поражение половых клеток.
Облучение малыми дозами не приводит к структурным изменениям семенников.
При местном облучении большими дозами (5 Гр и более) отмечаются постепенное уменьшение их размеров и гибель спермиогенного эпителия. Дегенеративные изменения в паренхиме железы при тяжелой форме острой лучевой болезни наступают на 2...3-й день после облучения. Первоначально поражаются спермиогонии, затем спермиоциты I и II порядков. Спермиды и зрелые спермии повреждаются в последнюю очередь.
У выживших - спермиогенез восстанавливается за счет сохранившихся спермиогонии, однако при этом отмечается большой процент дефектных спермиев, а в паренхиме семенников — развитие склеротических процессов.
Слайд 19

Лучевые поражения яичников.
У организмов раннего возраста и в период полового
созревания яичники более радиочувствительны, чем у половозрелых. У последних, в свою очередь, радиочувствительность железы зависит от ее функциональной активности. Например, облучение в период созревания фолликулов вызывает изменения яичников в большей степени, чем во время роста и развития желтого тела. В яичнике различают корковое и мозговое вещество. В корковом слое содержится большое количество половых клеток. При общем облучении у самок возникают изменения половых циклов, степень и направленность которых зависят от дозы воздействия. Картина радиационного поражения яичников при однократном облучении самок полулетальными и более высокими дозами излучений: вначале наблюдаются повреждения и гибель наиболее радиочувствительных тканевых элементов железы — зрелых фолликулов, затем дегенерация и гибель первичных фолликулов и других клеточных элементов. Многократные лучевые воздействия на яичники приводят к деструкции фолликулярного эпителия и фиброзному разрастанию соединительной ткани железы.
Слайд 20

Изменения в яичниках при поступлении в организм радионуклидов с равномерным типом
распределения в принципе равнозначны поражениям, которые наблюдаются в железе при общем внешнем облучении. При воздействии радиации вначале нарушается гормональная функция гонад и других функционально связанных с ними эндокринных желез. Вслед за этим или одновременно возникают морфологические изменения половых желез. Инкреторные сдвиги у облученных самок характеризуются изменением динамики половых циклов. Известно, что полноту и регулярную смену стадий половых циклов обеспечивают гонадотропный гормон гипофиза, фолликулярный гормон, гормон желтого тела и плацента.
В гуморальной регуляции функции гонад при облучении возникают дисгормональные состояния. Гормональные сдвиги эндокринных желез часто сопровождаются пролиферативными процессами в них и в том числе в гонадах, результатом чего в отдаленный период может быть рост злокачественной опухоли. Восстановление функции гонад как при остром, так и при хроническом лучевом поражении идет медленно и параллельно с общим выздоровлением.
Слайд 21

Лучевая катаракта
Лучевой катарактой называют помутнение хрусталика, которое возникает вследствие его повреждения
ионизирующим излучением.
В клинике развития лучевой катаракты принято различать два периода:
• Латентный или скрытый, который охватывает период времени от момента непосредственного облучения до проявления первых признаков заболевания.
• Период прогрессирования, продолжающийся вплоть до стабилизации катаракты либо полного помутнения хрусталика.
Слайд 22
Скорость помутнения хрусталика, продолжительность латентного периода и интенсивность прогрессирования катаракты напрямую
зависят от величины дозы полученного облучения, вида излучения, фактора времени, возраста пострадавшего. Самая маленькая доза однократного бета/гамма воздействия, способного привести к развитию лучевой катаракты, составляет примерно 200 рад, с поглощением непосредственно в хрусталике; при воздействии дробно, эта доза может увеличиваться до 400-550 и более рад.
Особенно большой катарактогенной способностью, в сравнении с другими видами ионизирующего излучения, обладают нейтроны. При комбинированном однократном гамма-нейтронном воздействии на глаз дозой в 150-700 рад лучевую катаракту можно клинически обнаружить спустя 2-7 лет. В течение следующих 3-6 лет после выявления первых проявлений лучевой катаракты образуется различной степени помутнение, что зависит от дозы излучения. Далее развитие лучевой катаракты приостанавливается, и помутнение медленно распространяется в глубокие слои хрусталиковой коры.
При дозах свыше 700 рад возникновение лучевой катаракты выявляется спустя 1,5 или 2 года после облучения; в случае поражения сосудистой оболочки, спустя 2,5 - 3 года после облучения констатируется полное помутнение хрусталика.
Первичное лучевое поражение хрусталика происходит в герминативной (ростковой) зоне эпителия хрусталика, которая находится под передней капсулой рядом с экватором.
Помутнение под передней капсулой хрусталика, состоящее из скопления точечных, штриховидных помутнений и вакуолей, обычно появляется позже и никогда не достигает такой интенсивности, как у заднего полюса.
Когда основная масса поврежденных клеток переместится с экватора к полюсам хрусталика, помутнение стабилизируется и постепенно отодвигается нормально растущими прозрачными хрусталиковыми волокнами от задней капсулы внутрь хрусталика. В таком состоянии помутнение может оставаться (не прогрессируя) в течение всей последующей жизни организма. Полное помутнение хрусталика может развиваться в результате лучевого поражения сосудистой оболочки глаза. Степень понижения остроты зрения зависит от размера помутнения хрусталика.
Слайд 23

Лучевые повреждения легких
Лучевые повреждения легких могут развиваться при лучевой терапии
рака легких, пищевода, молочной железы и т.д. Предрасполагающими факторами являются хронические воспалительные заболевания легких. Лучевые повреждения могут развиваться остро во время лучевой терапии, в ближайшие недели и месяцы после ее окончания и в более поздние сроки после применения доз более 2000—5000 рад.
Лучевые повреждения легких возникают в связи с тем, что толерантность легочной ткани к лучевым воздействиям находится в пределах 35 - 40 Гр, а при лечении злокачественных опухолей используют суммарные очаговые дозы около 60 - 80 Гр. В ходе лучевого воздействия на первом этапе поражаются клетки альвеолярного эпителия и эндотелия капилляров: в результате повреждения альвеолоцитов II типа уменьшается синтез сурфактанта, повышается поверхностное натяжение альвеол, происходит спадение альвеолярных стенок; повреждение эндотелиальных клеток капилляров, ведет к тромбообразованию, изменению тонуса сосудов и обструкции просвета сосуда.
Слайд 24

Лучевой дерматит (рентгеновский дерматит)
это воспалительные изменения, происходящие в коже в
результате воздействия ионизирующего излучения.
При лучевом дерматите под воздействием излучения происходит разрыв или спазм капилляров, ведущие к нарушению структуры капиллярного русла, что нарушает микроциркуляцию крови и повышает давление в сосудах. При нарастании излучения начинаются склеротические процессы, это грозит возникновением локальной гипоксии.
Изменения, которые зачастую невозможно обратить, приводят к лучевым дерматитам, имеющим две формы: острую и хроническую.
Слайд 25

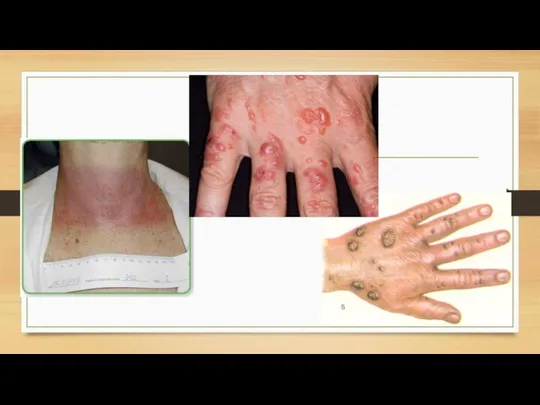
На эпидермисе лучевой дерматит может проявляться в таких формах:
• эритематозная форма. Если
доза облучения составляет 8-12 Гр, сопровождается покраснением, которые проходит через 3-4 дня, выпадают волосы, но начинают расти через несколько дней ,
• буллезная. Эта форма болезни появляется при действии облучения в дозе 12-20 Гр, начинается с эритемы, область поражения болит, на этом месте выпадают волосы, ощущается жжение, остаются пигментные пятна. Проходит через 6-7 недель
некротическая. Она проявляется при влиянии на эпителий облучения свыше 25 Гр; кожа отслаивается, образуются язвы. Самостоятельно, без лечения лучевой дерматит такого вида не проходит.
Слайд 26
Слайд 27

Дисгормональные состояния.
Эндокринная система находится в самой тесной связи с нервной системой.
Обе регулирующие системы объединяются гипоталамусом, нейросекреторные клетки которого занимают промежуточное положение между нейронами и инкреторными клетками желез внутренней секреции.
В ряду радиочувствительности органов (по функциональному принципу) эндокринные железы следуют за нервной системой.
Чувствительность эндокринных желез на лучевой раздражитель является в основном опосредованной реакцией и осуществляется рефлекторным путем через нервную систему.
Слайд 28

Изменения в гипофизе после облучения.
Вначале после облучения повышается адренокортикотропная функция
гипофиза, а в отдаленные сроки наступает ее снижение. При облучении в сублетальных дозах усиливается тирео- и гонадотропная функции. Летальные дозы резко снижают и соответственно угнетают гормональную активность щитовидной и половых желез. В результате нарушения секреции и выделения тропных гормонов гипофиза регулируемые ими железы могут оказаться в состоянии физиологической изоляции (разобщенности).
Морфологические изменения в гипофизе после лучевого воздействия не имеют четкой специфичности. Обычно отмечают набухание и уменьшение числа ацидофильных клеток, появление пикнотических ядер в хромофильных клетках, дегрануляцию и преобразование протоплазмы в гомогенный коллоид. Сдвиги в гипофизе происходят в результате нарушения в гипоталамо-гипофизарной системе.
Слайд 29

Изменения в надпочечниках после облучения.
В первый период (часы, иногда сутки) после
облучения в широком диапазоне доз (от 0,25 до 50 Гр) наблюдается усиление секреции надпочечниковых желез. Гиперсекреция коры надпочечников — один из механизмов опосредованных изменений крови и кроветворных органов. Изменяются масса надпочечников, величина корковой и мозговой зон, уменьшается содержание липоидных субстанций. В облученных надпочечниках отмечается возрастание активности кислой фосфатазы, протеолитических ферментов и развитие деструктивных изменений.
В коре надпочечников при облучении преобладающую роль, по-видимому, играет опосредованное влияние радиации, в частности со стороны нервной системы, гипофиза и других органов. Таким образом, в острый период лучевого поражения повышается функциональная активность надпочечников, а в последующие сроки наступает истощение коркового и мозгового вещества и развитие атрофических процессов.
Слайд 30

Изменения в щитовидной железе после облучения.
Первичная реакция ЩЖ на облучение характеризуется
гиперфункцией, за которой в зависимости от дозы облучения и других условий следует нормализация или снижение функции. В отдаленные сроки наблюдается дисфункция железы, выражающаяся периодичностью гипер- или гипофункции. Уменьшается относительная масса щитовидной железы, преобладают фолликулы крупного диаметра с низким эпителием и густым коллоидом, появляются деструктивные изменения в отдельных фолликулах. В мышечной ткани обычно накапливается большое количество тироксина, и одновременно с этим ускоряется его выведение из печени. В отдаленные сроки на фоне деструктивных пострадиационных изменений возможно развитие злокачественных новообразований в щитовидной железе.
Изменения функциональной активности щитовидной железы при общем внешнем облучении животных в основном определяются тиреотропной функцией гипофиза.
Слайд 31

Преждевременное старение и сокращение продолжительности жизни.
Единого мнения о безусловном влиянии радиации
на среднюю продолжительность жизни человека (СПЖ) у современных ученых нет. Но опыты на грызунах показали, что связь между облучением и более ранней смертностью есть. После получения дозы 1 Гр продолжительность жизни грызунов сокращалась на 1-5 %. Длительное воздействие гамма-излучения приводило к сокращению СПЖ при накоплении суммарной дозы 2 Гр. Причем смерть в каждом случае наступала от разных болезней, вызываемых радиацией: склеротических изменений, злокачественных новообразований, лейкозов и других патологий.
Слайд 32

По оценкам разных ученых сокращение СПЖ человека составляет:
• при кратковременном облучении –
100-1000 суток на 1 Гр;
• при хроническом облучении – около 8 суток на 1 Гр.
При анализе феномена сокращения СПЖ не удается выделить какой-нибудь типичный патологический процесс, непосредственно приводящий облученных животных к преждевременной гибели. В тех случаях, когда причину смертельного исхода у отдельных особей удавалось связать с каким-то конкретным патологическим процессом, это мог быть и сосудистый криз, и новообразование, и склеротические изменения, и лейкоз и т.д.
Основной причиной сокращения СПЖ после облучения в сублетальных дозах в настоящее время называют повреждение капилляров и мелких артериол, нарушения микроциркуляции, приводящие к гипоксии и гибели паренхиматозных клеток, преимущественно, в органах иммунитета и железах внутренней секреции. Отчасти сокращение СПЖ может быть связано с более частым развитием у облученных злокачественных новообразований.































 Строение ядра. Хромосомы
Строение ядра. Хромосомы Класс Птицы
Класс Птицы Растительные сообщества и взаимосвязи в них
Растительные сообщества и взаимосвязи в них Детям о насекомых
Детям о насекомых Морфологический критерий вида
Морфологический критерий вида Зрение. Строение глаза
Зрение. Строение глаза Оплодотворение у цветковых растений
Оплодотворение у цветковых растений Классификация животных и растений. Эволюция
Классификация животных и растений. Эволюция Тип членистоногие
Тип членистоногие Микроскопические частицы вирусы
Микроскопические частицы вирусы Грибы - часть живой природы
Грибы - часть живой природы Класс Хрящевые рыбы
Класс Хрящевые рыбы Генетика аддиктивного поведения. Преступность и наследственность
Генетика аддиктивного поведения. Преступность и наследственность Мембраналардың иондық каналдары
Мембраналардың иондық каналдары Урок-игра по теме В мире рыб
Урок-игра по теме В мире рыб Легенева вентиляція. Регуляція дихання
Легенева вентиляція. Регуляція дихання Селекцiя
Селекцiя Строение и функции скелета человека
Строение и функции скелета человека Хрящевые рыбы
Хрящевые рыбы Презентация Сообщества воды 5 класс
Презентация Сообщества воды 5 класс Кинетические дисфункции СБС
Кинетические дисфункции СБС Фитотерапия - лечение лекарственными травами. 1 класс
Фитотерапия - лечение лекарственными травами. 1 класс Semenné rostliny Spermatophyta
Semenné rostliny Spermatophyta Растения-хищники. 6 класс
Растения-хищники. 6 класс Царства живой природы
Царства живой природы Поведінка
Поведінка Анатомия и физиология человека
Анатомия и физиология человека Carbohydrate Metabolism I: Aerobic oxidation of glucose. Anaerobic Glycolysis. Gluconeogenesis
Carbohydrate Metabolism I: Aerobic oxidation of glucose. Anaerobic Glycolysis. Gluconeogenesis