Содержание
- 2. Химический состав бактериальной клетки
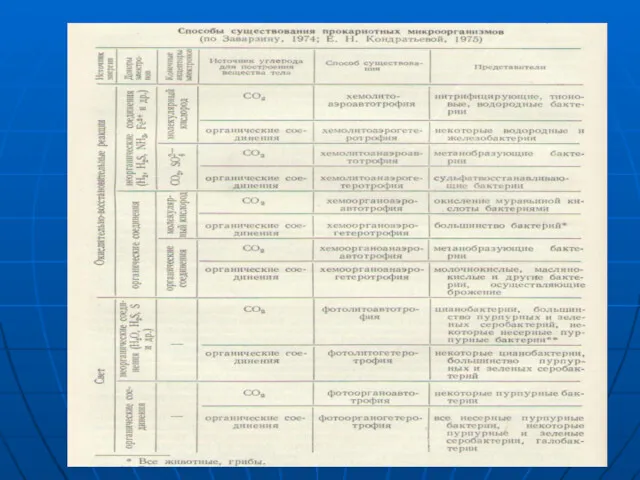
- 3. I группа – макробиогенные (N, H, O, C) II группа – олигобиогенные (К, Na, Cl, S,
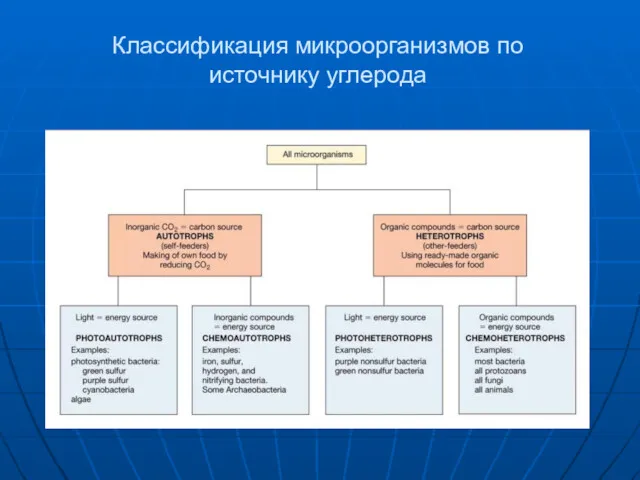
- 4. Классификация микроорганизмов по источнику углерода
- 6. в в а
- 8. Питательные среды делят по консистенции, составу, назначению. В зависимости от консистенции различают жидкие (мясопептонный бульон, сахарный
- 9. Простые(универсальные, основные) питательные среды мясо-пептонный бульон (МПБ) — жидкая среда мясо-пептонный агар (МПА) — плотная среда
- 10. Сложные среды с повышенной питательной ценностью Обогащенные углеводами (сахарный бульон/агар) Обогащенные белками (кровяной, сывороточный, асцит бульон/агар)
- 11. Элективные (избирательные) питательные среды Обеспечивают преимущественный рост определенной группы бактерий Среда Леффлера (свернутая сыворотка крови с
- 12. Элективные (избирательные) питательные среды (продолжение) Щелочной агар для холерного вибриона Желточно-солевой агар для S. aureus
- 13. Элективные (избирательные) питательные среды (продолжение) Агар Сабуро для обнаружения дрожжей и плесневых грибов
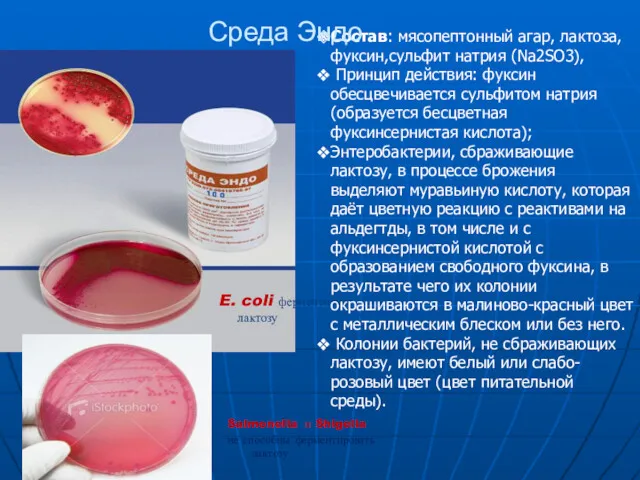
- 14. Дифференциально-диагностические среды Позволяют дифференцировать группы или виды бактерий по ферментативной активности Среды Эндо, Левина, Плоскирева –
- 15. E. coli ферментирует лактозу Salmonella и Shigella не способны ферментировать лактозу Состав: мясопептонный агар, лактоза,фуксин,сульфит натрия
- 16. Среда Плоскирева селективная среда для выделения шигелл и сальмонелл. В состав среды Плоскирева входят ингибирующие вещества
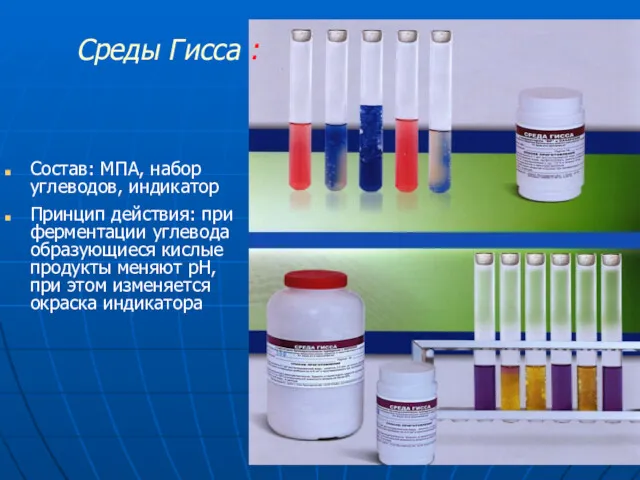
- 17. Состав: МПА, набор углеводов, индикатор Принцип действия: при ферментации углевода образующиеся кислые продукты меняют рН, при
- 18. Содержит 1% лактозу, 0.1% глюкозу, тиосульфат натрия и сульфат железа, индикатор фенол рот. Посев по поверхности
- 19. Дифференциально-диагностические среды (продолжение) Окислительно-ферментативные среды для опледеления типа дыхания бактерий Среда Симмонса для определения способности микроорганизмов
- 20. Выделение отдельных видов бактерий из исследуемого материала, содержащего, как правило, смесь различных микроорганизмов, является одним из
- 21. Определение числа бактерий Общее число клеток определяется а) путем подсчета клеток под микроскопом в окрашенном мазке
- 22. Способы поступления питательных веществ в клетку 1. Пассивная диффузия 2. Облегченная диффузия 3. Активный транспорт 4.
- 24. Механизмы получения энергии: 1. Фотофосфорилирование 2. Субстратное фосфорилирование (брожение) 3. Окислительное фосфорилирование (дыхание) С6Н12О6: 2С2Н5ОН +
- 25. АНАЭРОБНЫЕ ПРОЦЕССЫ СПИРТОВОЕ БРОЖЕНИЕ: С6Н12О6 = 2СН3СН2ОН + 2СО2 С6Н12О6 = 2СН3СОСООН + 2НАД ∙ Н2
- 26. Аэробное дыхание: С6Н12О6 + 6О2 = 6СО2 + 6Н2О + Q=2,87 * 106 Дж Анаэробное дыхание:
- 27. Методы окраски микроорганизмов Клетки микроорганизмов окрашивают главным образом анилиновыми красителями. Различают кислые и основные красители. К
- 28. Простые методы окраски Простая окраска позволяет быстро изучить морфологические особенности микроорганизмов. Для простой окраски используют только
- 29. Метод окраски по Граму
- 30. Метод окраски по Граму 1. Фиксированный мазок окрашивают карболовым раствором генцианового фиолетового в течение 1-2 минут.
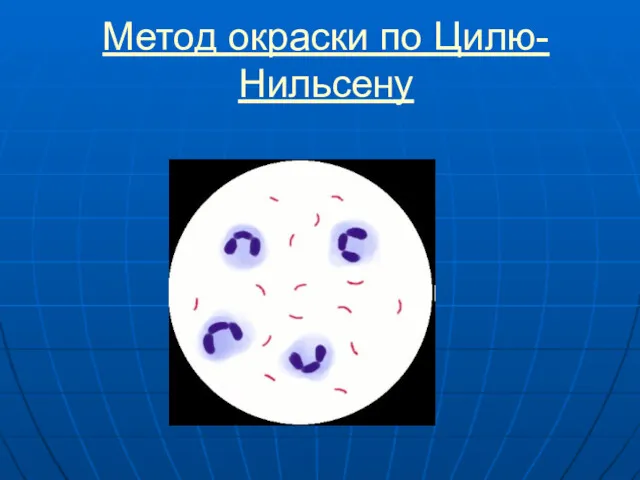
- 31. Метод окраски по Цилю-Нильсену
- 32. Метод окраски по Цилю-Нильсену Метод Циля-Нильсена предназначен для дифференциации кислотоустойчивых бактерий (возбудителей туберкулеза и лепры) от
- 33. Метод окраски по Ожешко
- 34. Метод окраски по Ожешко Метод Ожешко сходен с методом Циля-Нильсена, но отличается использованием раствора соляной кислоты
- 35. Метод окраски по Нейссеру
- 36. Метод окраски по Нейссеру Метод Нейссера используется для выявления зерен волютина. Мазок окрашивается уксуснокислым метиленовым синим
- 37. Метод окраски по Бурри
- 38. Метод окраски по Бурри Метод Бурри является негативным методом окраски: окрашивается фон, и не окрашиваются сами
- 40. Метод окраски по Бурри-Гинсу Метод Бурри-Гинса используется для окраски капсульных бактерий и основан на том, что
- 41. Метод окраски по Морозову
- 42. Метод окраски по Морозову Метод Морозова предназначен для обнаружения путём импрегнации серебром вирусов, а также выявления
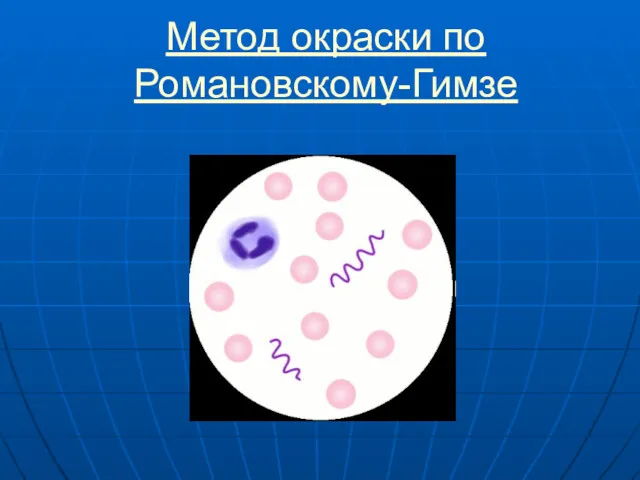
- 43. Метод окраски по Романовскому-Гимзе
- 44. Метод окраски по Романовскому-Гимзе Универсальным методом окраски микроорганизмов является окраска по Романовскому-Гимзе (смесью азура, эозина и
- 46. Скачать презентацию





































 Побег, его строение и развитие
Побег, его строение и развитие Энергетический обмен. Метаболизм (обмен веществ)
Энергетический обмен. Метаболизм (обмен веществ) Опорно - двигательный аппарат
Опорно - двигательный аппарат Многообразие червей
Многообразие червей Фотосинтез. История изучения вопросв фотосинтеза
Фотосинтез. История изучения вопросв фотосинтеза Фитонцидные свойства комнатных растений
Фитонцидные свойства комнатных растений Отряд Крокодилы (Crocodilia)
Отряд Крокодилы (Crocodilia) Неклеточные формы жизни. Вирусы и бактериофаги
Неклеточные формы жизни. Вирусы и бактериофаги Строение клетки
Строение клетки Cognitive neuroscience of movement
Cognitive neuroscience of movement Келесі өзгерістерді катализдейтін ферменттер қай класс мен подкласка жатады а) Лактат + НАД+ ↔ пируват + НАДН +Н+
Келесі өзгерістерді катализдейтін ферменттер қай класс мен подкласка жатады а) Лактат + НАД+ ↔ пируват + НАДН +Н+ Отдел голосеменные растения. Хвойные растения Приморского края
Отдел голосеменные растения. Хвойные растения Приморского края Знакомство детей с окружающим миром 4-5 лет
Знакомство детей с окружающим миром 4-5 лет Экологические факторы и их влияние на растения
Экологические факторы и их влияние на растения Селекция: методы и достижения
Селекция: методы и достижения Микропрепараты. Общая гистология
Микропрепараты. Общая гистология Строение коры больших полушарий
Строение коры больших полушарий Биологиялық үрдістер термодинамикасы
Биологиялық үрдістер термодинамикасы Разработка внекласного мероприятия по биологии Город здоровья
Разработка внекласного мероприятия по биологии Город здоровья The Digestive System in Humans
The Digestive System in Humans Методы биологического исследования
Методы биологического исследования Рысь
Рысь Тесты ГИА. Биологическое и социальное в человеке, личность, деятельность человека и его основные формы, межличностные отношения
Тесты ГИА. Биологическое и социальное в человеке, личность, деятельность человека и его основные формы, межличностные отношения Радиационная безопасность населения
Радиационная безопасность населения Пищеварение в кишечнике.Всасывание питательных веществ.
Пищеварение в кишечнике.Всасывание питательных веществ. Красная книга
Красная книга Класс Птицы
Класс Птицы Животные Севера
Животные Севера