Содержание
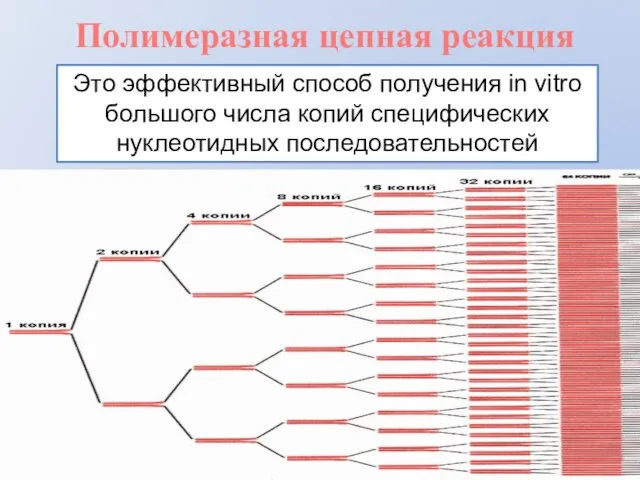
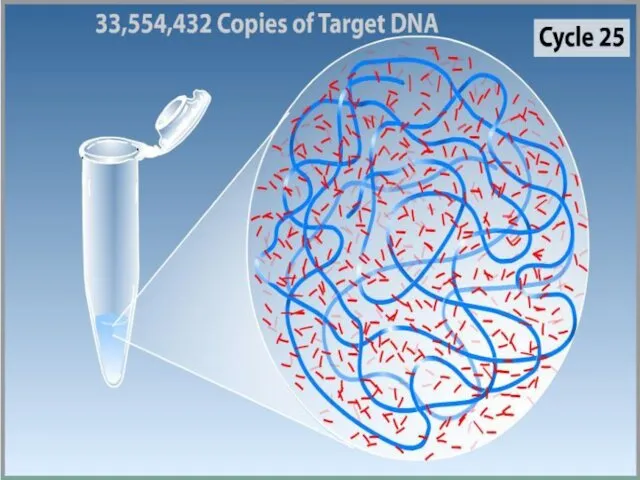
- 2. Полимеразная цепная реакция Это эффективный способ получения in vitro большого числа копий специфических нуклеотидных последовательностей
- 3. Полимеразная цепная реакция Метод ферментативной наработки in vitro определённых, сравнительно коротких (до нескольких тысяч пар нуклеотидов),
- 4. Изобретение ПЦР В 1983 г. химик компании Cetus, Кэри Маллис, оптимизируя метод олигомерной рестрикции для идентификации
- 5. ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно с точностью не
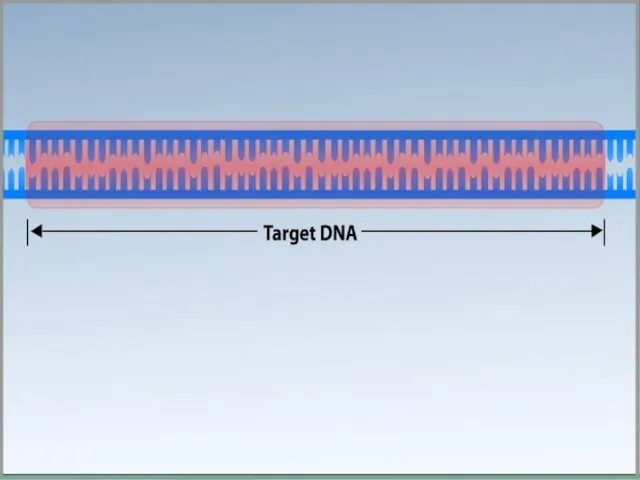
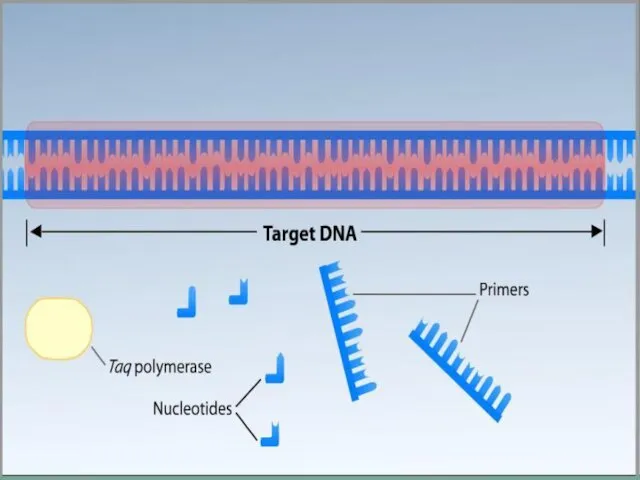
- 6. Для ПЦР необходимы: ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать. Два праймера, комплементарные противоположным концам
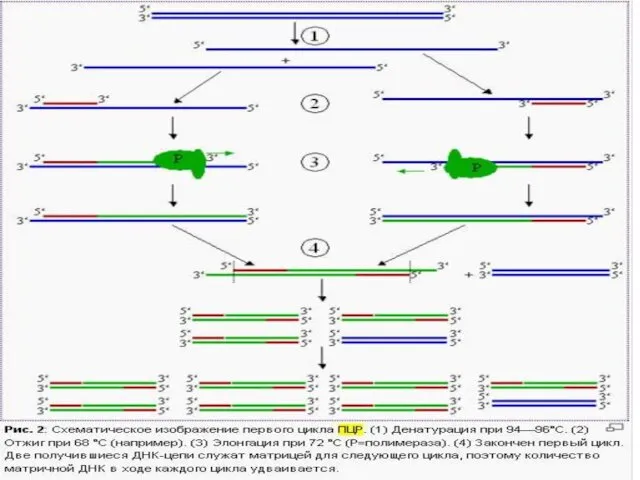
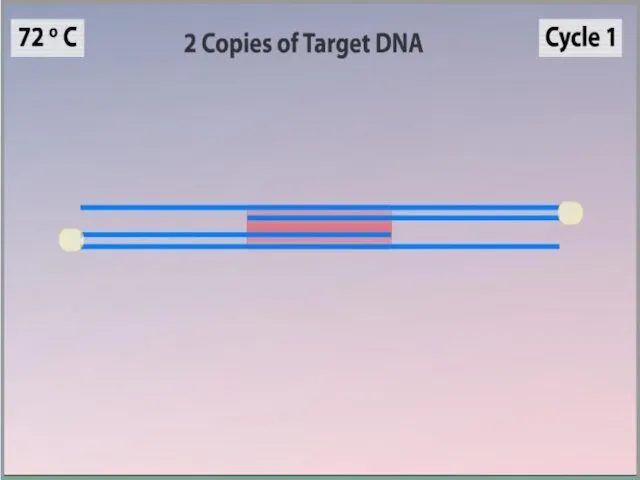
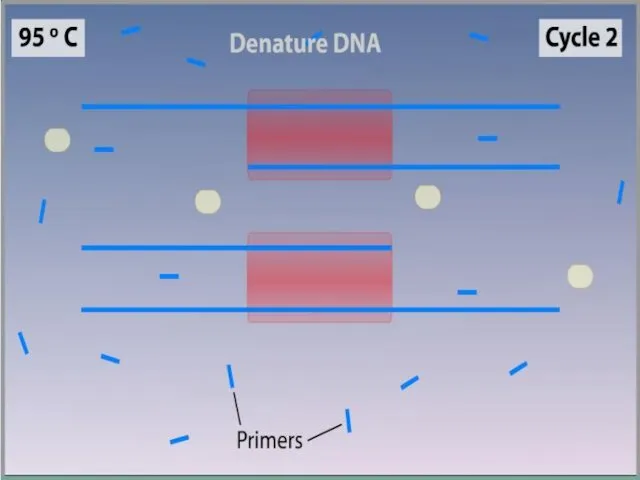
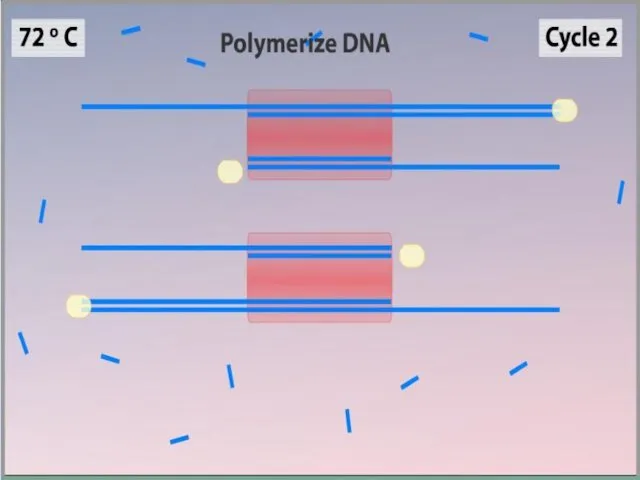
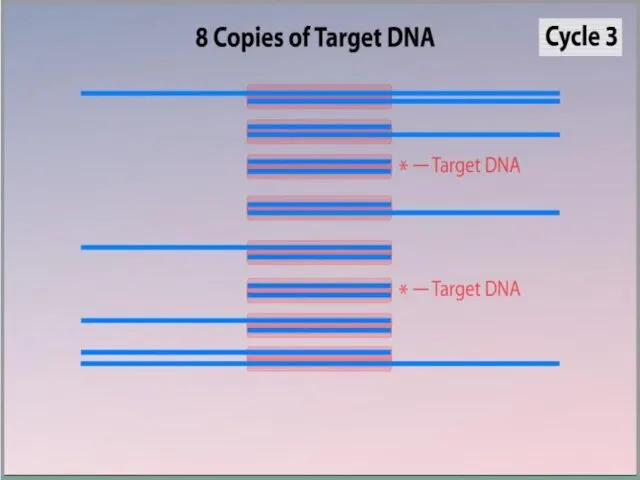
- 7. ПЦР осуществляется в ходе трехэтапного циклического процесса: Денатурация Ренатурация Синтез
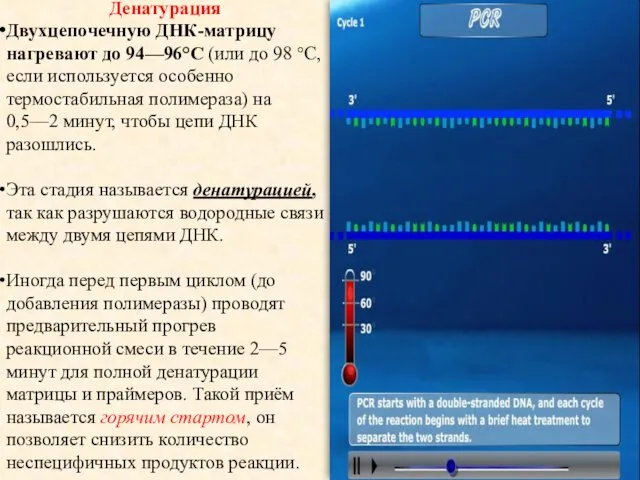
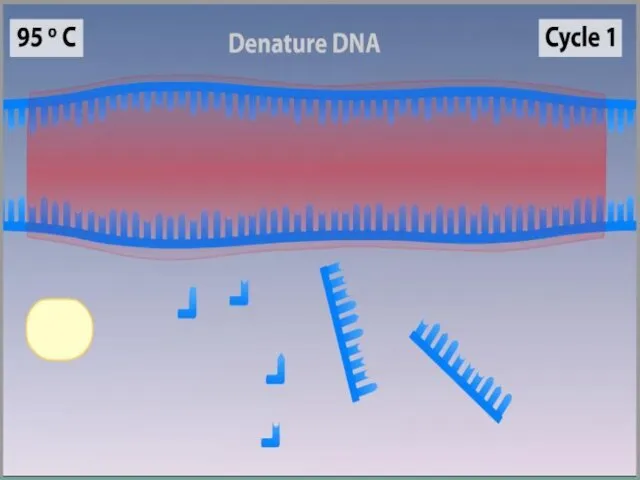
- 9. Денатурация Двухцепочечную ДНК-матрицу нагревают до 94—96°C (или до 98 °C, если используется особенно термостабильная полимераза) на
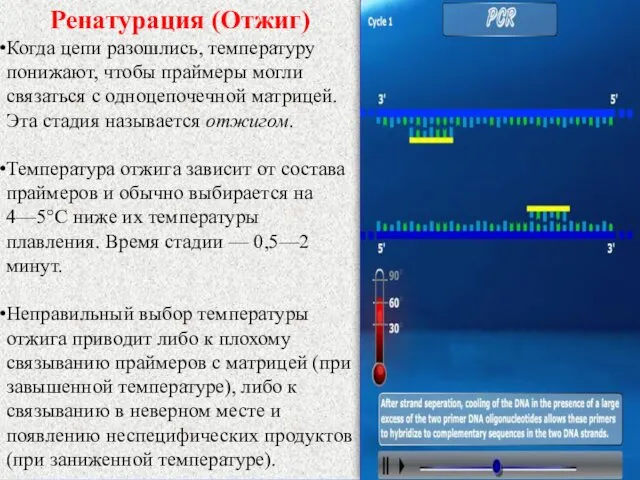
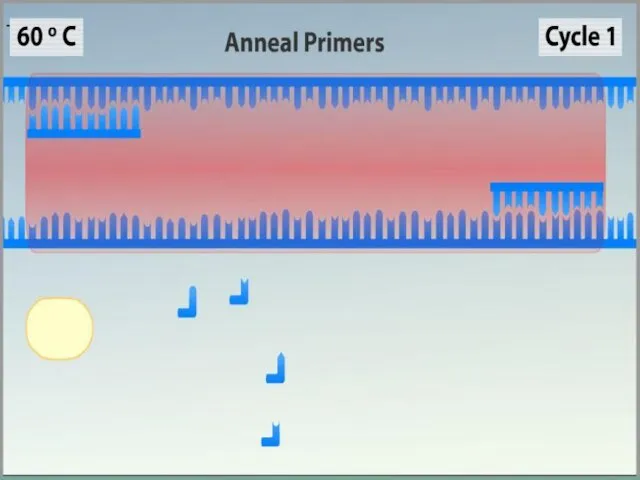
- 10. Ренатурация (Отжиг) Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Эта стадия
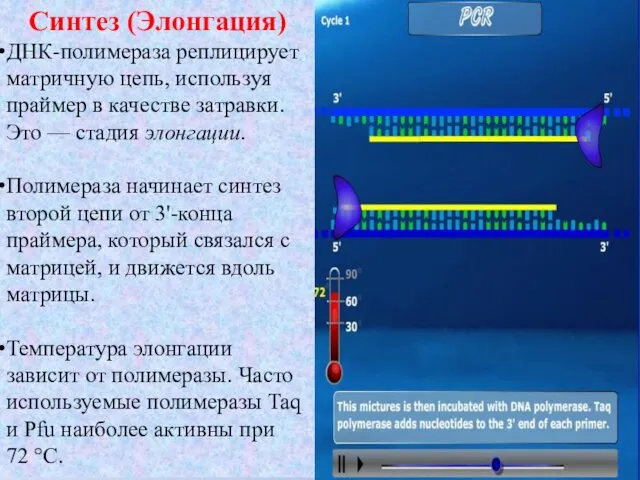
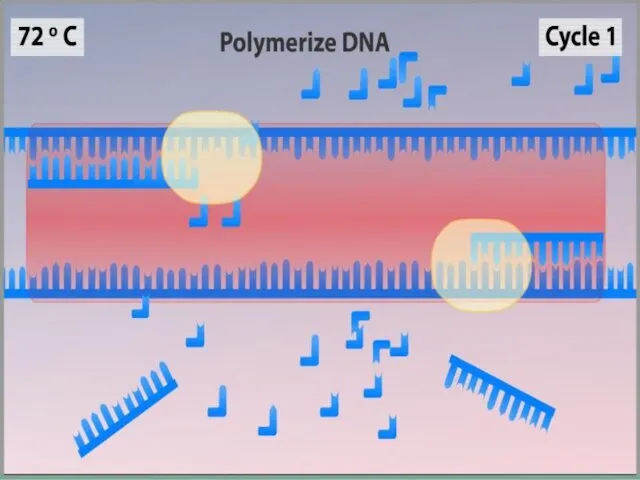
- 11. Синтез (Элонгация) ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки. Это — стадия элонгации. Полимераза
- 12. Состав реакционной смеси Исследуемая ДНК ДНК-зависимая-ДНК-полимераза Дезоксирибонуклеотидтрифосфаты (dNTP) ДНК-затравки (праймеры) Интеркалирующих краситель (обычно SYBR Green) или
- 13. Полимеразная цепная реакция с возможностью детекции продукта в реальном времени (RT-PCR). Секвенирование по Сенгеру
- 26. Технология «ПЦР-чип» Анализ экспрессии 84 генов за один раз
- 28. Постгеномная Эра 26 июня 2000 года было объявлено о расшифровке генома человека. На данный момент известны
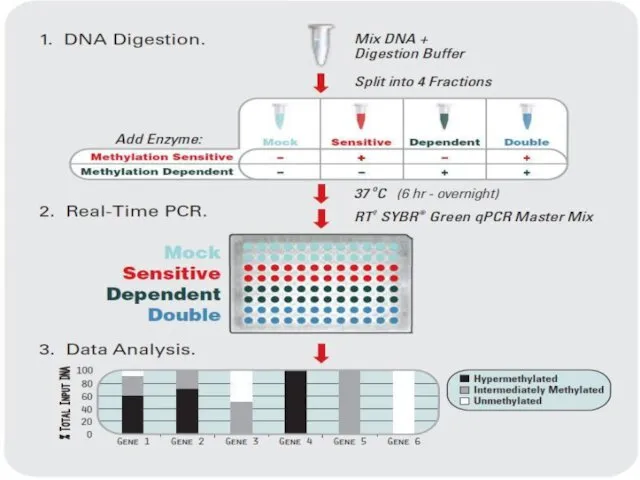
- 29. Контроль качества ПЦР Проверка соответствия праймеров рекомендуемым параметрам, при их дизайне; Подбор стабильного референсного гена; Контроль
- 30. Рекомендуемые параметры праймеров: Длина 18-22 осн. Температура плавления 52-60˚С Содержание GC: 40-60% Вторичные структуры: Шпильки: ΔG>-2
- 31. Рекомендуемые параметры праймеров: Повторы: не более 4 динуклеотидных повтора Не более 4 одинаковых нуклеотидов подряд Повторы:
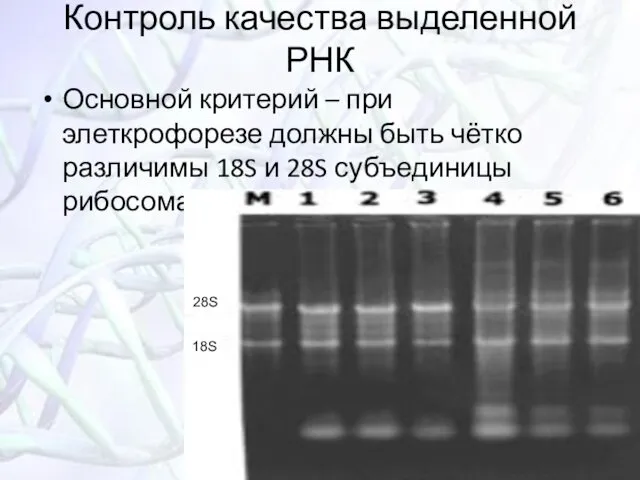
- 32. Контроль качества выделенной РНК Основной критерий – при элеткрофорезе должны быть чётко различимы 18S и 28S
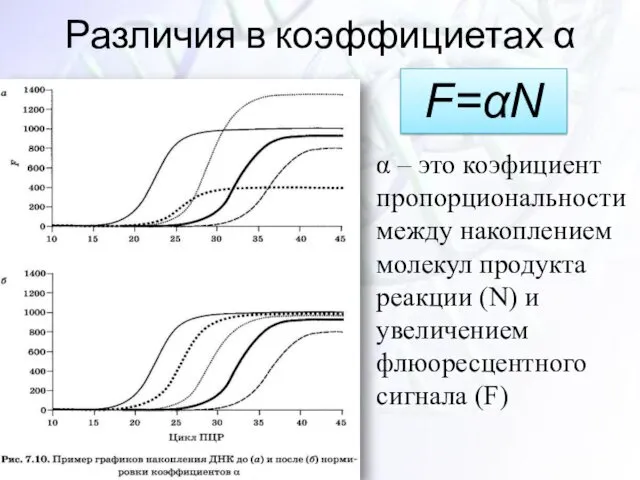
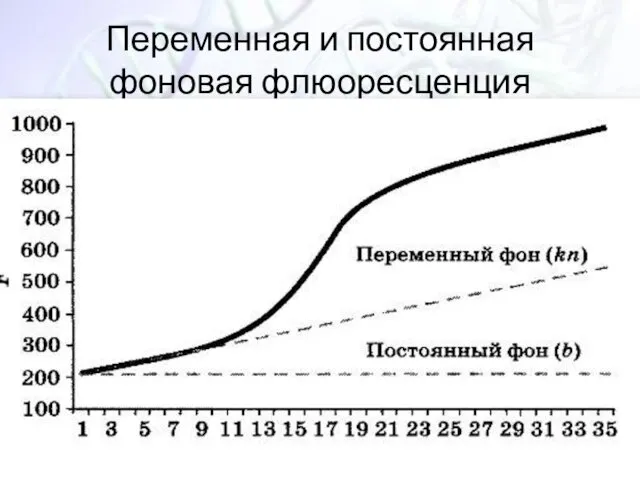
- 33. Различия в коэффициетах α α – это коэфициент пропорциональности между накоплением молекул продукта реакции (N) и
- 34. Переменная и постоянная фоновая флюоресценция
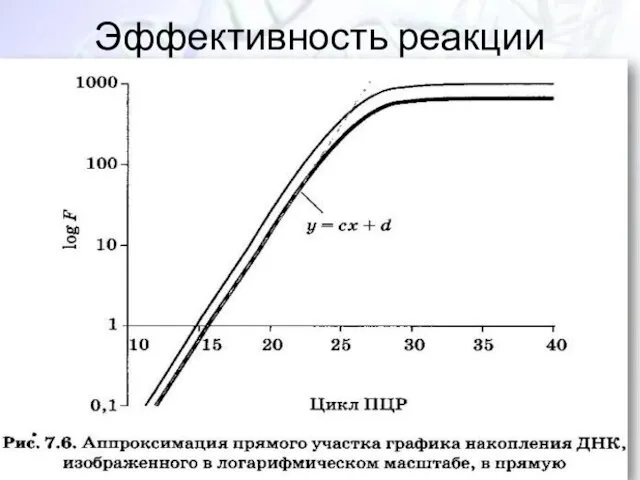
- 35. Эффективность реакции
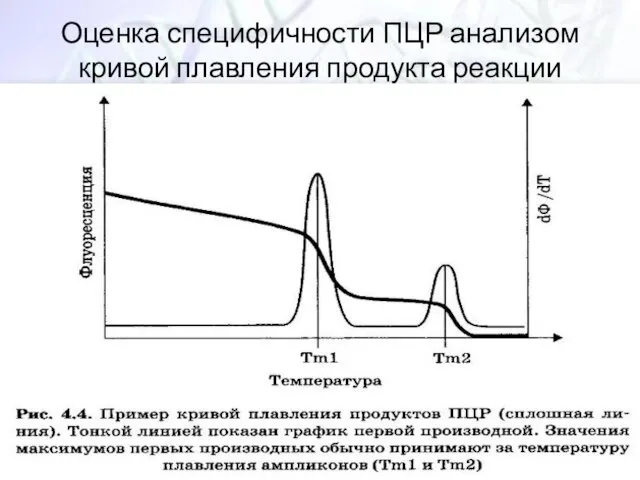
- 36. Оценка специфичности ПЦР анализом кривой плавления продукта реакции
- 37. ПЦР «в реальном времени» Циклы Флуоресценция Пороговый цикл (Сt)
- 38. Анализ содержания ГМО в продуктах питания; Установление отцовства; Криминалистика: «Генетические отпечатки пальцев»; В медицине: Диагностика наследственных
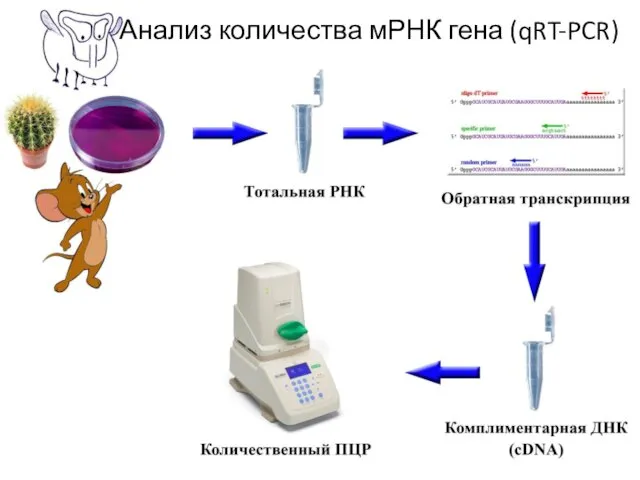
- 39. Анализ количества мРНК гена (qRT-PCR)
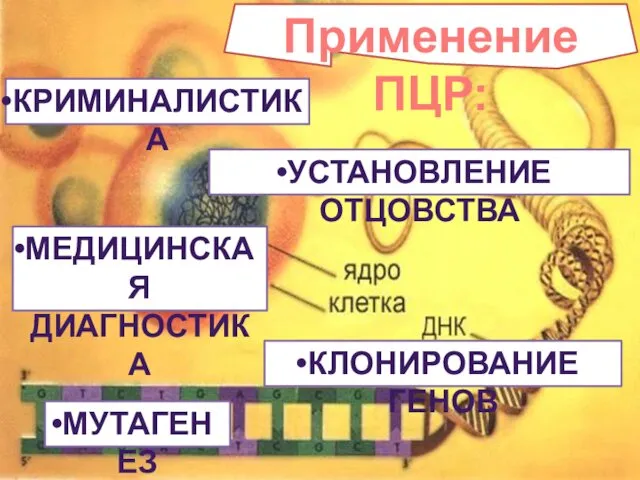
- 40. Применение ПЦР: КРИМИНАЛИСТИКА УСТАНОВЛЕНИЕ ОТЦОВСТВА МЕДИЦИНСКАЯ ДИАГНОСТИКА КЛОНИРОВАНИЕ ГЕНОВ МУТАГЕНЕЗ
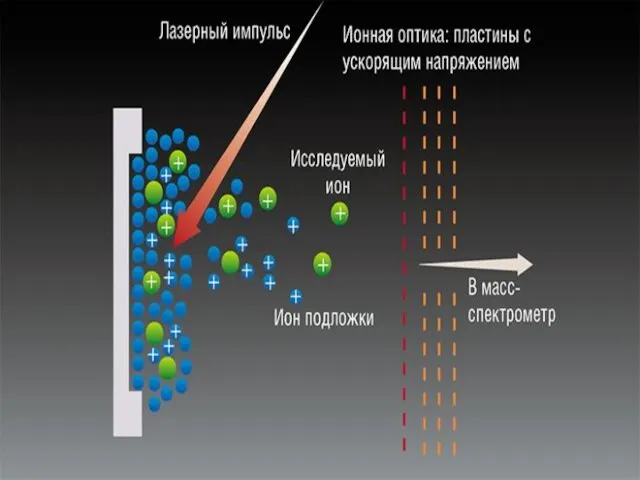
- 41. MALDI
- 42. Матрично-активированная лазерная десорбция/ионизация МАЛДИ — (от англ. MALDI, Matrix Assisted Laser Desorption/Ionization) — десорбционный метод «мягкой»
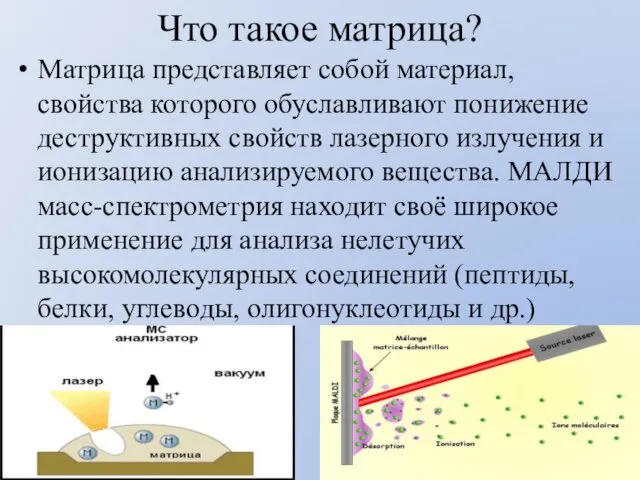
- 43. Что такое матрица? Матрица представляет собой материал, свойства которого обуславливают понижение деструктивных свойств лазерного излучения и
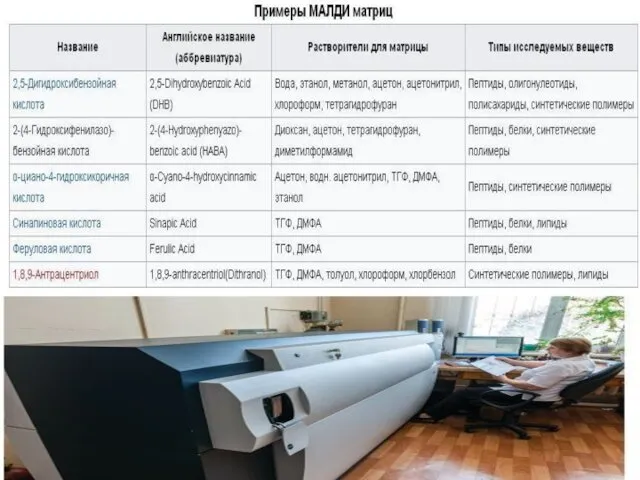
- 44. Считается, что вещество, используемое в качестве матрицы, должно отвечать следующим основным требованиям: 1) обладать высоким коэффициентом
- 46. Немного истории Впервые возможность применения матрицы для подавления фрагментации при анализе нелетучих органических соединений на примере
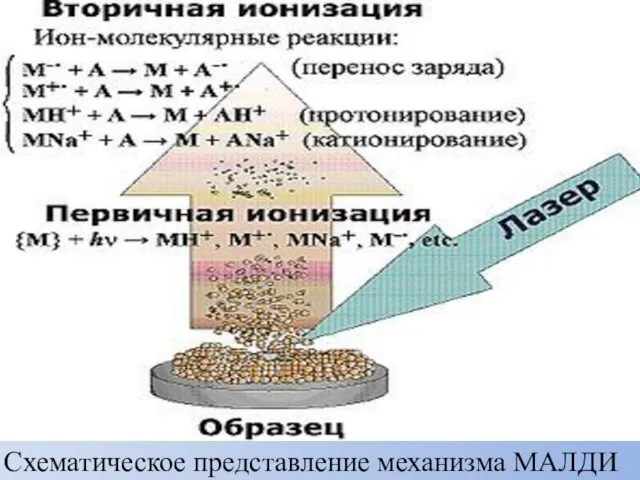
- 47. Схематическое представление механизма МАЛДИ
- 49. Применение MALDI Диапазон применения МАЛДИ достаточно широк и охватывает многие классы химических соединений: Биоорганические соединения (пептиды,
- 51. МАЛДИ масс-спектрометрия в медицине С конца 2000-х технология MALDI-TOF начала применяться в практической медицине для быстрой
- 52. Применение метода позволило значительно сократить затраты и время бактериологического анализа и увеличить его точность. Система получила
- 54. Скачать презентацию






















 Залози тіла людини
Залози тіла людини Предмет, задачи и история развития радиобиологии, ее роль в решении задач агропромышленного комплекса
Предмет, задачи и история развития радиобиологии, ее роль в решении задач агропромышленного комплекса Основные направления эволюционного процесса
Основные направления эволюционного процесса Мир динозавров
Мир динозавров Город будущего
Город будущего Высшая нервная деятельность человека. 8 класс
Высшая нервная деятельность человека. 8 класс Фізіологія травної системи. Травлення
Фізіологія травної системи. Травлення Клуб знатоков природы
Клуб знатоков природы Өтілген дәріс пен практикалық сабақтарды қамтитын материалдар
Өтілген дәріс пен практикалық сабақтарды қамтитын материалдар Animal reproduction
Animal reproduction Будова рослинної і тваринної клітини
Будова рослинної і тваринної клітини Методы диагностики, морфология, микроскопия, методы окраски бактерий
Методы диагностики, морфология, микроскопия, методы окраски бактерий Семейства: Ластовневые, Маслиновые, Вьюнковые, Подорожниковые, Колокольчиковые
Семейства: Ластовневые, Маслиновые, Вьюнковые, Подорожниковые, Колокольчиковые Дыхание. Типы дыхания
Дыхание. Типы дыхания Оплодотворение цветковых растений
Оплодотворение цветковых растений Закономерности преобразования функций органов в филогенезе. Примеры изменений функций органов у человека
Закономерности преобразования функций органов в филогенезе. Примеры изменений функций органов у человека Опорно-двигательная система человека. Скелет конечностей
Опорно-двигательная система человека. Скелет конечностей Повторительно-обобщающий урок (игра) по теме Строение живых организмов
Повторительно-обобщающий урок (игра) по теме Строение живых организмов день подснежника
день подснежника Весна в мире птиц и зверей. 2 класс
Весна в мире птиц и зверей. 2 класс Презентация Жилища животных
Презентация Жилища животных Фізика в житті тварин
Фізика в житті тварин Генетика пола. Наследование признаков, сцепленных с полом
Генетика пола. Наследование признаков, сцепленных с полом Загальна будова та функції нервової системи
Загальна будова та функції нервової системи Кишечнополостные. Характеристика типа Гребневики, особенности строения, закладка мезодермы
Кишечнополостные. Характеристика типа Гребневики, особенности строения, закладка мезодермы Игра Кто хочет стать биологическим миллионером?
Игра Кто хочет стать биологическим миллионером? Биосфера антропогендік факторлар
Биосфера антропогендік факторлар Опасная флора и фауна
Опасная флора и фауна