Содержание
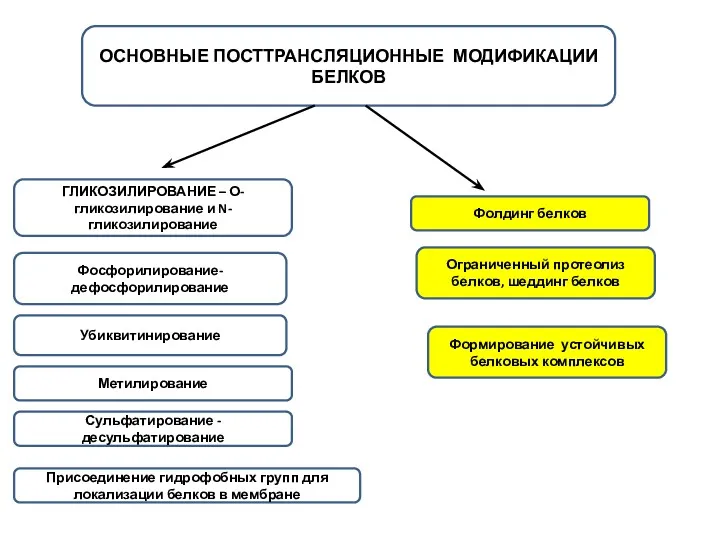
- 2. ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ ГЛИКОЗИЛИРОВАНИЕ – О-гликозилирование и N-гликозилирование Фосфорилирование-дефосфорилирование Убиквитинирование Метилирование Сульфатирование -десульфатирование Присоединение гидрофобных
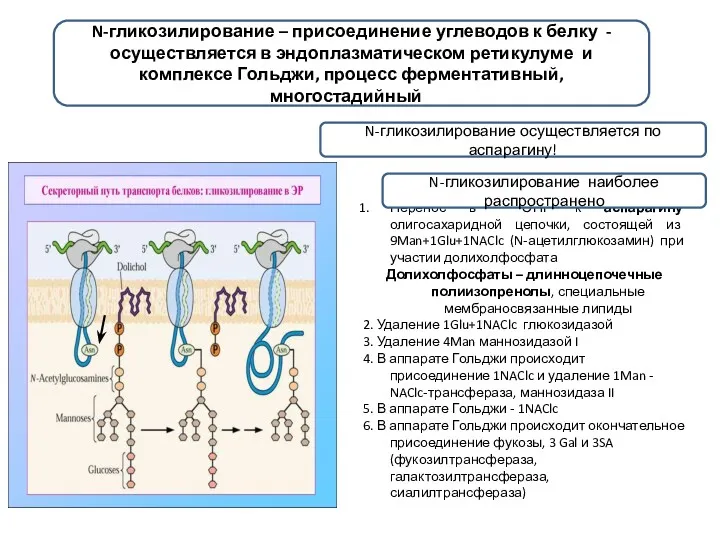
- 3. N-гликозилирование – присоединение углеводов к белку - осуществляется в эндоплазматическом ретикулуме и комплексе Гольджи, процесс ферментативный,
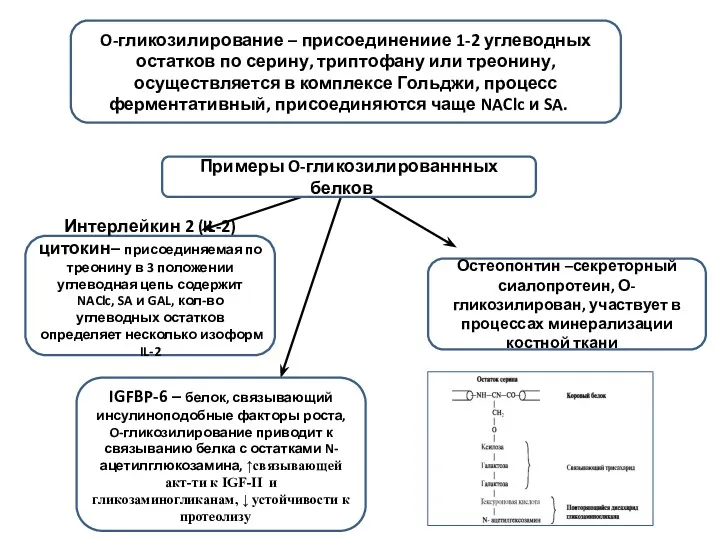
- 4. O-гликозилирование – присоединениие 1-2 углеводных остатков по серину, триптофану или треонину, осуществляется в комплексе Гольджи, процесс
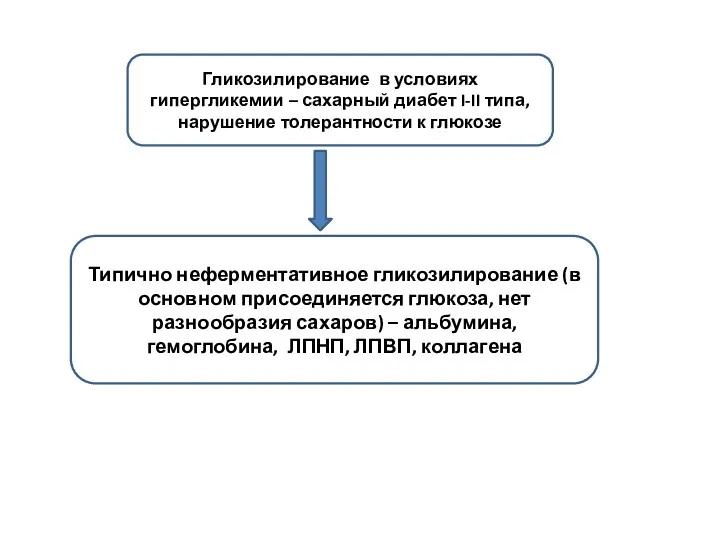
- 5. Гликозилирование в условиях гипергликемии – сахарный диабет I-II типа, нарушение толерантности к глюкозе Типично неферментативное гликозилирование
- 6. Гликированный HbA - контроль эффективности лечения СД и весоредуцирующих технологий – в норме менее 7%. в
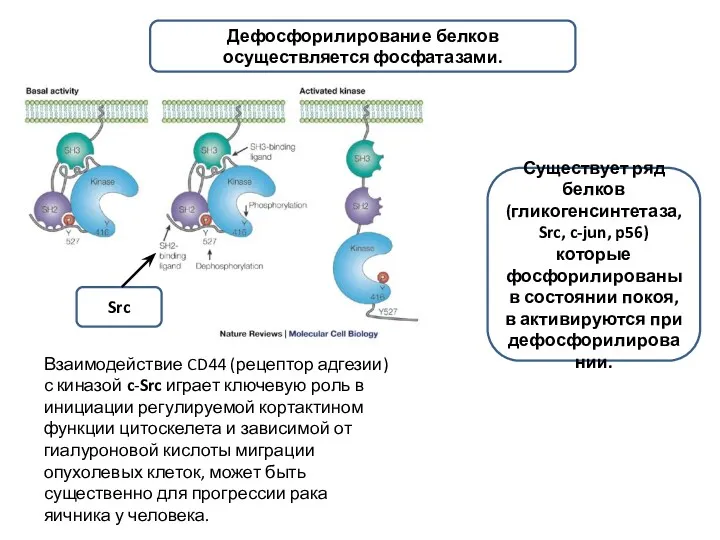
- 7. Фосфорилирование – дефосфорилирование белков Фосфорилирование существенно меняет химические свойства белков. В результате белок становится способным распознавать,
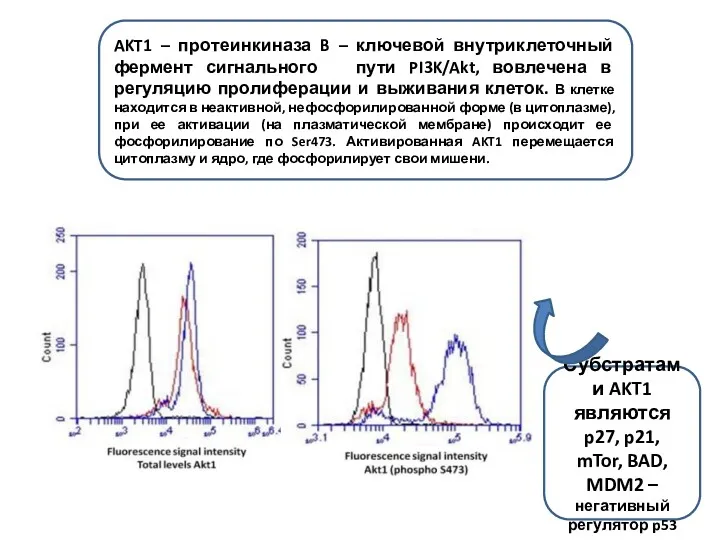
- 8. AKT1 – протеинкиназа B – ключевой внутриклеточный фермент сигнального пути PI3K/Akt, вовлечена в регуляцию пролиферации и
- 9. Взаимодействие CD44 (рецептор адгезии) с киназой c-Src играет ключевую роль в инициации регулируемой кортактином функции цитоскелета
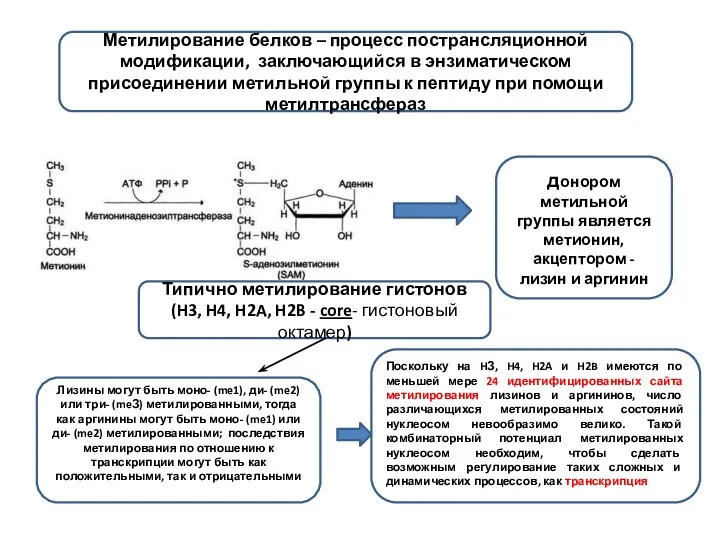
- 10. Метилирование белков – процесс пострансляционной модификации, заключающийся в энзиматическом присоединении метильной группы к пептиду при помощи
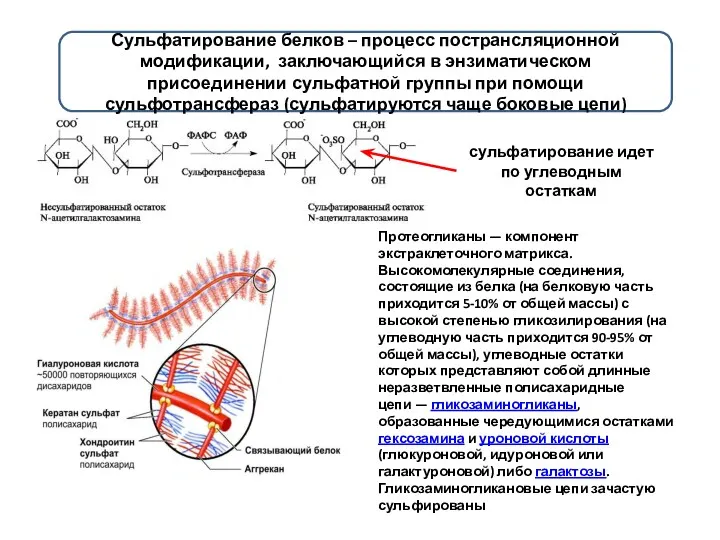
- 11. Сульфатирование белков – процесс пострансляционной модификации, заключающийся в энзиматическом присоединении сульфатной группы при помощи сульфотрансфераз (сульфатируются
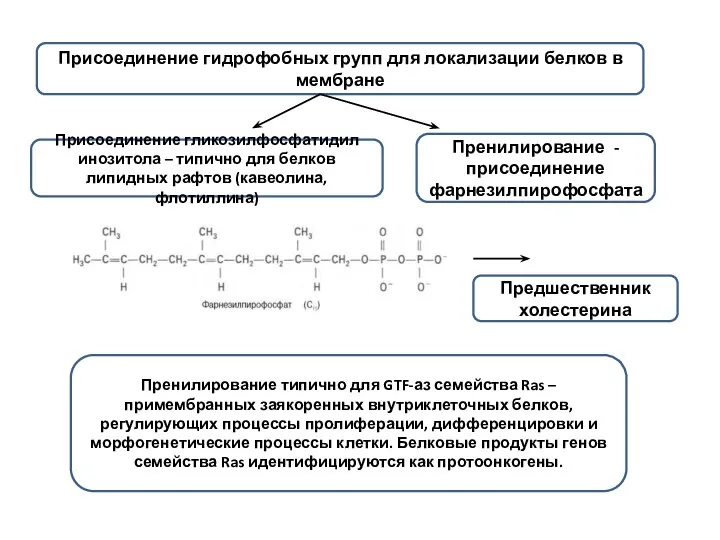
- 12. Присоединение гидрофобных групп для локализации белков в мембране Присоединение гликозилфосфатидил инозитола – типично для белков липидных
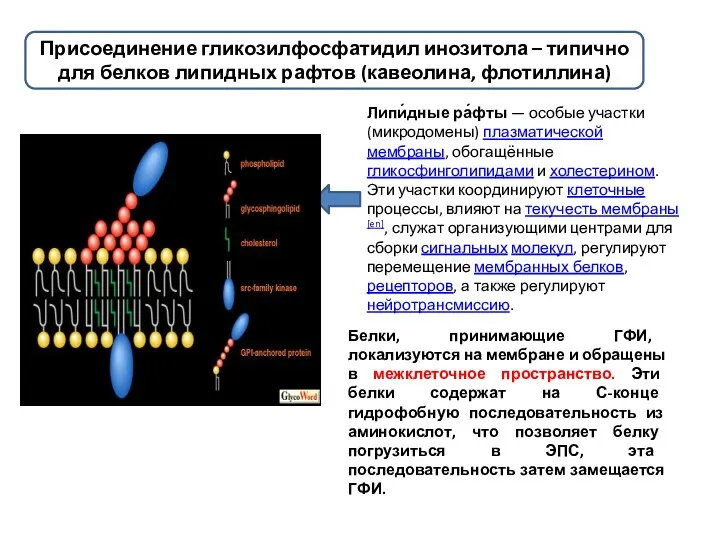
- 13. Присоединение гликозилфосфатидил инозитола – типично для белков липидных рафтов (кавеолина, флотиллина) Белки, принимающие ГФИ, локализуются на
- 14. ЛИПИДНЫЕ РАФТЫ – ЛОКУСЫ стабильного функционирования РЕЦЕПТОР-ЛИГАНДНЫХ КОМПЛЕКСОВ. ЛИПИДНЫМИ РАФТАМИ БОГАТЫ ЭКЗОСОМЫ
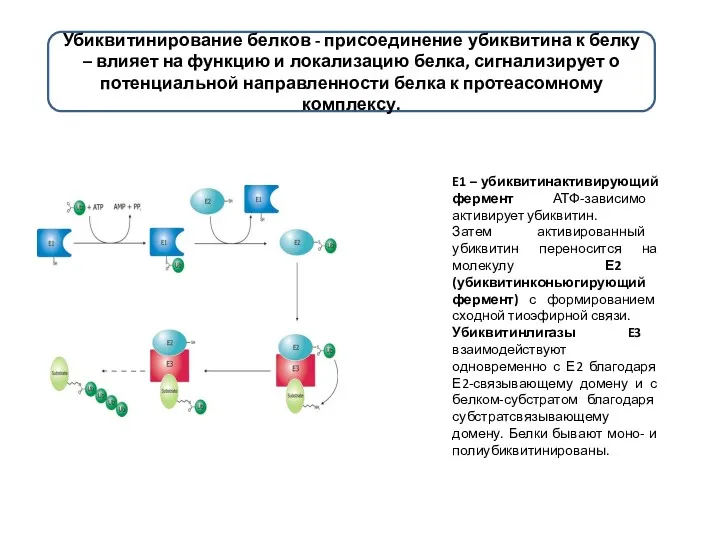
- 15. Убиквитинирование белков - присоединение убиквитина к белку – влияет на функцию и локализацию белка, сигнализирует о
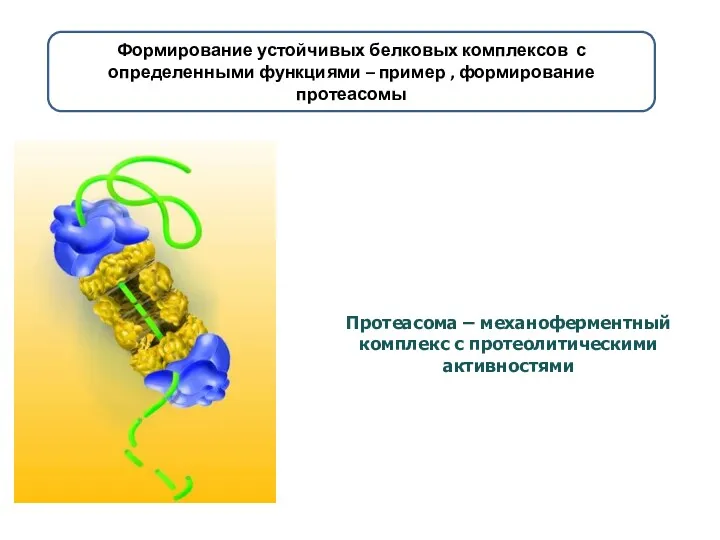
- 16. Протеасома – механоферментный комплекс с протеолитическими активностями Формирование устойчивых белковых комплексов с определенными функциями – пример
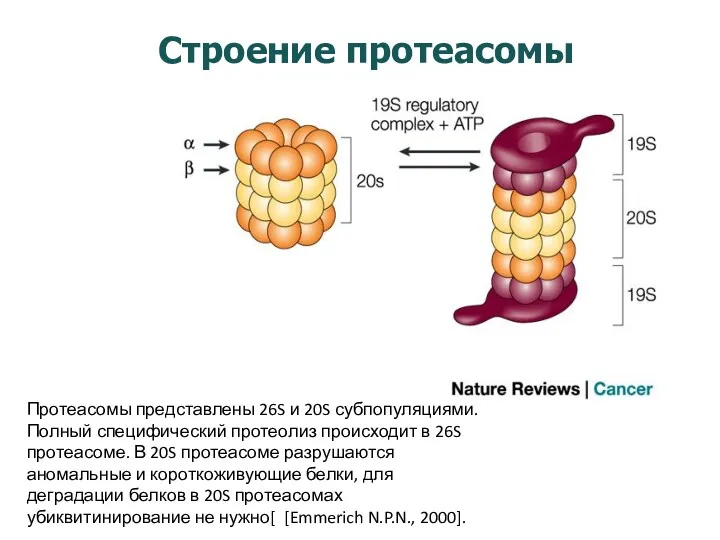
- 17. Строение протеасомы Протеасомы представлены 26S и 20S субпопуляциями. Полный специфический протеолиз происходит в 26S протеасоме. В
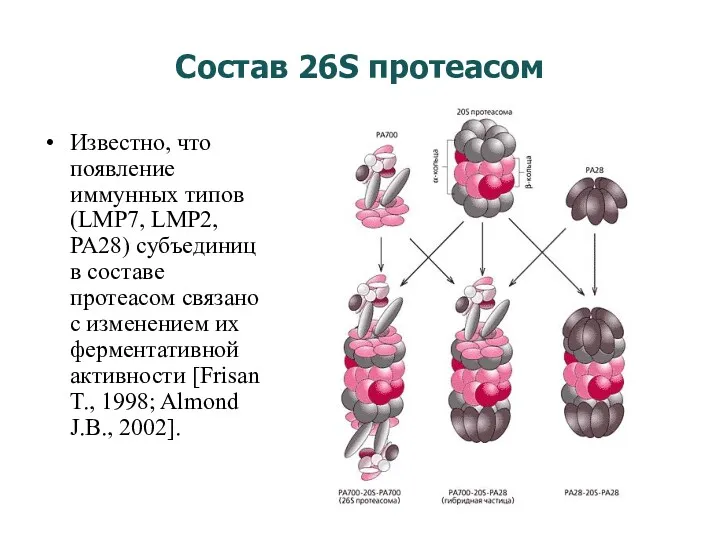
- 18. Состав 26S протеасом Известно, что появление иммунных типов (LMP7, LMP2, PA28) субъединиц в составе протеасом связано
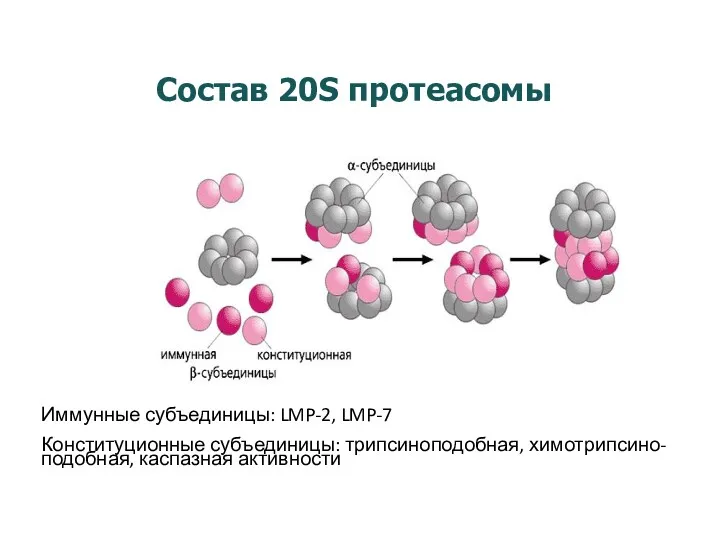
- 19. Состав 20S протеасомы Иммунные субъединицы: LMP-2, LMP-7 Конституционные субъединицы: трипсиноподобная, химотрипсино- подобная, каспазная активности
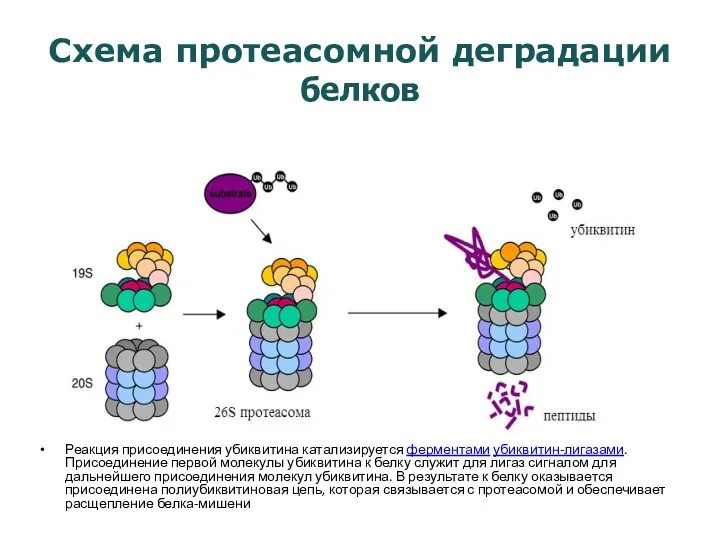
- 20. Схема протеасомной деградации белков Реакция присоединения убиквитина катализируется ферментами убиквитин-лигазами. Присоединение первой молекулы убиквитина к белку
- 21. Функции протеасом 1. Протеолиз цитозольных, ядерных белков: ненормальные белки, короткоживущие белки, поврежденные белки, долгоживущие белки 2.
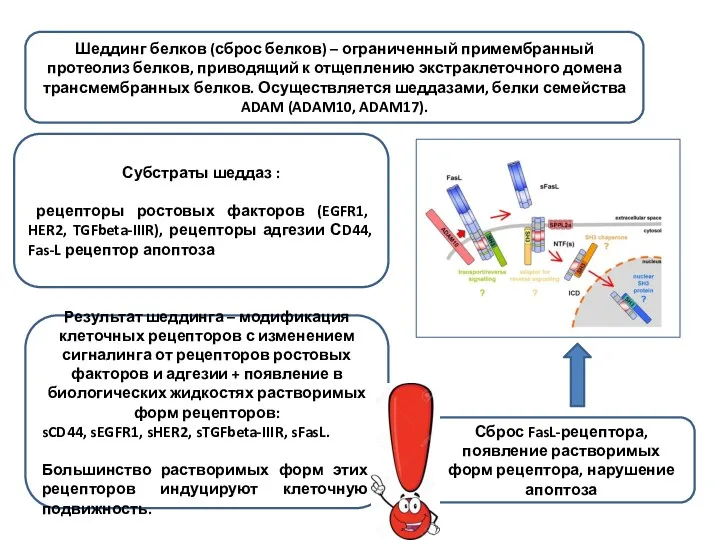
- 22. Сброс FasL-рецептора, появление растворимых форм рецептора, нарушение апоптоза Шеддинг белков (сброс белков) – ограниченный примембранный протеолиз
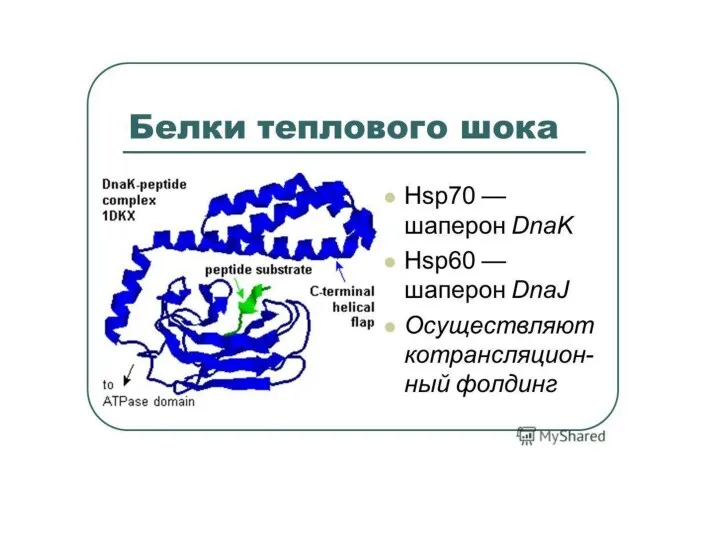
- 23. Фолдинг белков – процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру Каждая молекула белка
- 26. Скачать презентацию





 Растениеводство. Системы земледелия
Растениеводство. Системы земледелия Эндокринная система
Эндокринная система Положение человека в системе животного мира. Стадии антропогенеза
Положение человека в системе животного мира. Стадии антропогенеза Отряд Журавлеобразные
Отряд Журавлеобразные Выделение ДНК
Выделение ДНК Ядовитые растения Крыма
Ядовитые растения Крыма Физиология высшей нервной деятельности. Этология и стадность
Физиология высшей нервной деятельности. Этология и стадность Слуховой анализатор. Гигиена слуха. 8 класс
Слуховой анализатор. Гигиена слуха. 8 класс Типи взаємовідносин між організмами
Типи взаємовідносин між організмами Конечные продукты азотистого обмена. Биосинтез мочевины
Конечные продукты азотистого обмена. Биосинтез мочевины Статеві гормони. Гормони наднирників. Гормони щитовидної залози, гормони нейрогипофиза
Статеві гормони. Гормони наднирників. Гормони щитовидної залози, гормони нейрогипофиза 20181126_razvitie_nasekomyh
20181126_razvitie_nasekomyh Последствия близкородственных браков
Последствия близкородственных браков Келесі өзгерістерді катализдейтін ферменттер қай класс мен подкласка жатады а) Лактат + НАД+ ↔ пируват + НАДН +Н+
Келесі өзгерістерді катализдейтін ферменттер қай класс мен подкласка жатады а) Лактат + НАД+ ↔ пируват + НАДН +Н+ Общее учение о внутренностях
Общее учение о внутренностях Биохимия соединительной ткани
Биохимия соединительной ткани Железы. Гистофизиология секреторного процесса. Типы секреции
Железы. Гистофизиология секреторного процесса. Типы секреции Кровеносная система
Кровеносная система Тип Плоские черви (Plathelminthes)
Тип Плоские черви (Plathelminthes) Витамины. 9 класс
Витамины. 9 класс Карты генов наследственных заболеваний
Карты генов наследственных заболеваний Нуклеиновые кислоты
Нуклеиновые кислоты Показатели загрязненности почв и экологического неблагополучия агроэкосистемы
Показатели загрязненности почв и экологического неблагополучия агроэкосистемы Эволюционное учение (урок обобщающего повторения для 10 класса)
Эволюционное учение (урок обобщающего повторения для 10 класса) Самые необычные кошки планеты
Самые необычные кошки планеты Мышцы. Типы мышц, их строение и значение
Мышцы. Типы мышц, их строение и значение Зоопарк
Зоопарк Органи і системи органів тварин
Органи і системи органів тварин