Слайд 16

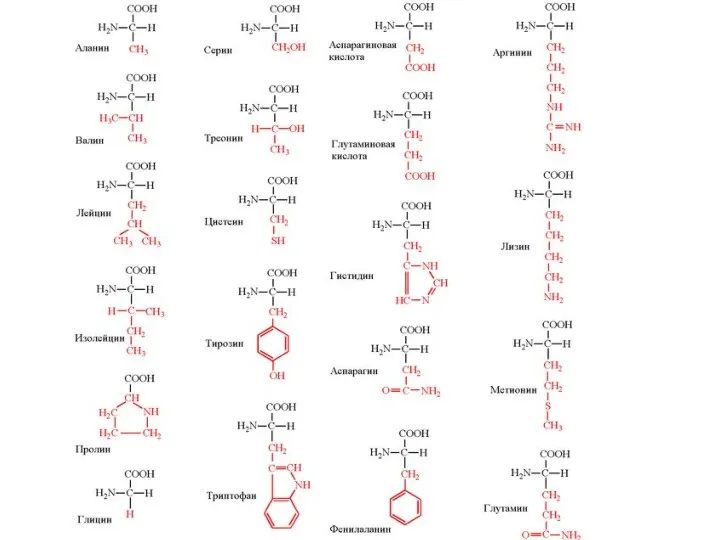
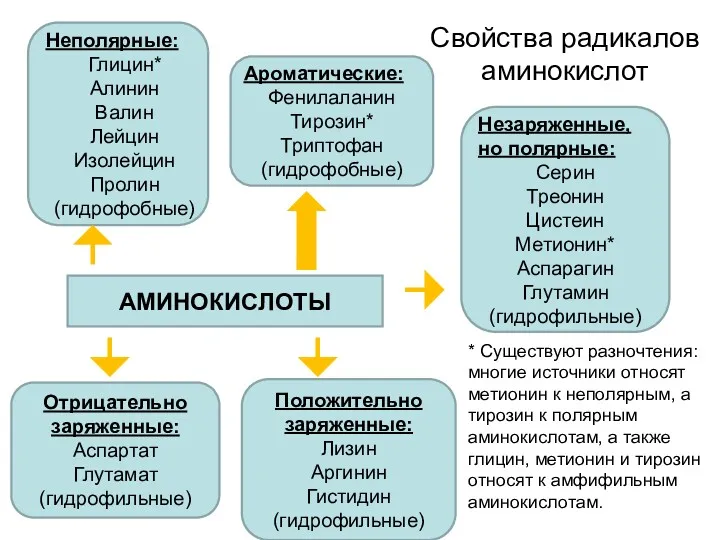
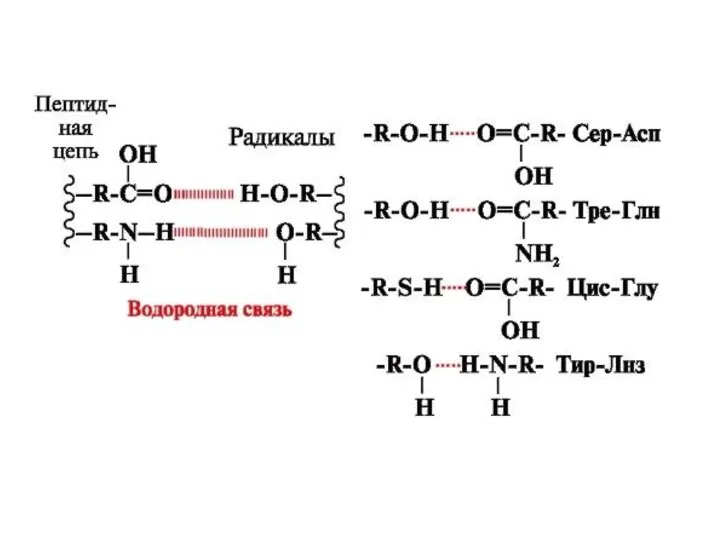
По строению бокового радикала выделяют:
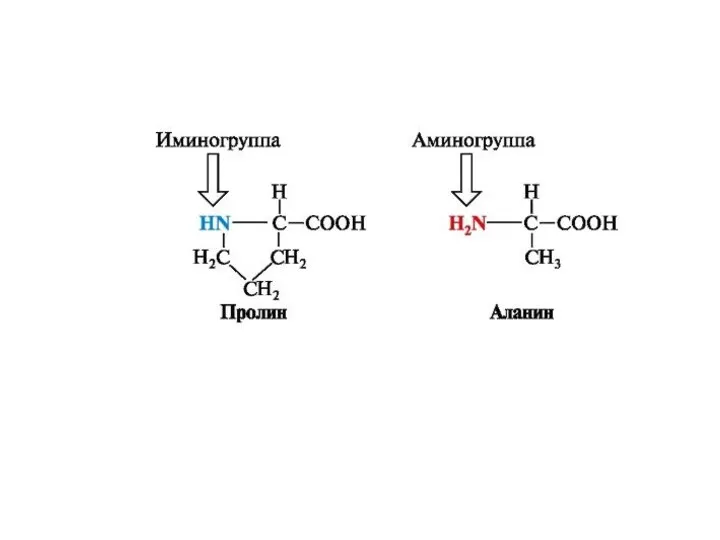
алифатические (аланин, валин, лейцин, изолейцин, пролин,
глицин),
ароматические (фенилаланин, тирозин, триптофан),
серусодержащие (цистеин, метионин),
содержащие ОН-группу (серин, треонин, опять тирозин),
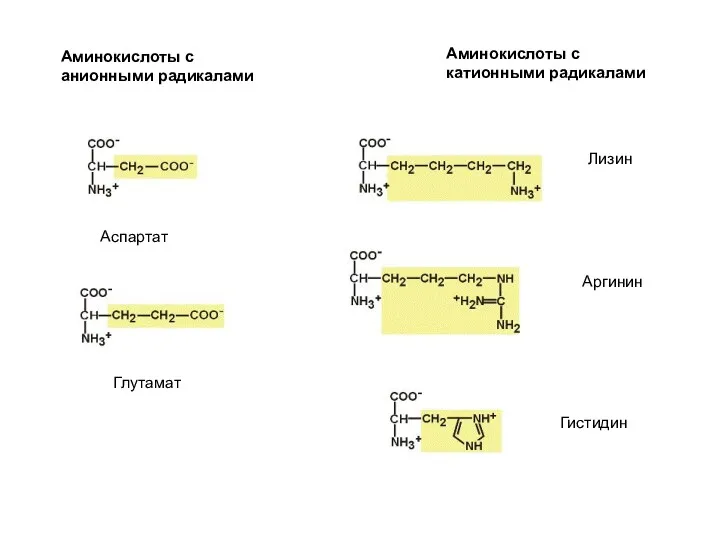
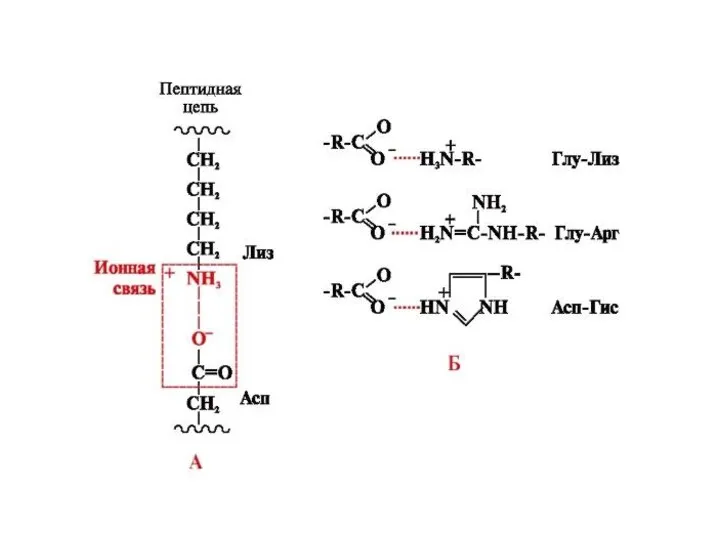
содержащие дополнительную СООН-группу (аспарагиновая и глутаминовая кислоты),
дополнительную NH2-группу (лизин, аргинин, гистидин, глутамин, аспарагин).
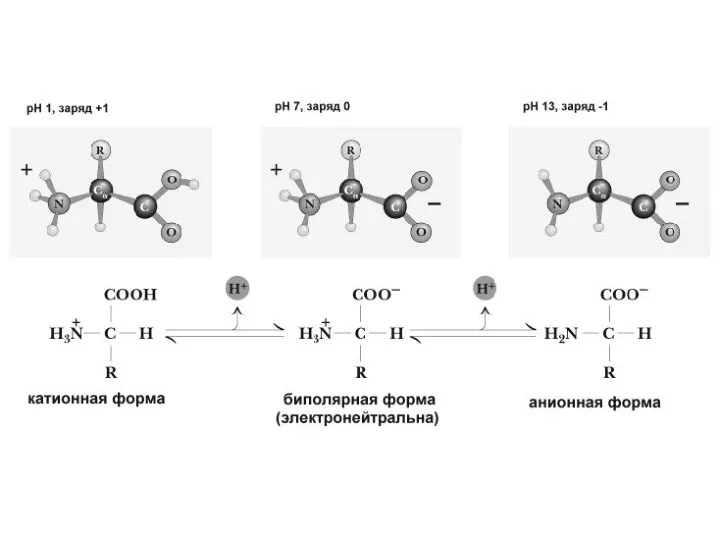
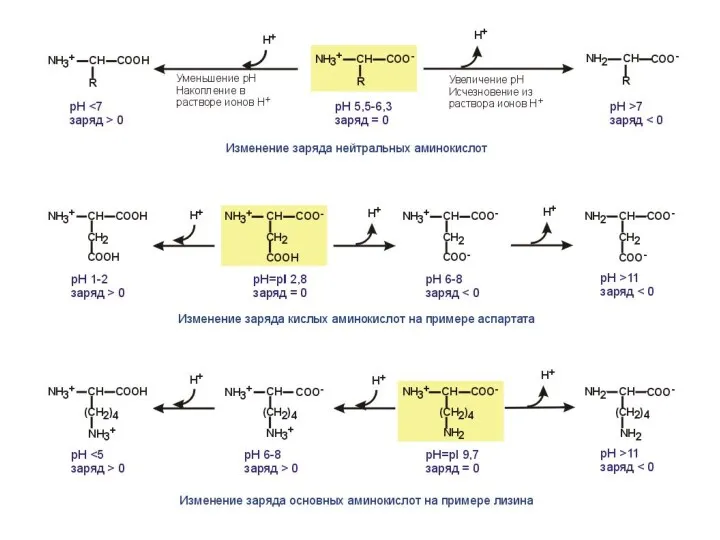
По полярности бокового радикала существуют неполярные аминокислоты (ароматические, алифатические) и полярные(незаряженные, отрицательно и положительно заряженные).
По кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (аспарагиновая и глутаминовая кислоты) и основные (лизин, аргинин, гистидин) аминокислоты.
По необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей – незаменимые аминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин, аргинин, гистидин). К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием соответствующей аминокислоты.









 Рекомбинантные антитела для диагностики и терапии
Рекомбинантные антитела для диагностики и терапии Структурно-функциональная организация клетки
Структурно-функциональная организация клетки Причины разнообразия жизни на Земле
Причины разнообразия жизни на Земле Митохондрия
Митохондрия Утворення перлин
Утворення перлин Организация микробиологической лабораторной службы
Организация микробиологической лабораторной службы Вегетативные органы растений: корень
Вегетативные органы растений: корень Формы естественного отбора
Формы естественного отбора Биологическая викторина Птицы Калужской области
Биологическая викторина Птицы Калужской области Пищеварительная система (наддиафрагмальный отдел пищеварительной трубки)
Пищеварительная система (наддиафрагмальный отдел пищеварительной трубки) 5 популярных характеристик при сравнении организмов
5 популярных характеристик при сравнении организмов Муравьи
Муравьи Своя игра. Мир растений
Своя игра. Мир растений Водная среда обитания организмов
Водная среда обитания организмов Шляпочные грибы
Шляпочные грибы Общая характеристика типа Моллюски
Общая характеристика типа Моллюски Животные России
Животные России Эволюция и видообразование. Современные представления
Эволюция и видообразование. Современные представления Растительные сообщества городской системы
Растительные сообщества городской системы Биотехнология в селекции растений. Часть 7. Селекция на качество продукции
Биотехнология в селекции растений. Часть 7. Селекция на качество продукции Альвеолата. Инфузории
Альвеолата. Инфузории Ядро клетки. Хромосомный набор клетки
Ядро клетки. Хромосомный набор клетки Животные и птицы (фотографии)
Животные и птицы (фотографии) Функция желез внутренней секреции
Функция желез внутренней секреции Типы питания живых организмов
Типы питания живых организмов Хвойный лес. Экосистема хвойного леса
Хвойный лес. Экосистема хвойного леса Отдел голосеменные
Отдел голосеменные Профессия агроном
Профессия агроном