Содержание
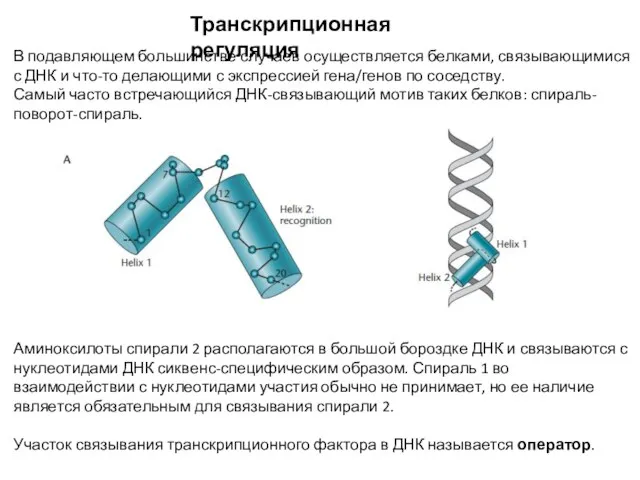
- 2. Транскрипционная регуляция В подавляющем большинстве случаев осуществляется белками, связывающимися с ДНК и что-то делающими с экспрессией
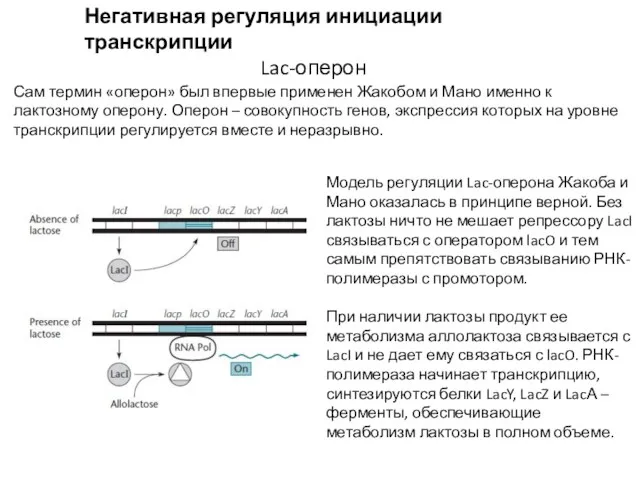
- 3. Негативная регуляция инициации транскрипции Lac-оперон Сам термин «оперон» был впервые применен Жакобом и Мано именно к
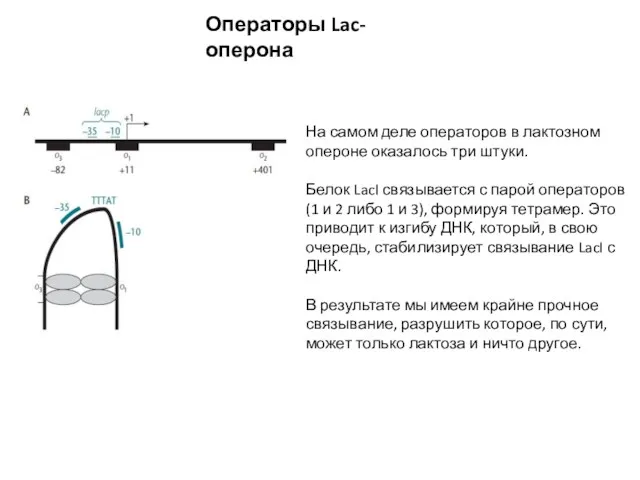
- 4. Операторы Lac-оперона На самом деле операторов в лактозном опероне оказалось три штуки. Белок LacI связывается с
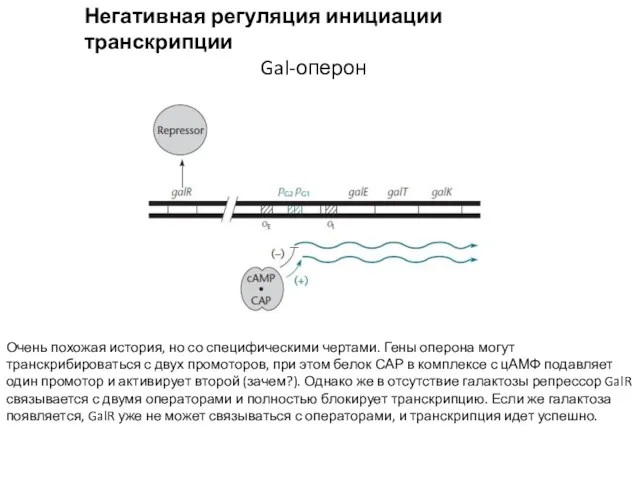
- 5. Негативная регуляция инициации транскрипции Gal-оперон Очень похожая история, но со специфическими чертами. Гены оперона могут транскрибироваться
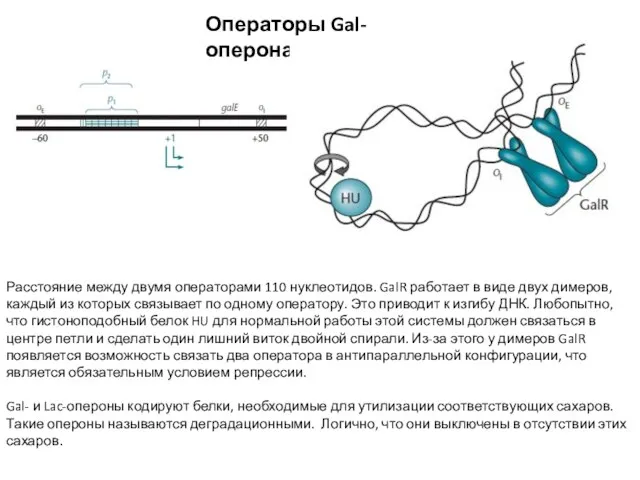
- 6. Операторы Gal-оперона Расстояние между двумя операторами 110 нуклеотидов. GalR работает в виде двух димеров, каждый из
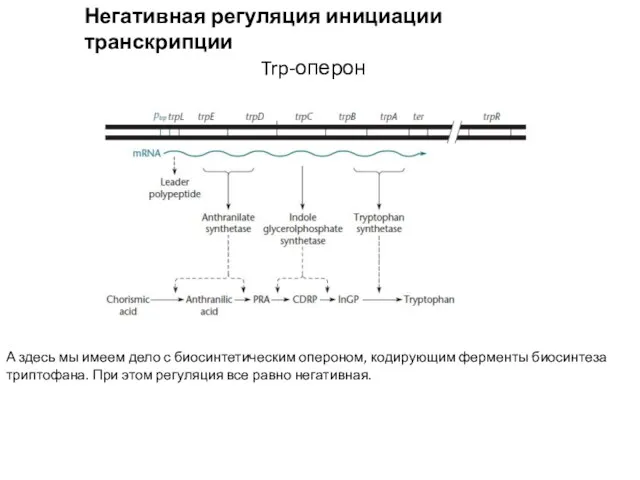
- 7. Негативная регуляция инициации транскрипции Trp-оперон А здесь мы имеем дело с биосинтетическим опероном, кодирующим ферменты биосинтеза
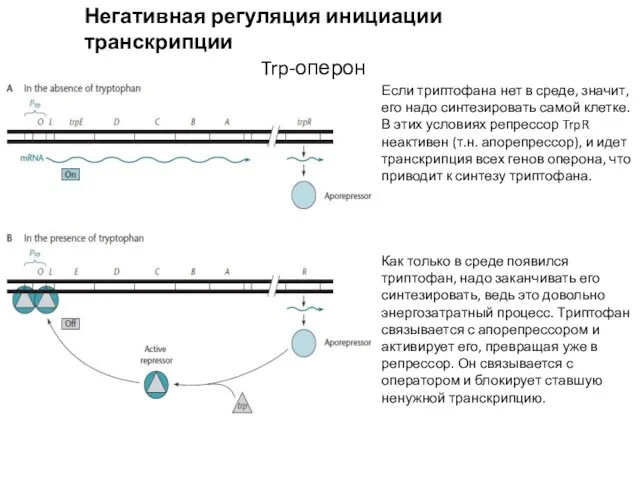
- 8. Негативная регуляция инициации транскрипции Trp-оперон Если триптофана нет в среде, значит, его надо синтезировать самой клетке.
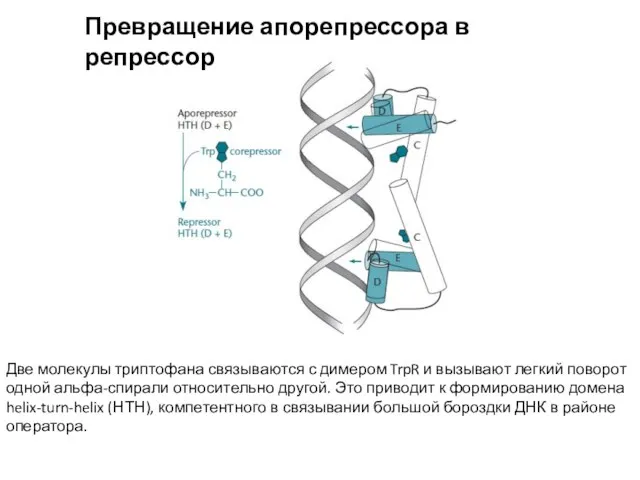
- 9. Превращение апорепрессора в репрессор Две молекулы триптофана связываются с димером TrpR и вызывают легкий поворот одной
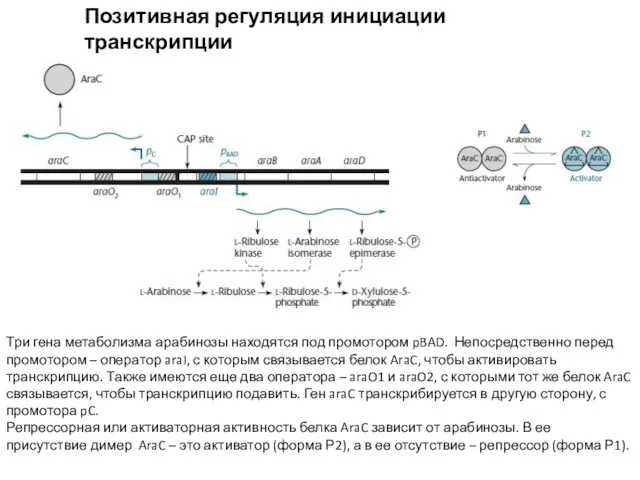
- 10. Позитивная регуляция инициации транскрипции Ara-оперон Три гена метаболизма арабинозы находятся под промотором pBAD. Непосредственно перед промотором
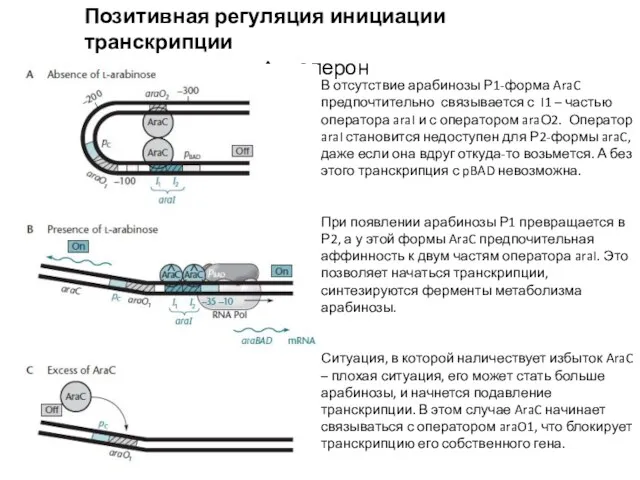
- 11. Позитивная регуляция инициации транскрипции Ara-оперон В отсутствие арабинозы Р1-форма AraC предпочтительно связывается с I1 – частью
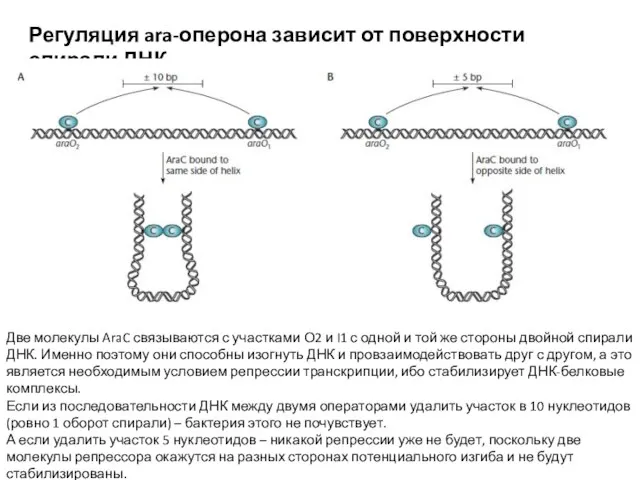
- 12. Регуляция ara-оперона зависит от поверхности спирали ДНК Две молекулы AraC связываются с участками О2 и I1
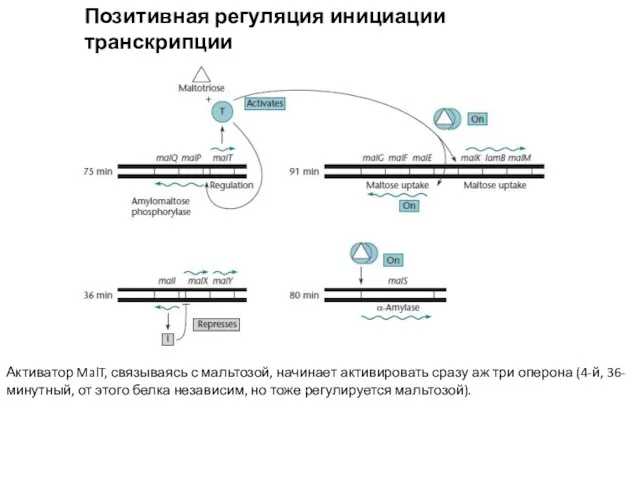
- 13. Позитивная регуляция инициации транскрипции Mal-опероны Активатор MalT, связываясь с мальтозой, начинает активировать сразу аж три оперона
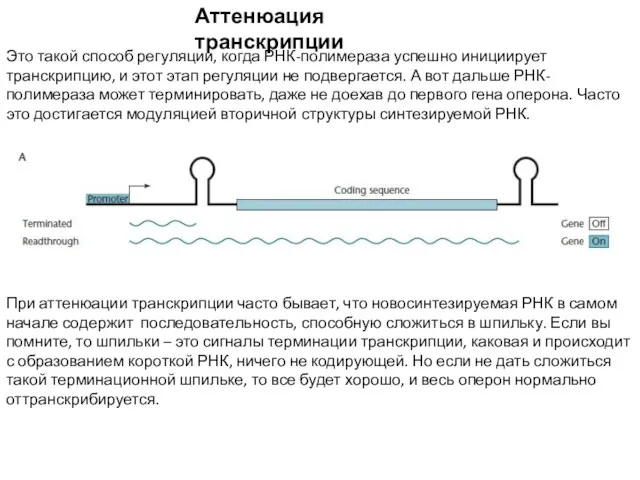
- 14. Аттенюация транскрипции Это такой способ регуляции, когда РНК-полимераза успешно инициирует транскрипцию, и этот этап регуляции не
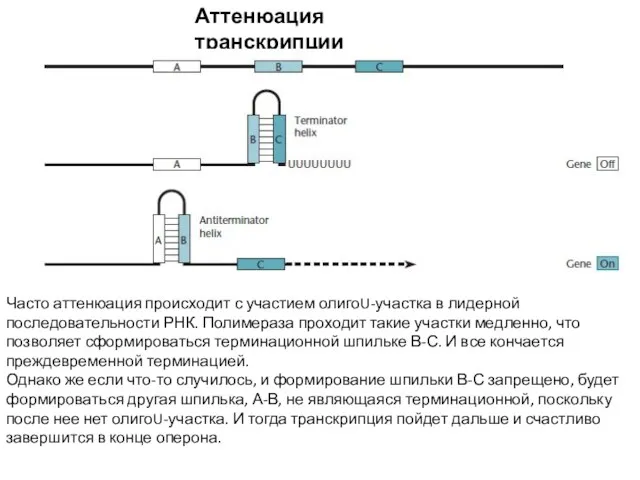
- 15. Аттенюация транскрипции Часто аттенюация происходит с участием олигоU-участка в лидерной последовательности РНК. Полимераза проходит такие участки
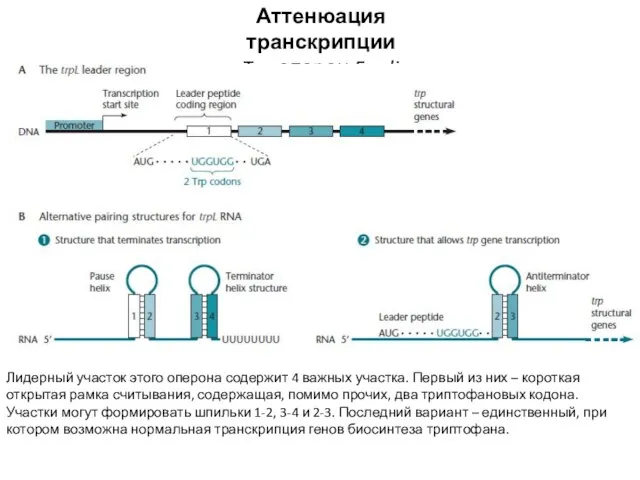
- 16. Аттенюация транскрипции Trp-оперон E.coli Лидерный участок этого оперона содержит 4 важных участка. Первый из них –
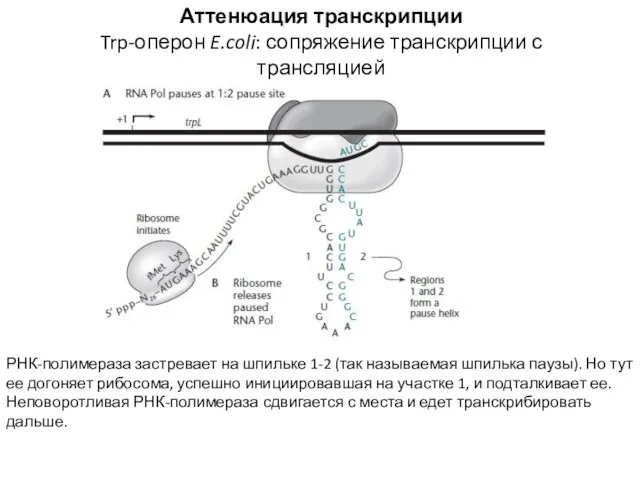
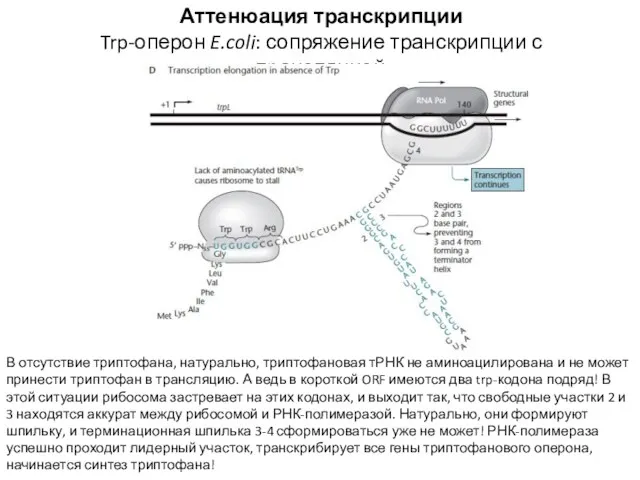
- 17. Аттенюация транскрипции Trp-оперон E.coli: сопряжение транскрипции с трансляцией РНК-полимераза застревает на шпильке 1-2 (так называемая шпилька
- 18. Аттенюация транскрипции Trp-оперон E.coli: сопряжение транскрипции с трансляцией В отсутствие триптофана, натурально, триптофановая тРНК не аминоацилирована
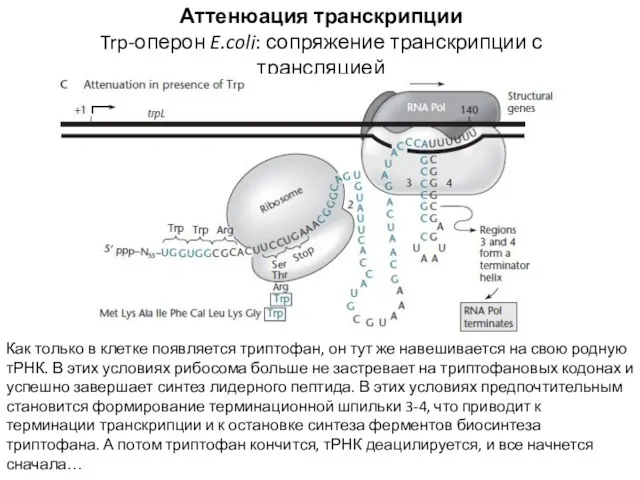
- 19. Аттенюация транскрипции Trp-оперон E.coli: сопряжение транскрипции с трансляцией Как только в клетке появляется триптофан, он тут
- 20. Аттенюация транскрипции Trp-оперон B.subtilis У этой бактерии аттенюация триптофанового оперона происходит совсем не так, но с
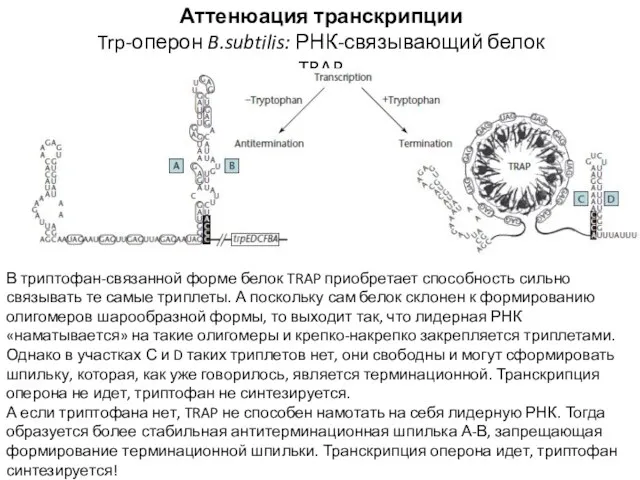
- 21. Аттенюация транскрипции Trp-оперон B.subtilis: РНК-связывающий белок TRAP В триптофан-связанной форме белок TRAP приобретает способность сильно связывать
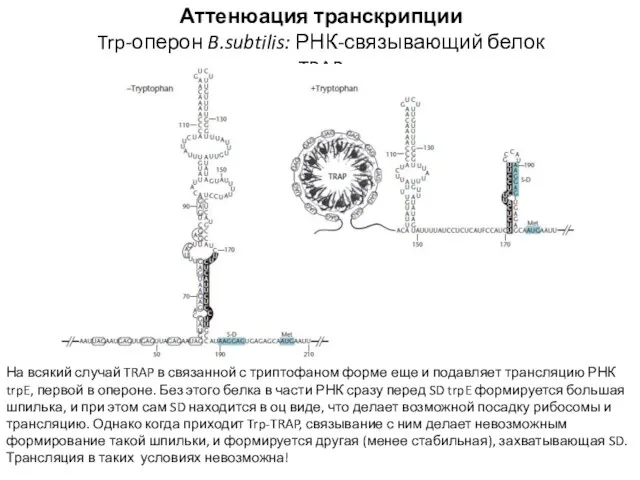
- 22. Аттенюация транскрипции Trp-оперон B.subtilis: РНК-связывающий белок TRAP На всякий случай TRAP в связанной с триптофаном форме
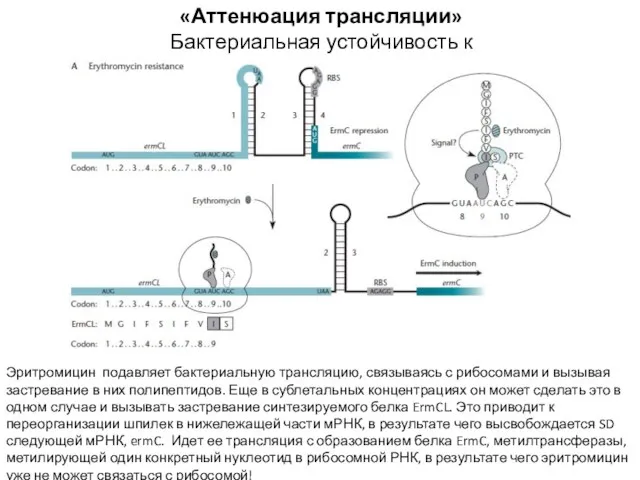
- 23. «Аттенюация трансляции» Бактериальная устойчивость к эритромицину Эритромицин подавляет бактериальную трансляцию, связываясь с рибосомами и вызывая застревание
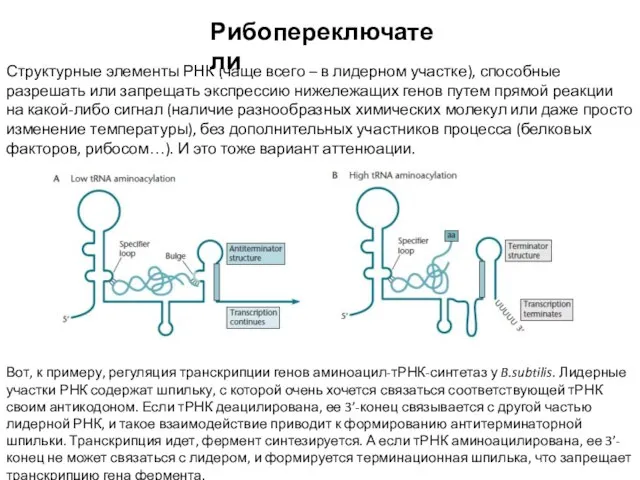
- 24. Рибопереключатели Структурные элементы РНК (чаще всего – в лидерном участке), способные разрешать или запрещать экспрессию нижележащих
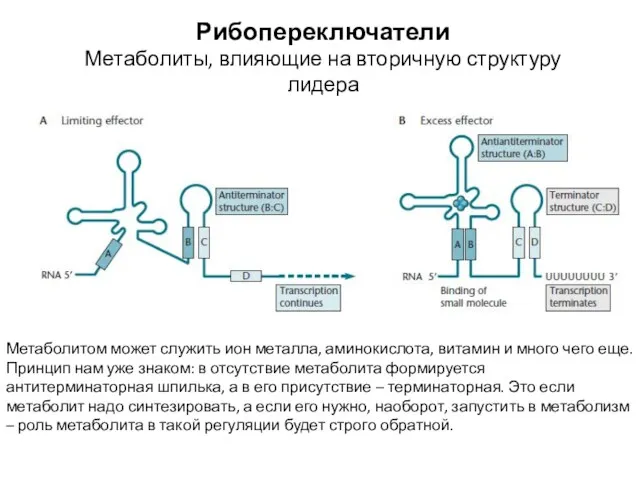
- 25. Рибопереключатели Метаболиты, влияющие на вторичную структуру лидера Метаболитом может служить ион металла, аминокислота, витамин и много
- 27. Скачать презентацию

 Технология возделывания гречихи
Технология возделывания гречихи Почему мы любим кошек и собак
Почему мы любим кошек и собак Гистология и цитология, их содержание, задачи, связь с другими науками, значение
Гистология и цитология, их содержание, задачи, связь с другими науками, значение Генеалогия и здоровье моей семьи
Генеалогия и здоровье моей семьи Особо охраняемые территории Ленинградской области. Заказник Раковые озера
Особо охраняемые территории Ленинградской области. Заказник Раковые озера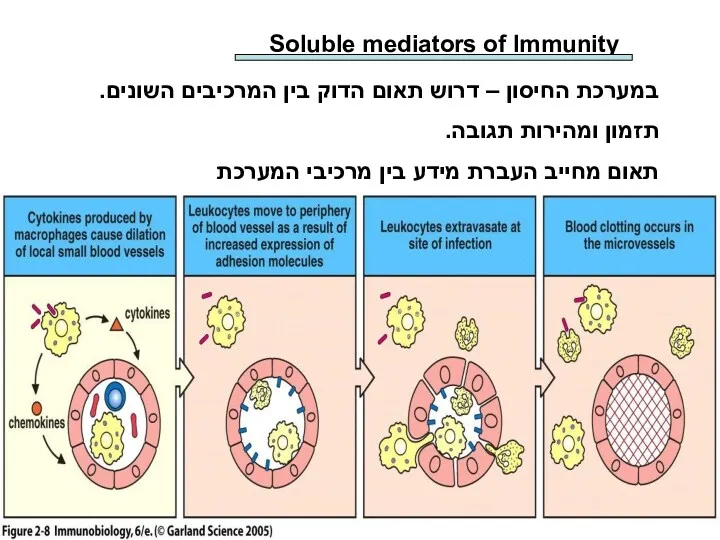 Soluble mediators of Immunity
Soluble mediators of Immunity Рефлексы
Рефлексы Тозаңдану дегеніміз не?
Тозаңдану дегеніміз не? Надорганизменный уровень биомониторинга
Надорганизменный уровень биомониторинга Первая эволюционная теория Ламарка
Первая эволюционная теория Ламарка Белки. Классификация белков. (Тема 2)
Белки. Классификация белков. (Тема 2) Разнообразие и особенности строения моллюсков
Разнообразие и особенности строения моллюсков История биологии
История биологии Правда о происхождении жизни
Правда о происхождении жизни Разнообразие животных
Разнообразие животных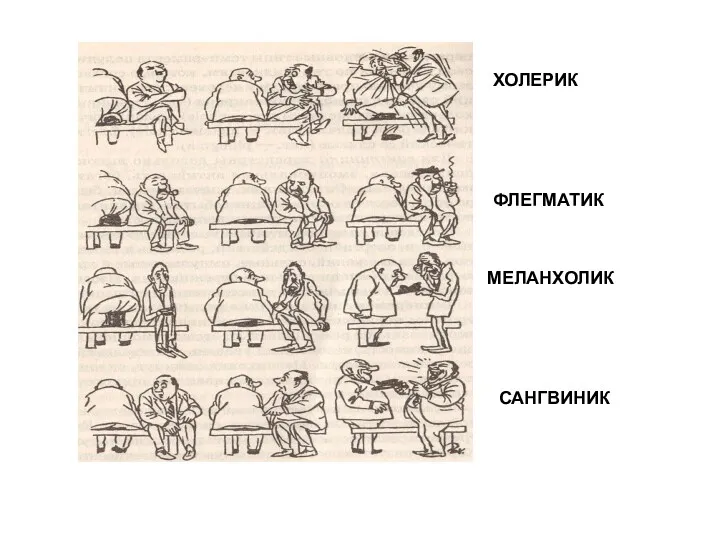 Холерик. Флегматик. Меланхолик. Сангвиник
Холерик. Флегматик. Меланхолик. Сангвиник Біологічна продуктивність водойм. Охорона водойм від забруднення
Біологічна продуктивність водойм. Охорона водойм від забруднення Презентация Гигиена питания и предупреждение желудочно-кишечных заболеваний.
Презентация Гигиена питания и предупреждение желудочно-кишечных заболеваний. Физические принципы оптической микроскопии, сахариметрии,рефрактометрии. (Лекция 11)
Физические принципы оптической микроскопии, сахариметрии,рефрактометрии. (Лекция 11) Зоология позвоночных. Систематика птиц. (Лекция 9)
Зоология позвоночных. Систематика птиц. (Лекция 9) Надкласс рыбы. Особенности внешнего строения рыб в связи с водной средой обитания
Надкласс рыбы. Особенности внешнего строения рыб в связи с водной средой обитания Развитие жизни на Земле
Развитие жизни на Земле Бесполое размножение
Бесполое размножение Синтез олигонуклеотидов (2)
Синтез олигонуклеотидов (2) Органы. Системы органов
Органы. Системы органов Викторина День Птиц 2020
Викторина День Птиц 2020 Тест. Основы общей и медицинской генетики
Тест. Основы общей и медицинской генетики Внеклассное мероприятие Знать и охранять природу - значит знать и охранять Родину
Внеклассное мероприятие Знать и охранять природу - значит знать и охранять Родину