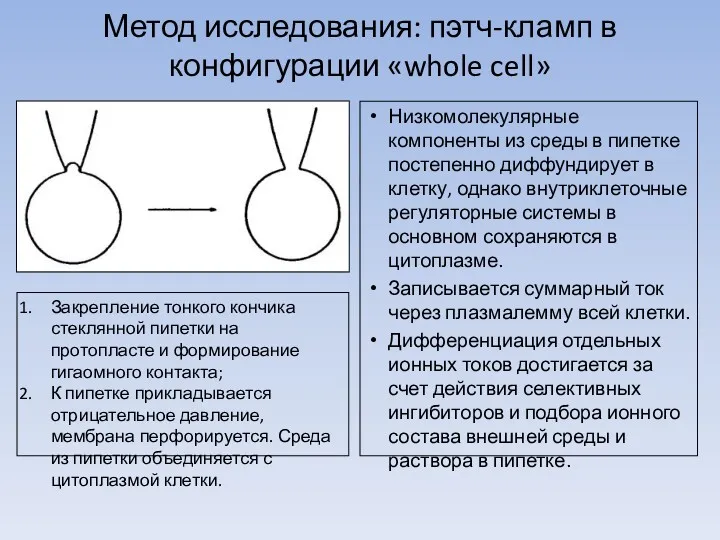
Метод исследования: пэтч-кламп в конфигурации «whole cell»
Низкомолекулярные компоненты из среды в
пипетке постепенно диффундирует в клетку, однако внутриклеточные регуляторные системы в основном сохраняются в цитоплазме.
Записывается суммарный ток через плазмалемму всей клетки.
Дифференциация отдельных ионных токов достигается за счет действия селективных ингибиторов и подбора ионного состава внешней среды и раствора в пипетке.
Закрепление тонкого кончика стеклянной пипетки на протопласте и формирование гигаомного контакта;
К пипетке прикладывается отрицательное давление, мембрана перфорируется. Среда из пипетки объединяется с цитоплазмой клетки.
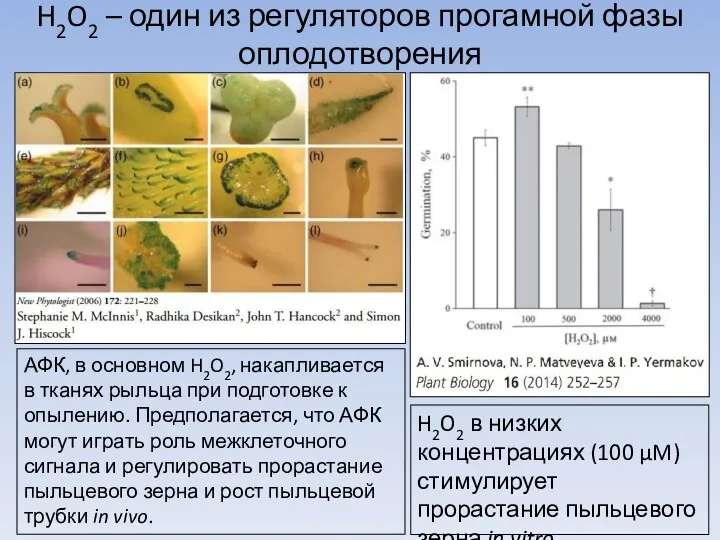
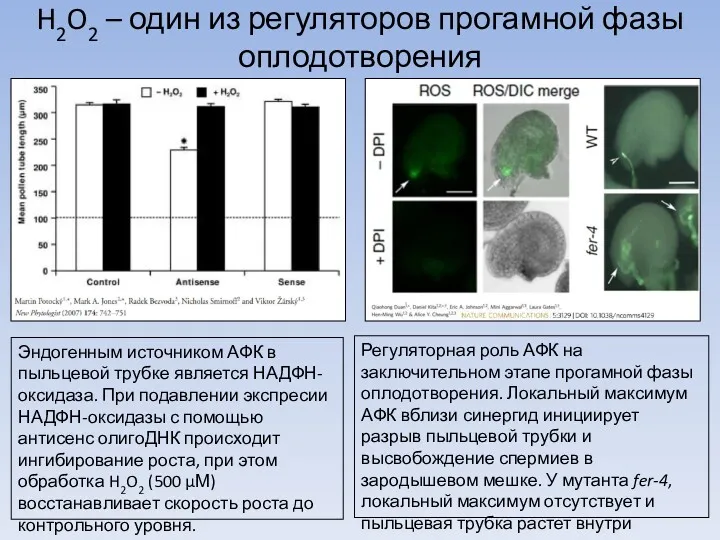
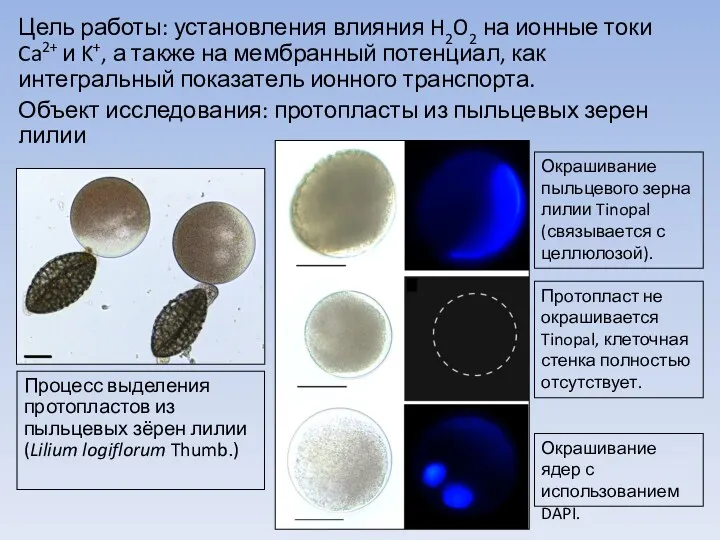
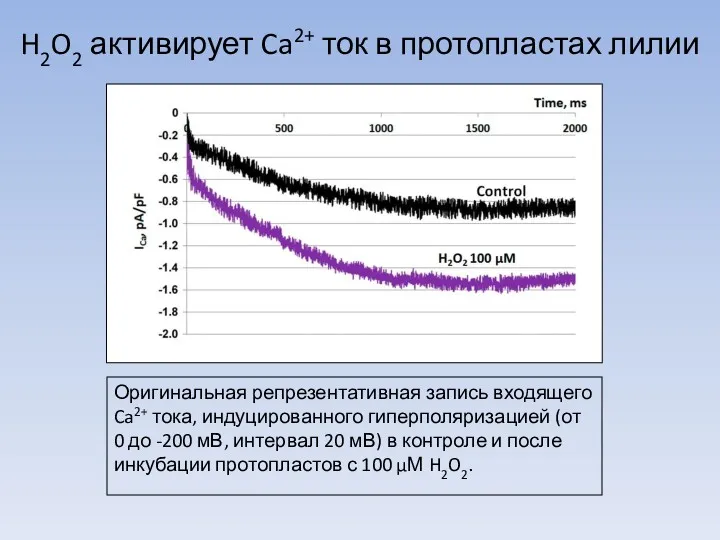
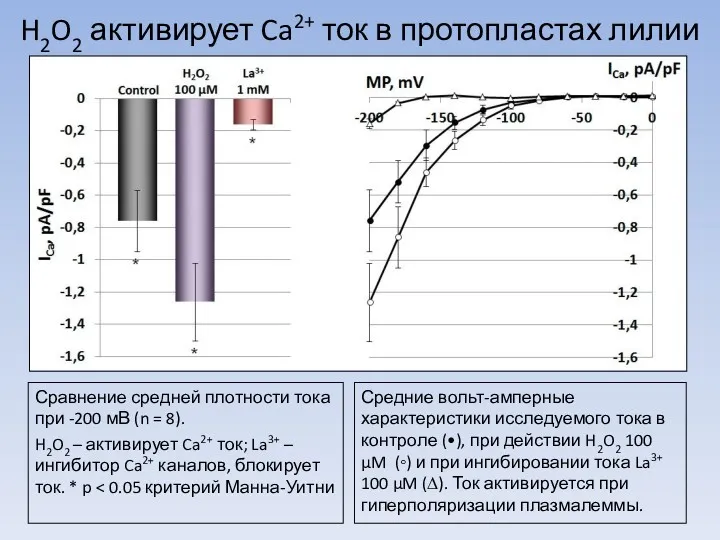
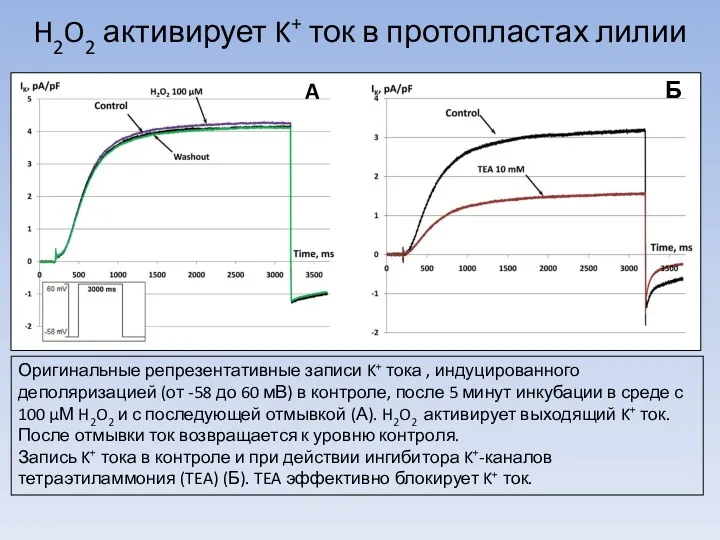
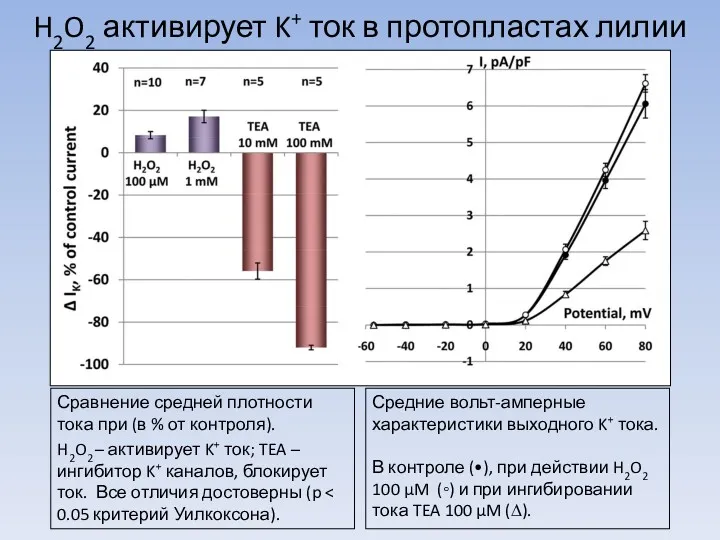

 Легенды и были о цветах
Легенды и были о цветах Клетка. Её состав, строение и жизнедеятельность
Клетка. Её состав, строение и жизнедеятельность Концепция коэволюции Н.Н. Моисеева
Концепция коэволюции Н.Н. Моисеева Многообразие паукообразных и их значение в природе и жизни человека. Общая характеристика паукообразных
Многообразие паукообразных и их значение в природе и жизни человека. Общая характеристика паукообразных Анатомия и физиология ротовой полости, глотки, пищевода, желудка
Анатомия и физиология ротовой полости, глотки, пищевода, желудка Что общего у разных растений
Что общего у разных растений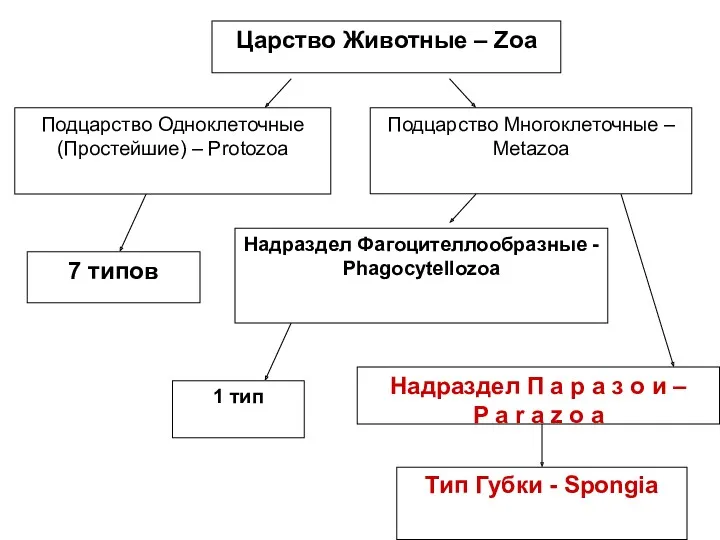 Царство животные. Тип губки
Царство животные. Тип губки Жизнедеятельность клетки
Жизнедеятельность клетки Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Гипоталамус и гипофиз: нейроэндокринная регуляция. Либерины, статины, тропные гормоны. Влияние гормонов на функции ЦНС
Гипоталамус и гипофиз: нейроэндокринная регуляция. Либерины, статины, тропные гормоны. Влияние гормонов на функции ЦНС Мейоз
Мейоз Растения занесенные в Красную книгу Волгоградской области
Растения занесенные в Красную книгу Волгоградской области Су-тұз алмасу бұзылыстарының клиникалық биохимиясы
Су-тұз алмасу бұзылыстарының клиникалық биохимиясы Формирование урожая различных сортов земляники в условиях ГНУ Оренбургская опытная станция
Формирование урожая различных сортов земляники в условиях ГНУ Оренбургская опытная станция Регуляция пищеварения. Гигиена органов пищеварения
Регуляция пищеварения. Гигиена органов пищеварения Гормоны растений
Гормоны растений Семейство Сосновые Pinaceae
Семейство Сосновые Pinaceae Spooky Spiders
Spooky Spiders Мой домашний питомец – красноухая черепаха
Мой домашний питомец – красноухая черепаха Гусеницы и бабочки
Гусеницы и бабочки Жизнедеятельность клетки питание и дыхание
Жизнедеятельность клетки питание и дыхание Дыхание растений
Дыхание растений Отдел Папоротниковидные
Отдел Папоротниковидные Наши домашние питомцы и русская фразеология. 5 класс
Наши домашние питомцы и русская фразеология. 5 класс Гниение аминокислот в кишечнике
Гниение аминокислот в кишечнике The mechanism of chromosome, gene mutation. The theory of mutation of Hugo De Vries
The mechanism of chromosome, gene mutation. The theory of mutation of Hugo De Vries Презентация по теме Вирусы
Презентация по теме Вирусы Сезонные изменения в жизни организмов
Сезонные изменения в жизни организмов