Содержание
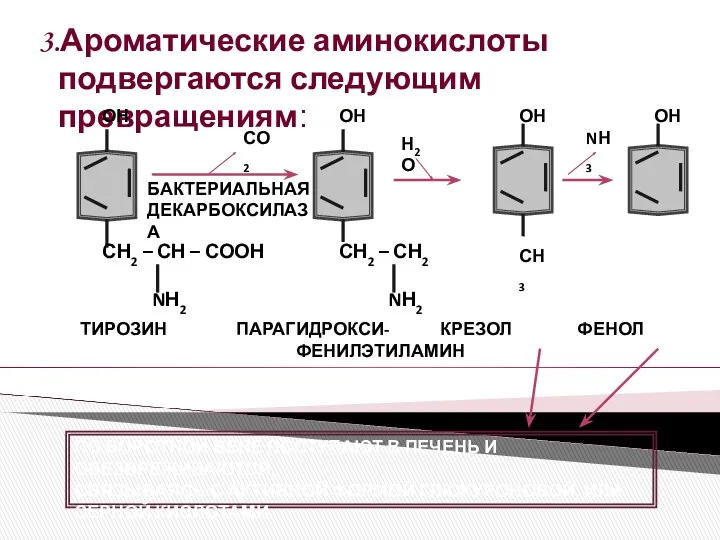
- 2. 3.Ароматические аминокислоты подвергаются следующим превращениям: СН2 – СН – СООН NН2 СН2 – СН2 NН2 ОН
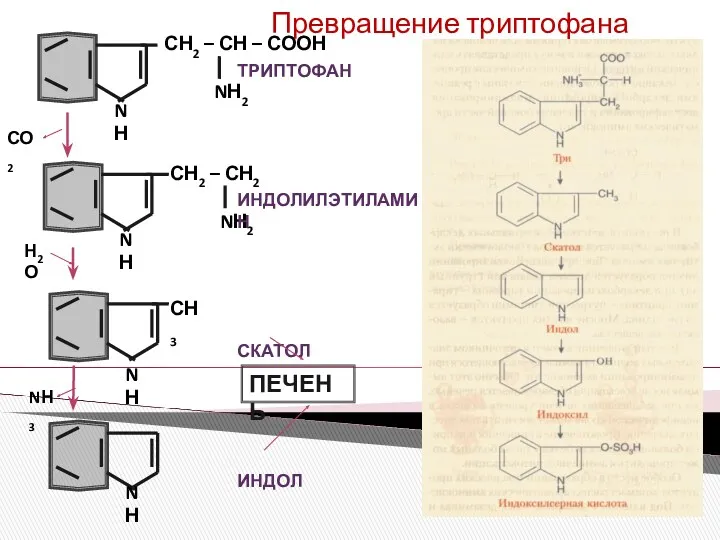
- 3. СН2 – СН2 NН2 СН2 – СН – СООН NН2 СН3 СО2 Н2О NН3 N Н
- 4. Обезвреживание токсических веществ в печени включает следующие 3 этапа: 1. Окисление токсических веществ; 2. Глюкуронирование или
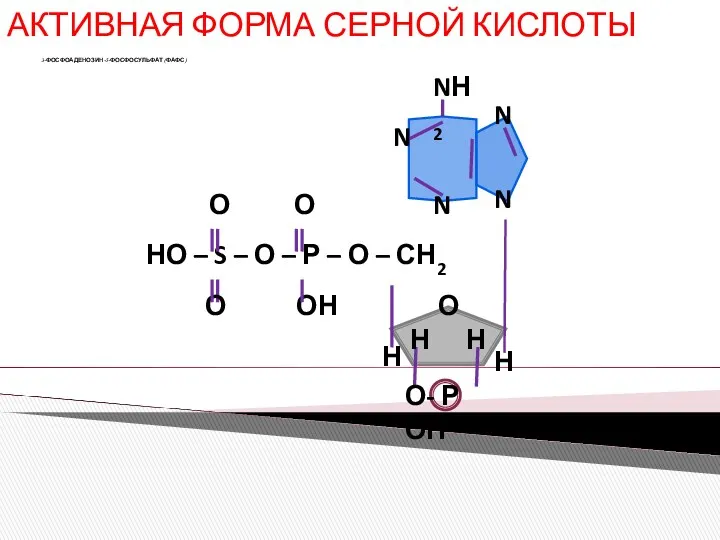
- 5. АКТИВНАЯ ФОРМА СЕРНОЙ КИСЛОТЫ 3-ФОСФОАДЕНОЗИН-5-ФОСФОСУЛЬФАТ (ФАФС)
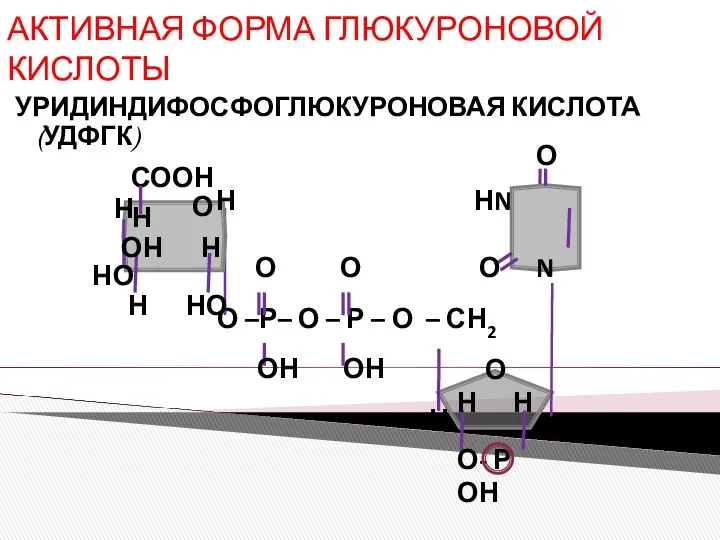
- 6. АКТИВНАЯ ФОРМА ГЛЮКУРОНОВОЙ КИСЛОТЫ УРИДИНДИФОСФОГЛЮКУРОНОВАЯ КИСЛОТА (УДФГК) О- Р ОН Н
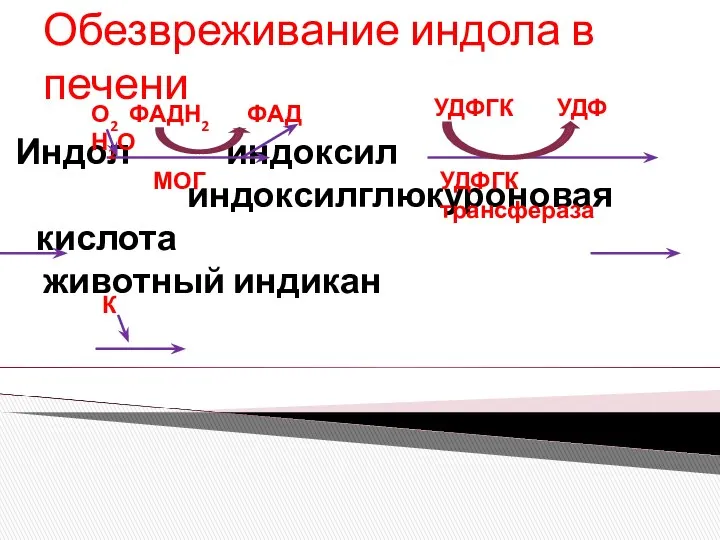
- 7. Обезвреживание индола в печени Индол индоксил индоксилглюкуроновая кислота животный индикан УДФГК трансфераза УДФГК УДФ МОГ К
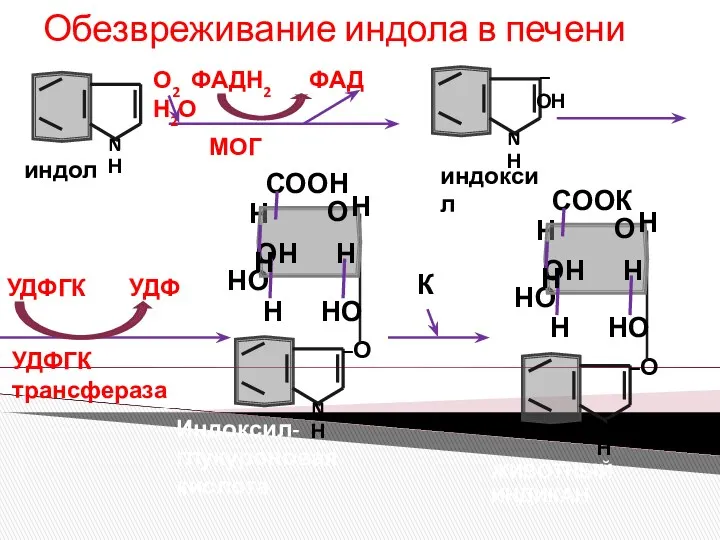
- 8. Обезвреживание индола в печени индол МОГ О2 ФАДН2 ФАД Н2О индоксил УДФГК трансфераза УДФГК УДФ Индоксил-глукуроновая
- 9. Промежуточный обмен аминокислот А) Общие пути катаболизма аминокислот: 1. Трансаминирование; 2. Дезаминирование: а) окислительное (прямое, непрямое);
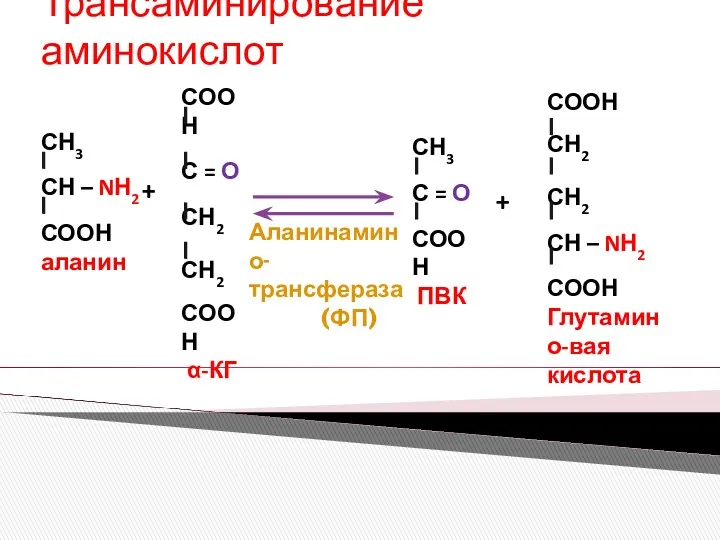
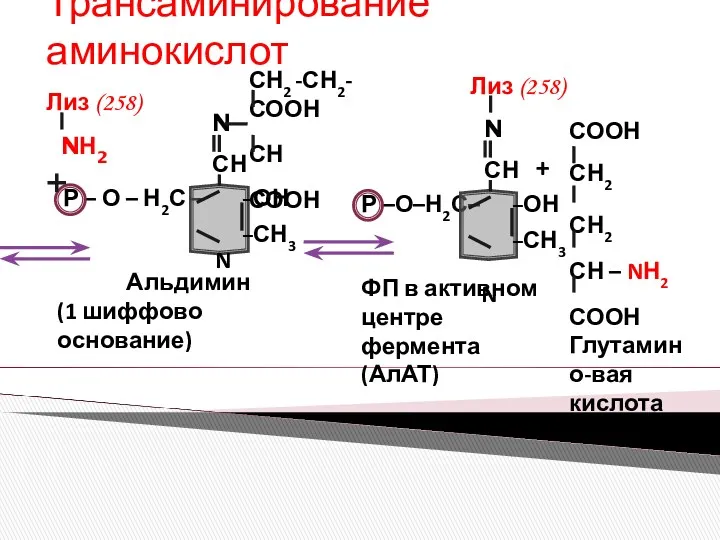
- 10. Трансаминирование аминокислот + + Аланинамино-трансфераза (ФП)
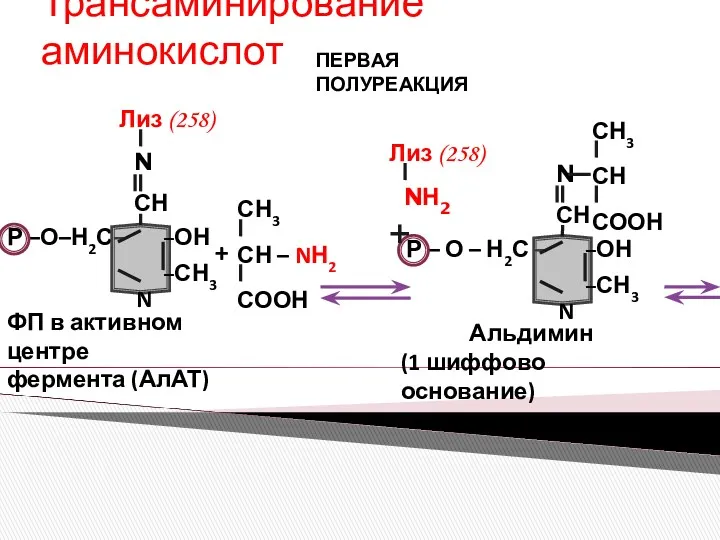
- 11. Трансаминирование аминокислот ПЕРВАЯ ПОЛУРЕАКЦИЯ
- 12. Трансаминирование аминокислот НОН НОН
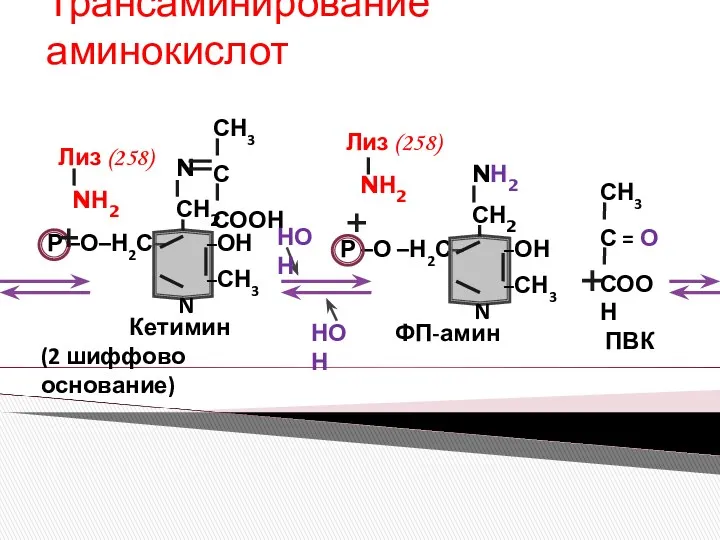
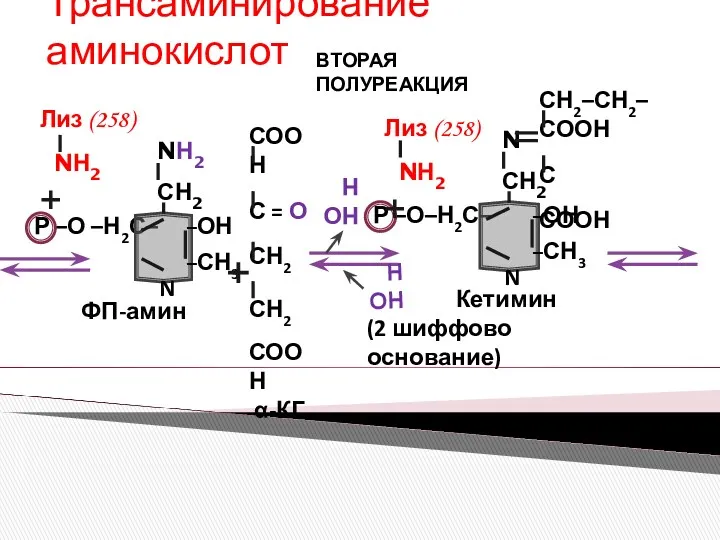
- 13. Трансаминирование аминокислот ВТОРАЯ ПОЛУРЕАКЦИЯ НОН НОН
- 14. Трансаминирование аминокислот
- 15. Лекция Дезаминирование аминокислот. Пути образования и обезвреживания аммиака в организме.
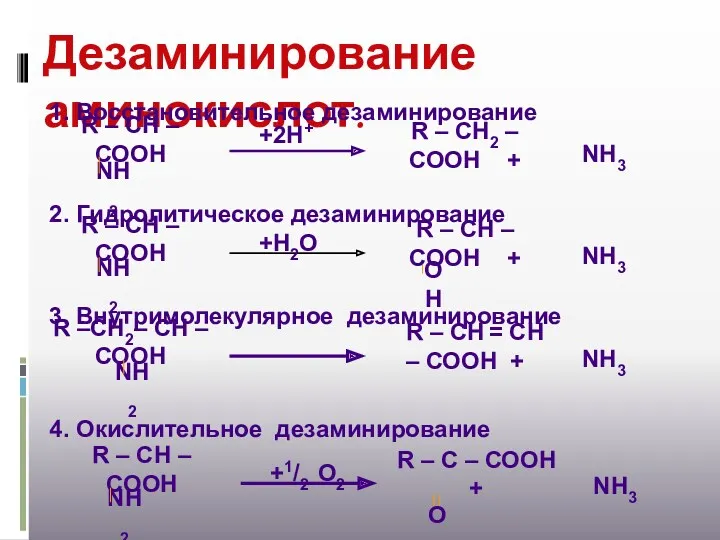
- 16. Дезаминирование аминокислот. 1. Восстановительное дезаминирование 2. Гидролитическое дезаминирование 3. Внутримолекулярное дезаминирование 4. Окислительное дезаминирование
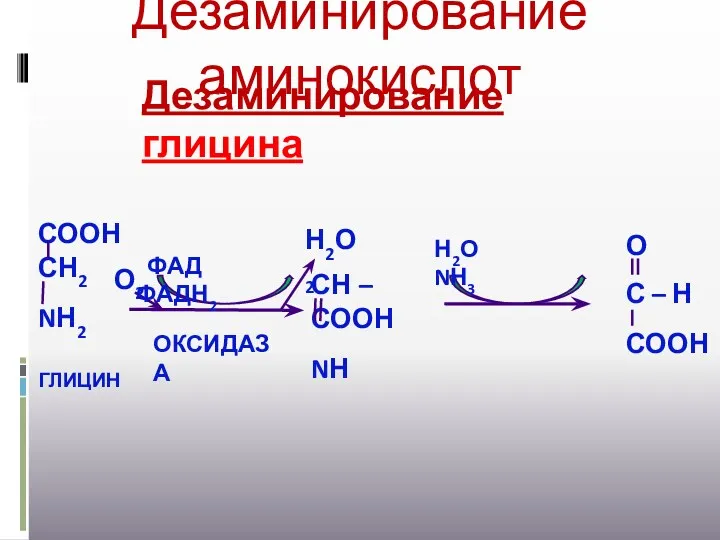
- 17. Дезаминирование аминокислот Н2О NН3 ФАД ФАДН2 О2 Н2О2 ОКСИДАЗА Дезаминирование глицина
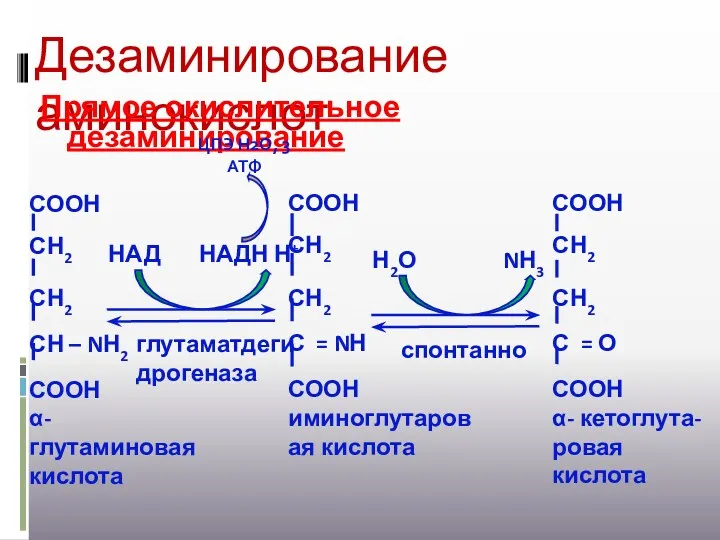
- 18. Дезаминирование аминокислот Прямое окислительное дезаминирование глутаматдегидрогеназа НАД НАДН Н+ спонтанно Н2О NН3 ЦПЭ Н2О, 3 АТФ
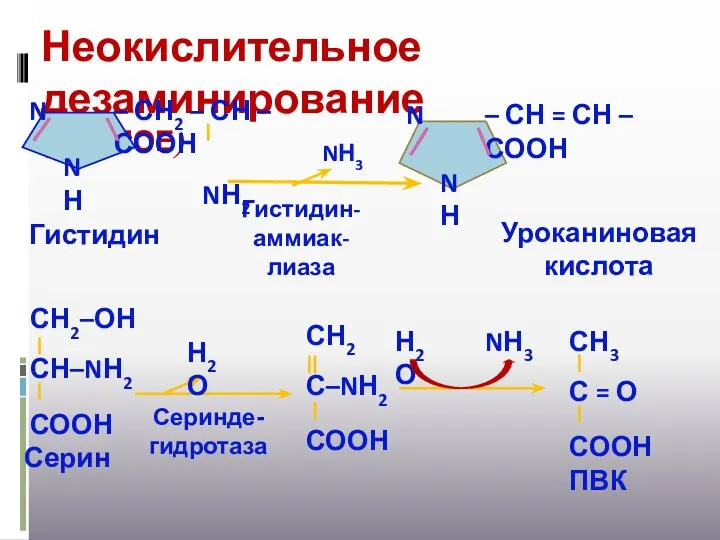
- 19. Неокислительное дезаминирование (ПРЯМОЕ) NН3 Гистидин-аммиак- лиаза NН3 Н2О Н2О Серинде- гидротаза Гистидин
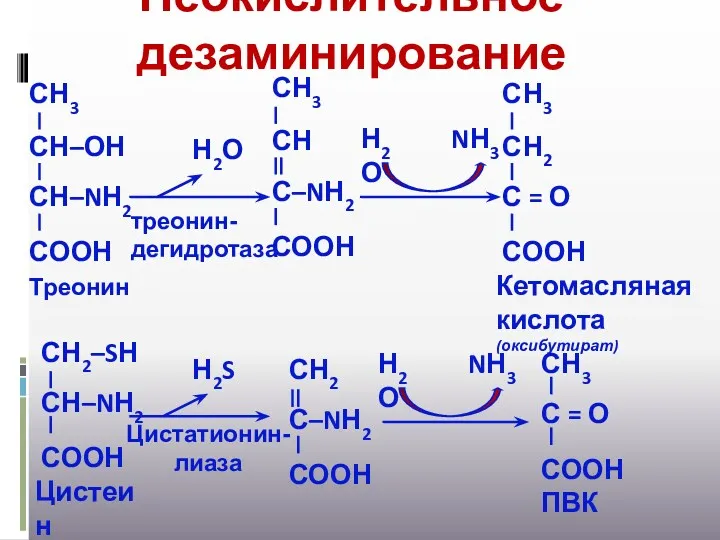
- 20. Неокислительное дезаминирование Н2О NН3 Н2О треонин-дегидротаза
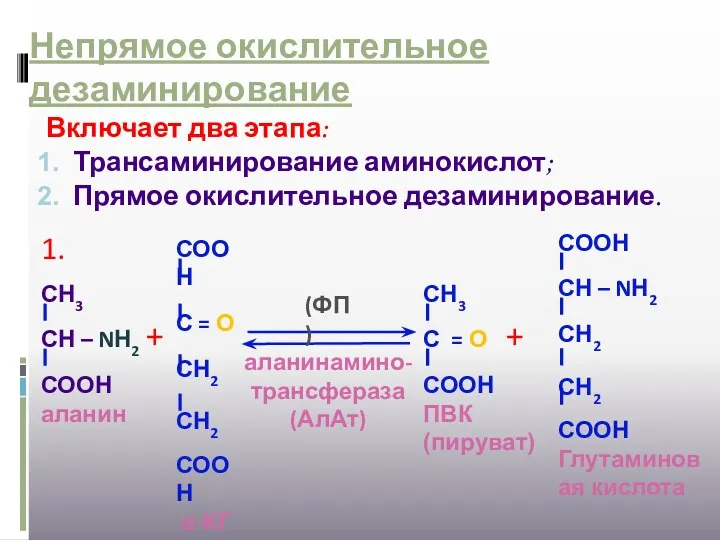
- 21. Непрямое окислительное дезаминирование Включает два этапа: Трансаминирование аминокислот; Прямое окислительное дезаминирование. + аланинамино-трансфераза (АлАт) + 1.
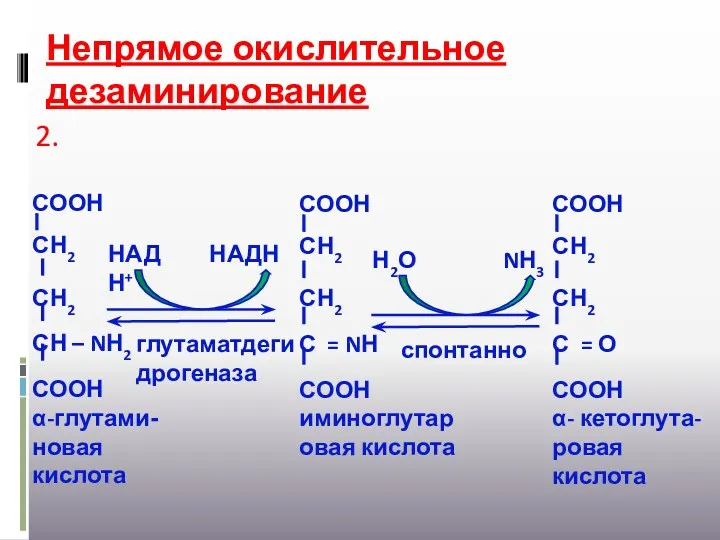
- 22. Непрямое окислительное дезаминирование СООН СН2 СН2 СН – NН2 СООН α-глутами-новая кислота глутаматдегидрогеназа НАД НАДН Н+
- 23. Основные источники аммиака 1. Поступление аммиака из кишечника в портальную вену; 2. Окислительное дезаминирование аминокислот; 3.
- 24. Действие аммиака на организм: При восстановительном аминировании α-кетоглутаровая кислота отвлекается от ЦТК , что может привести
- 25. Пути обезвреживания аммиака: Связывание аммиака с глутаминовой и реже аспарагиновой кислотами свободными и в составе белков
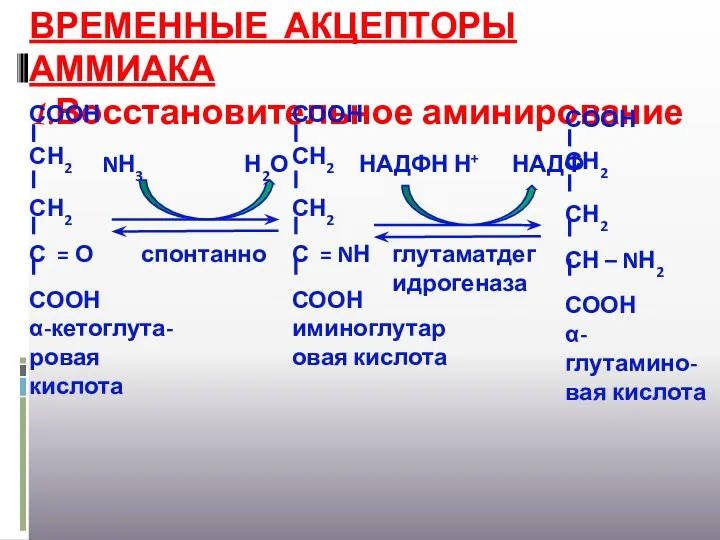
- 26. ВРЕМЕННЫЕ АКЦЕПТОРЫ АММИАКА 1.Восстановительное аминирование
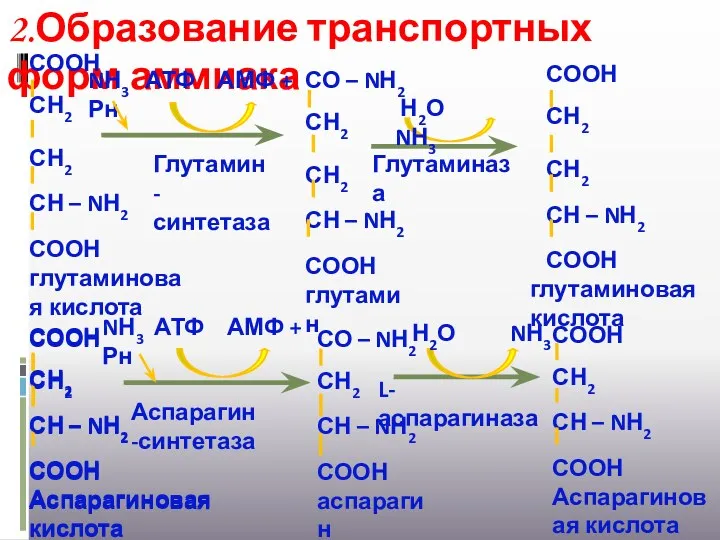
- 27. 2.Образование транспортных форм аммиака Глутаминаза L-аспарагиназа Н2О NН3 Н2О NН3 СООН СН2 СН2 СН – NН2
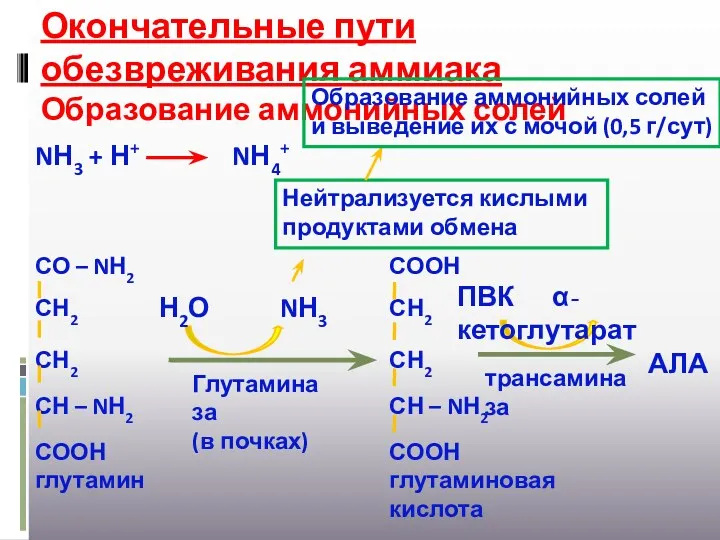
- 28. Окончательные пути обезвреживания аммиака Образование аммонийных солей Глутаминаза (в почках) Н2О NН3 трансаминаза ПВК α-кетоглутарат АЛА
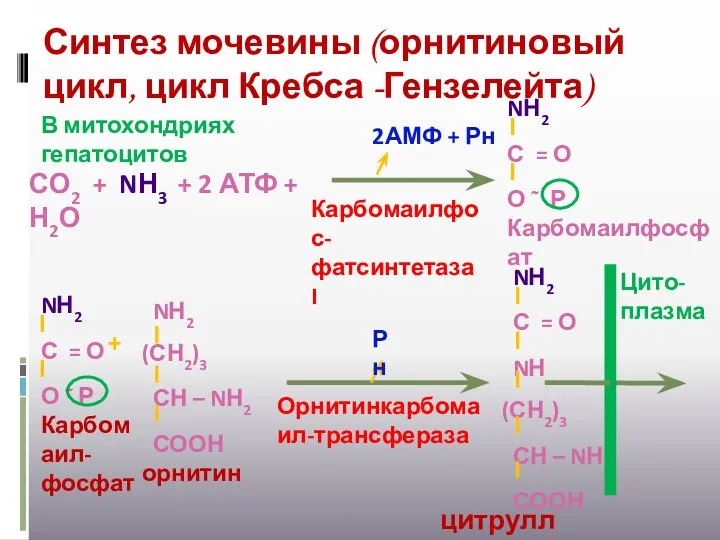
- 29. Синтез мочевины (орнитиновый цикл, цикл Кребса -Гензелейта) В митохондриях гепатоцитов СО2 + NН3 + 2 АТФ
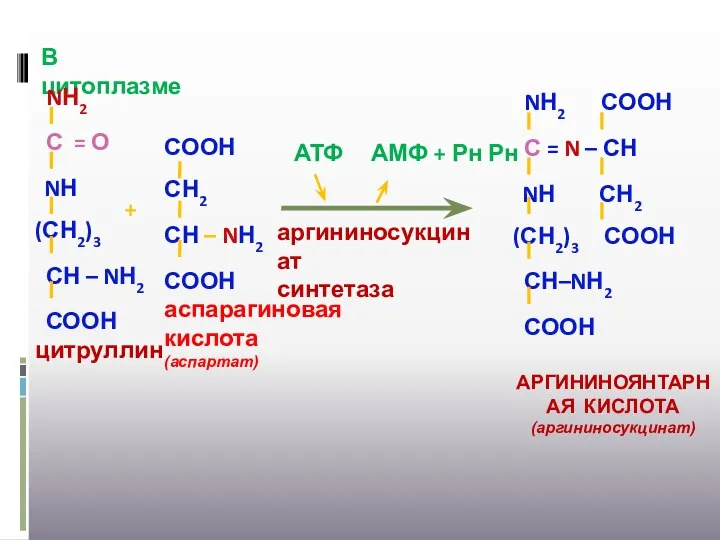
- 30. АТФ АМФ + Рн Рн аргининосукцинат синтетаза В цитоплазме +
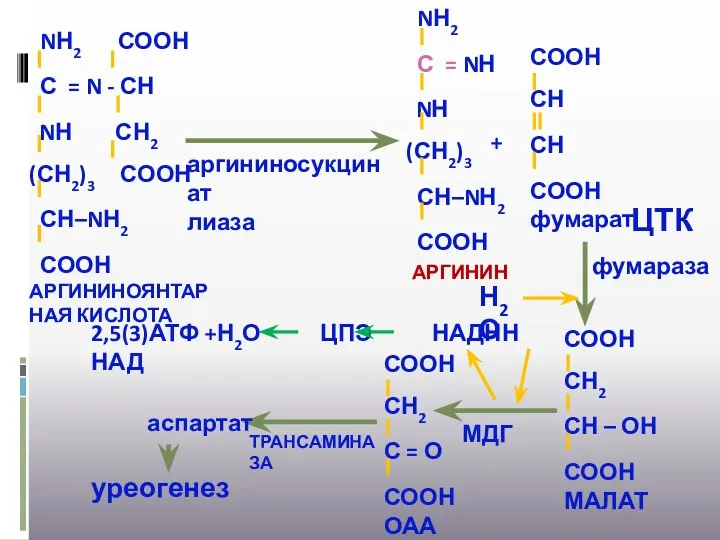
- 31. аргининосукцинат лиаза + ЦТК фумараза Н2О МДГ ТРАНСАМИНАЗА 2,5(3)АТФ +Н2О ЦПЭ НАДНН НАД аспартат уреогенез
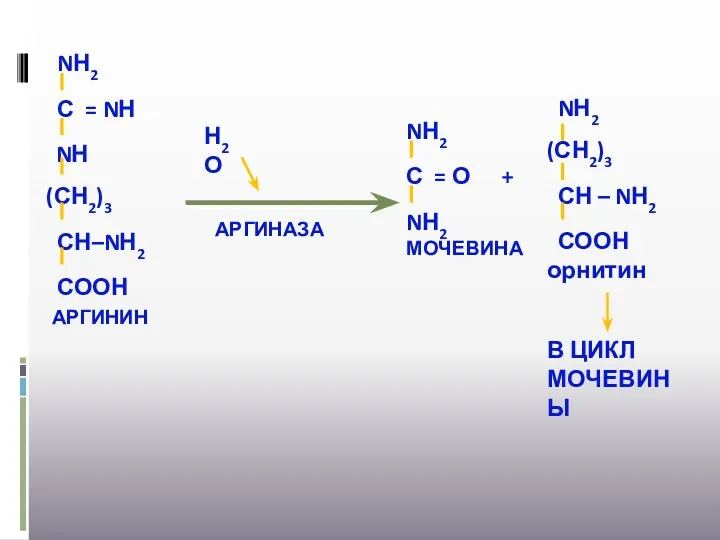
- 32. Н2О АРГИНАЗА + В ЦИКЛ МОЧЕВИНЫ
- 33. Содержание мочевины в сыворотке крови составляет 3,3- 8,3 ммоль/л Выделяется с мочой - 333-583 ммоль/сут (20-35
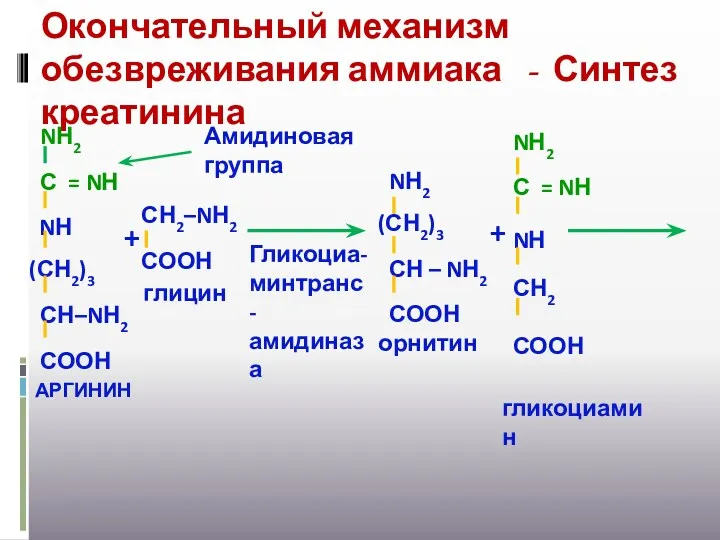
- 34. Окончательный механизм обезвреживания аммиака - Синтез креатинина + Гликоциа-минтранс-амидиназа + Амидиновая группа
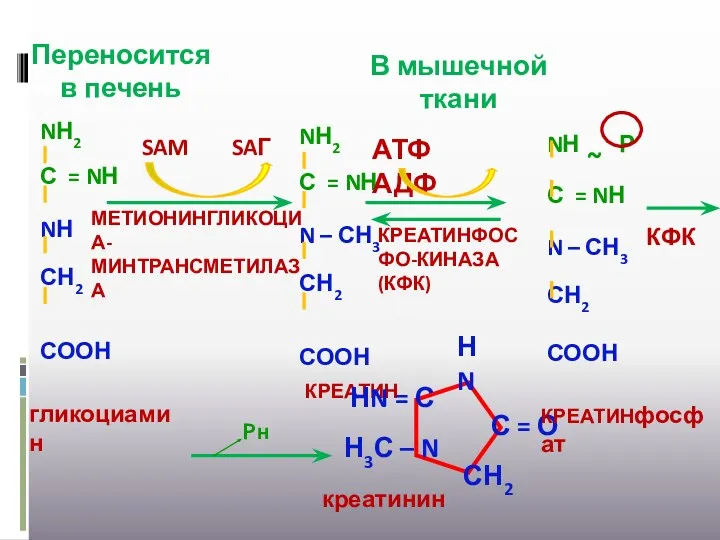
- 35. Переносится в печень SAM SAГ МЕТИОНИНГЛИКОЦИА-МИНТРАНСМЕТИЛАЗА АТФ АДФ КРЕАТИНФОСФО-КИНАЗА (КФК) КФК В мышечной ткани Рн
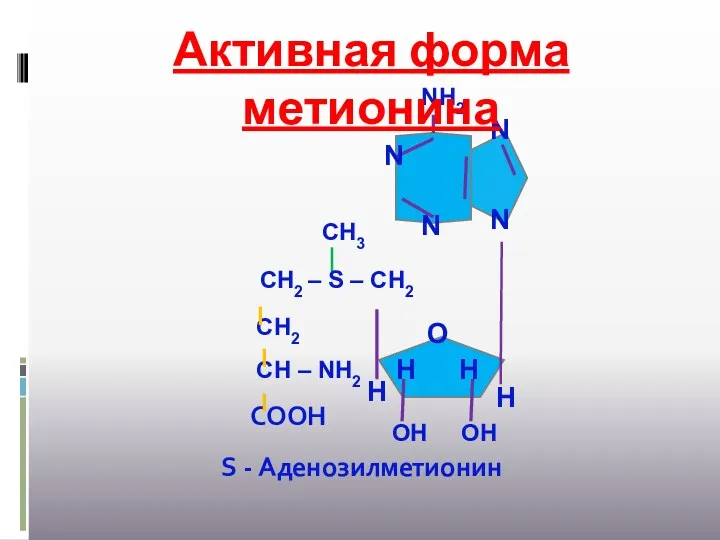
- 36. Активная форма метионина
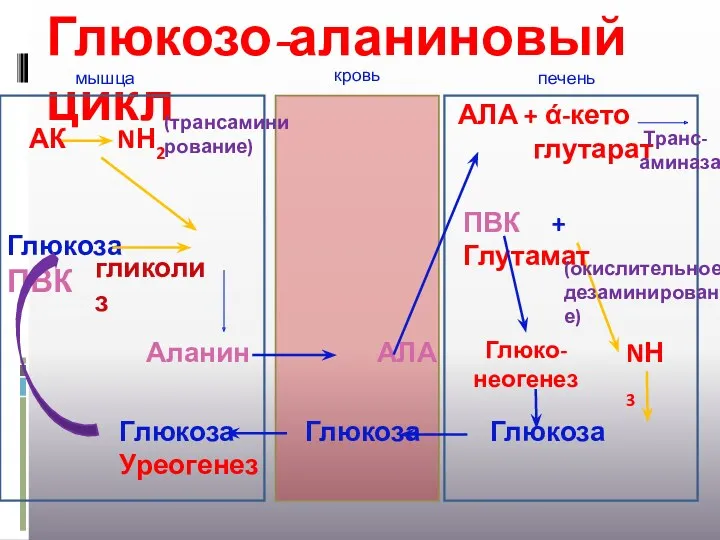
- 37. Глюкозо-аланиновый цикл АК NН2 (трансамини рование) Глюкоза ПВК гликолиз Глюкоза Глюкоза Глюкоза Уреогенез Аланин АЛА АЛА
- 38. Нарушение процесса мочевинообразования приводит к повышению концентрации аммиака в крови (гипераммониемии). Причины гипераммониемии: Врожденная недостаточность хотя
- 39. Клинические проявления гипераммониемии: 1. Тошнота, рвота; 2. Отвращение к белковой пище; 3. Нарушение координации движения; 4.
- 40. Гиперазотемия 1. Абсолютная: а) Ретенционная (задержка): - почечная (нарушение выделительной функции почек, инфекционные заболевания: гломерулонефрит, пиелонефрит,
- 41. Основная литература: Т.Т. Березов, Б.Ф. Коровкин «Биологическая химия», издание третье, Москва, 2007, стр. 431-434, 446-450 Е.С.
- 43. Скачать презентацию











 Воздействие антропогенного фактора на биосферу города Старая Купавна
Воздействие антропогенного фактора на биосферу города Старая Купавна Насекомые. Игра Как стать миллионером
Насекомые. Игра Как стать миллионером Углеводы. Моносахариды. (Лекция 13)
Углеводы. Моносахариды. (Лекция 13) Размножение и развитие птиц
Размножение и развитие птиц Дикие и домашние животные
Дикие и домашние животные Сердечнососудистая система
Сердечнососудистая система Влияние сроков посева на рост и развитие сеянцев сосны и ели с закрытой корневой системой
Влияние сроков посева на рост и развитие сеянцев сосны и ели с закрытой корневой системой Маски из продуктов питания. Маска для подтяжки кожи лица
Маски из продуктов питания. Маска для подтяжки кожи лица Амурский тигр
Амурский тигр Брюхоногие моллюски ампуллярии
Брюхоногие моллюски ампуллярии Реализация методики рефлексивного обучения на уроках
Реализация методики рефлексивного обучения на уроках Строение цветка
Строение цветка Cellular neurophysiology
Cellular neurophysiology Лекарственные растения
Лекарственные растения Витамины. Действие на организм
Витамины. Действие на организм Поверхностный аппарат клеток
Поверхностный аппарат клеток Структурно-функциональные особенности биокатализа
Структурно-функциональные особенности биокатализа Экологические сообщества. Экосистема, биогеоценоз
Экологические сообщества. Экосистема, биогеоценоз Углеводы: строение и функции.
Углеводы: строение и функции. Скелет головы
Скелет головы Углеводы, липиды
Углеводы, липиды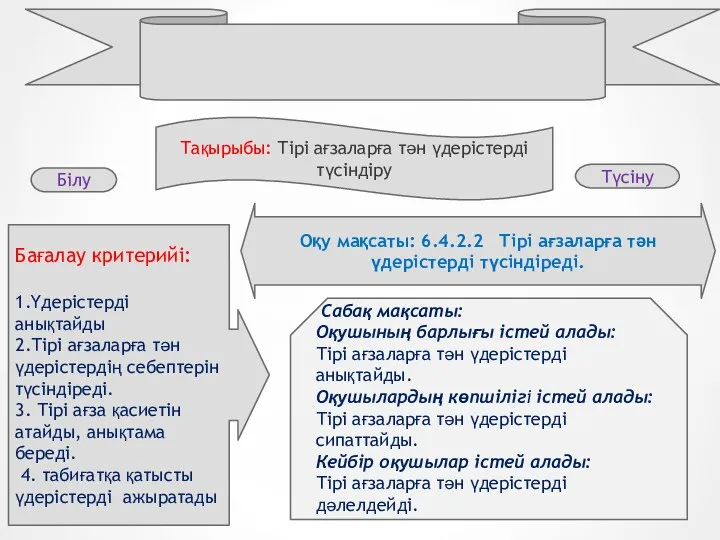 Тірі ағзаларға тән үдерістерді түсіндіру
Тірі ағзаларға тән үдерістерді түсіндіру Краткосрочный проект в старшей группе Перелетные птицы осенью
Краткосрочный проект в старшей группе Перелетные птицы осенью Половозрелая форма сосальщика. Медицинская гельминтология
Половозрелая форма сосальщика. Медицинская гельминтология Презентация по теме Витамины
Презентация по теме Витамины Ферменты – 1
Ферменты – 1 Нетрадиционное наследование
Нетрадиционное наследование Обмен веществ и энергией
Обмен веществ и энергией