Содержание
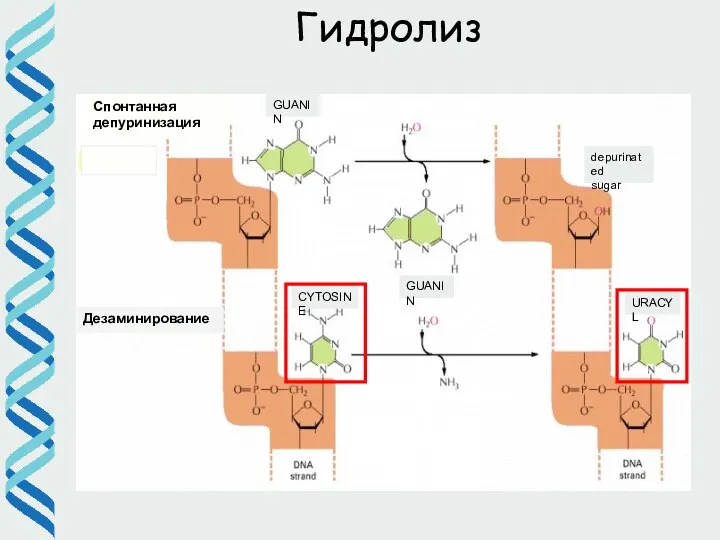
- 2. Причины появления повреждений в ДНК • Ошибки репликации • Повреждения ДНК эндогенными агентами гидролиз (депуринизация, дезаминирование)
- 3. Типы повреждений ДНК На уровне одного нуклеотида • Отсутствие основания • Некомплементарное основание • Основание с
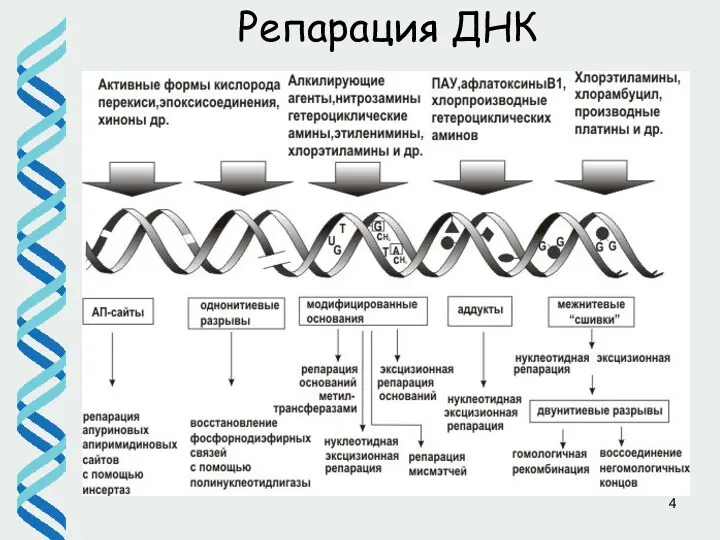
- 4. Репарация ДНК
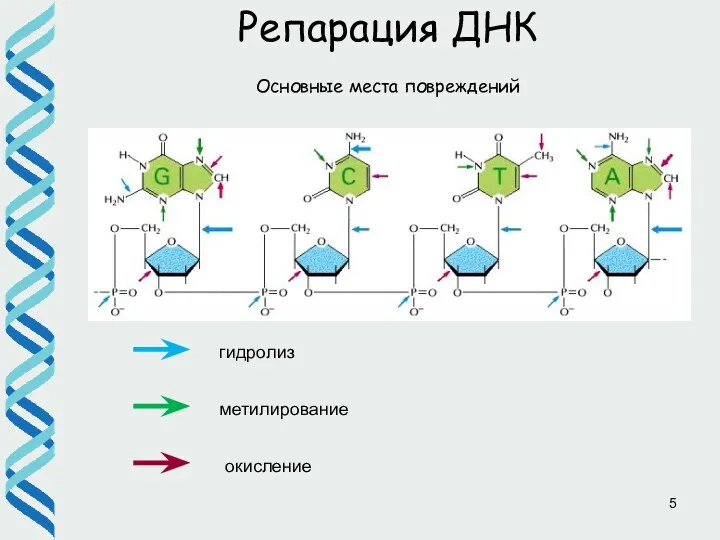
- 5. Репарация ДНК гидролиз метилирование окисление Основные места повреждений
- 6. Гидролиз
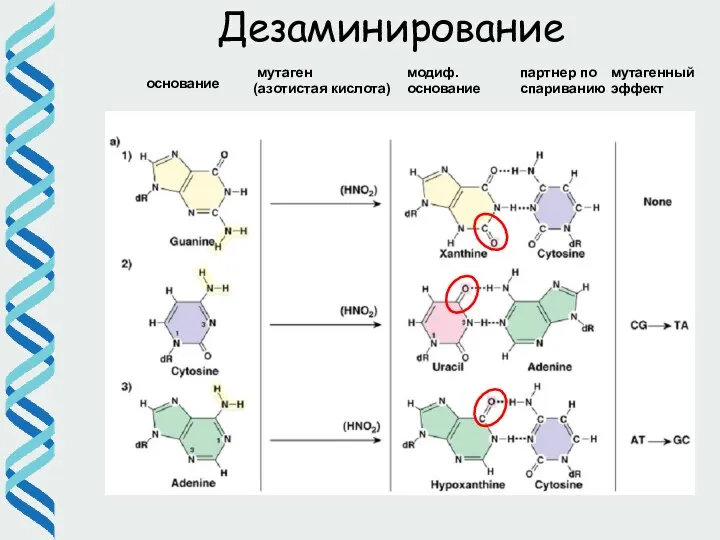
- 7. Дезаминирование основание мутаген (азотистая кислота) модиф. основание партнер по спариванию мутагенный эффект
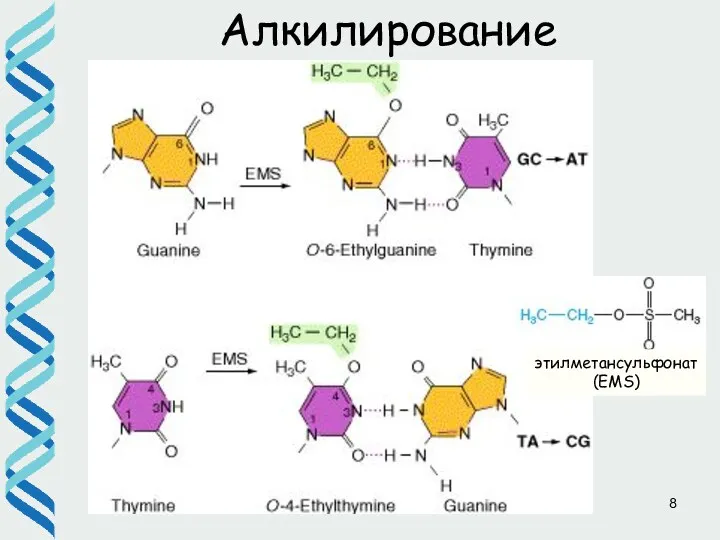
- 8. Алкилирование этилметансульфонат (EMS)
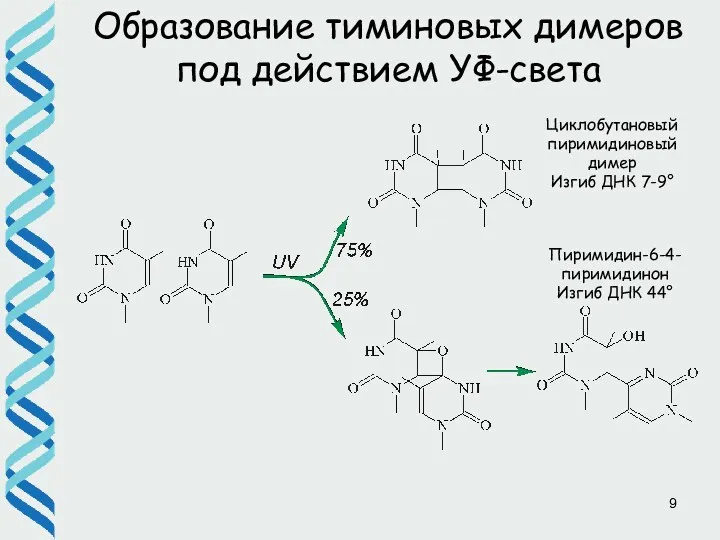
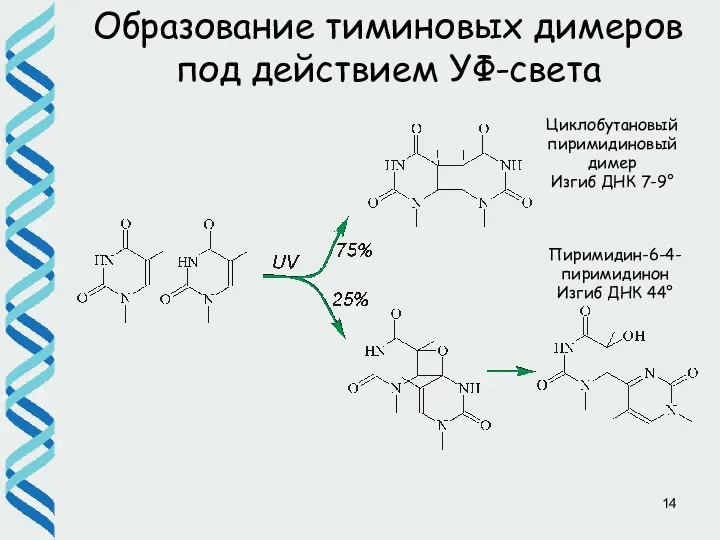
- 9. Образование тиминовых димеров под действием УФ-света Циклобутановый пиримидиновый димер Изгиб ДНК 7-9° Пиримидин-6-4-пиримидинон Изгиб ДНК 44°
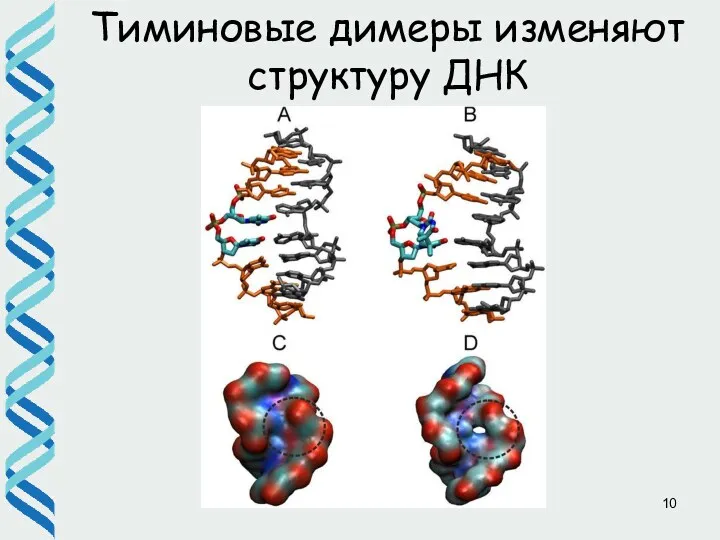
- 10. Тиминовые димеры изменяют структуру ДНК
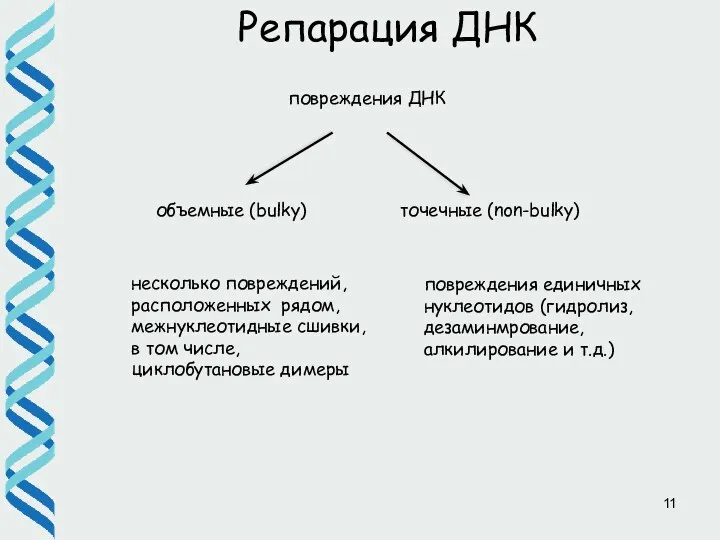
- 11. Репарация ДНК несколько повреждений, расположенных рядом, межнуклеотидные сшивки, в том числе, циклобутановые димеры повреждения единичных нуклеотидов
- 12. Репарация ДНК Стратегии коррекции повреждений Ошибки репликации: исправление ошибок ДНК полимеразой (3’-5’ экзонуклеаза), репарация неспареных оснований
- 13. Репарация ДНК Прямое исправление повреждений (Direct reversal) (2 и >) 2. Эксцизионная репарация оснований (Base excision
- 14. Образование тиминовых димеров под действием УФ-света Циклобутановый пиримидиновый димер Изгиб ДНК 7-9° Пиримидин-6-4-пиримидинон Изгиб ДНК 44°
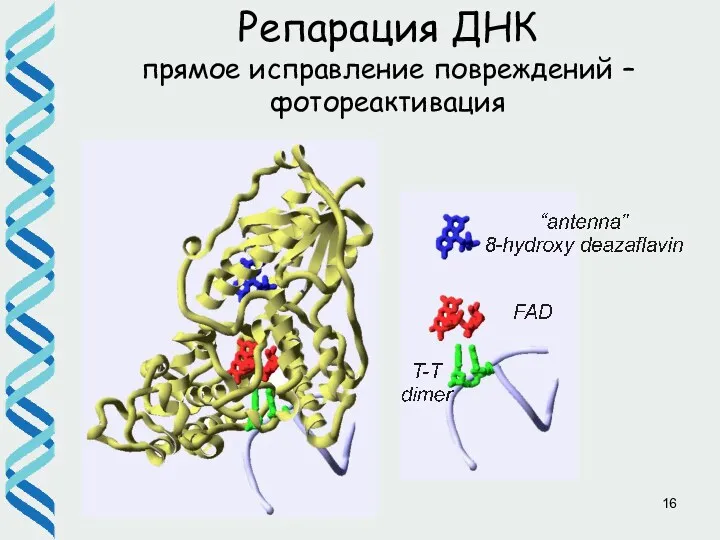
- 15. Репарация ДНК прямое исправление повреждений – фотореактивация ДНК-фотолиазы, мономерные флавин-зависимый ферменты Кофакторы : FADH- и 5,10-метенилтетрагидрофолат
- 16. Репарация ДНК прямое исправление повреждений – фотореактивация
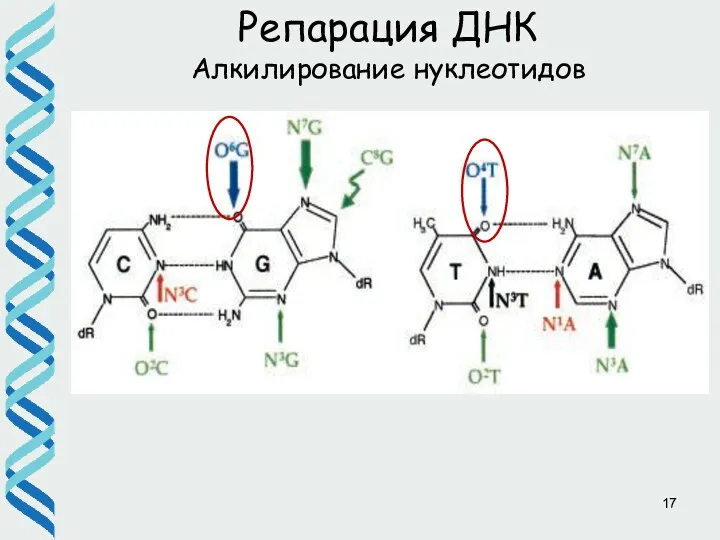
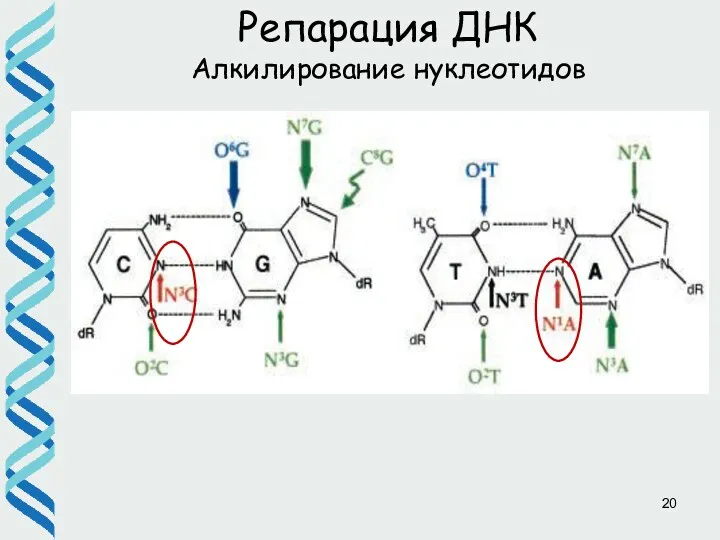
- 17. Репарация ДНК Алкилирование нуклеотидов
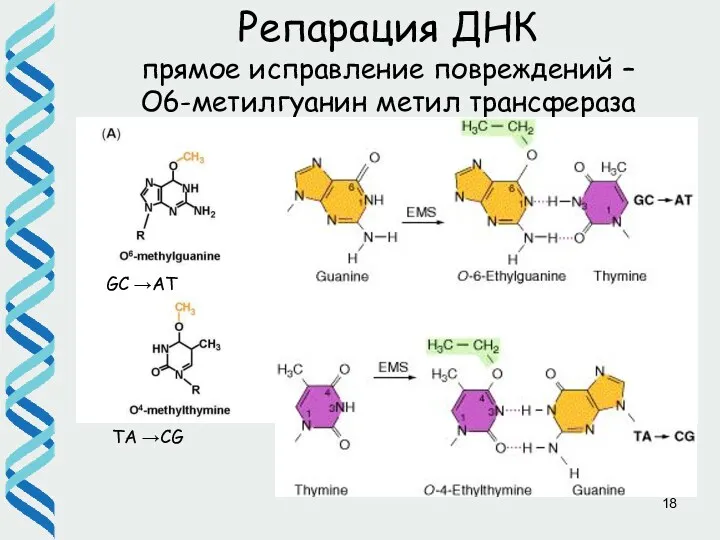
- 18. SN2 mechanism TA →CG GC →AT Репарация ДНК прямое исправление повреждений – О6-метилгуанин метил трансфераза Ada
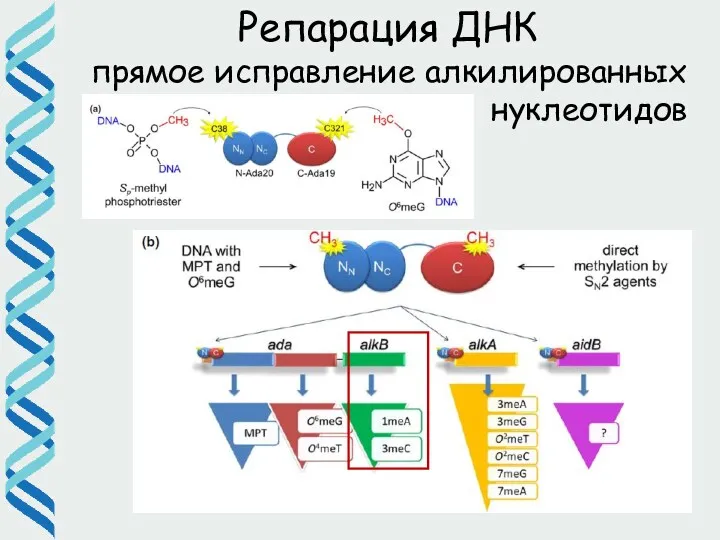
- 19. Репарация ДНК прямое исправление алкилированных нуклеотидов
- 20. Репарация ДНК Алкилирование нуклеотидов
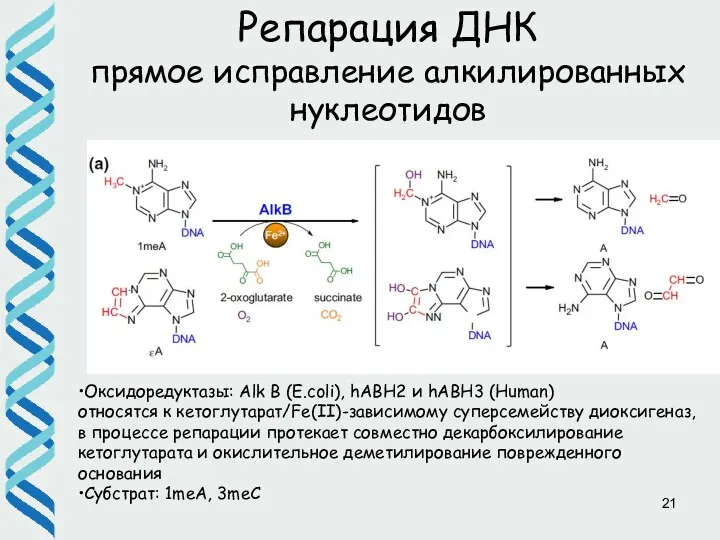
- 21. Репарация ДНК прямое исправление алкилированных нуклеотидов •Оксидоредуктазы: Alk B (E.coli), hABH2 и hABH3 (Human) относятся к
- 22. Репарация ДНК прямое исправление алкилированных нуклеотидов
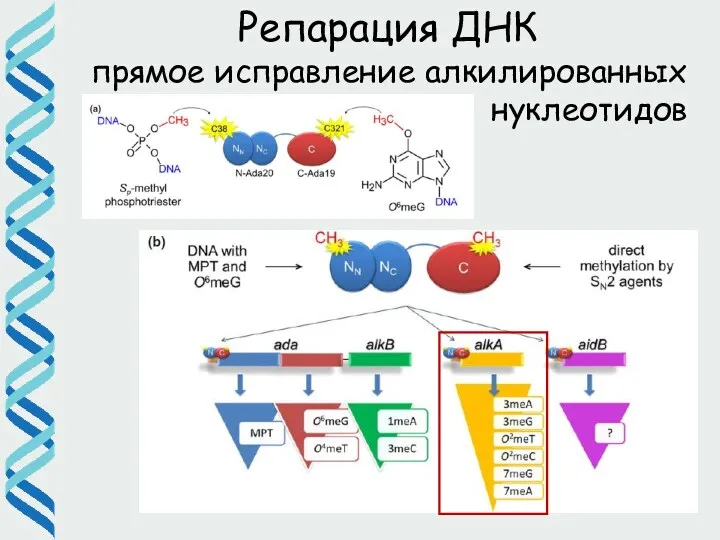
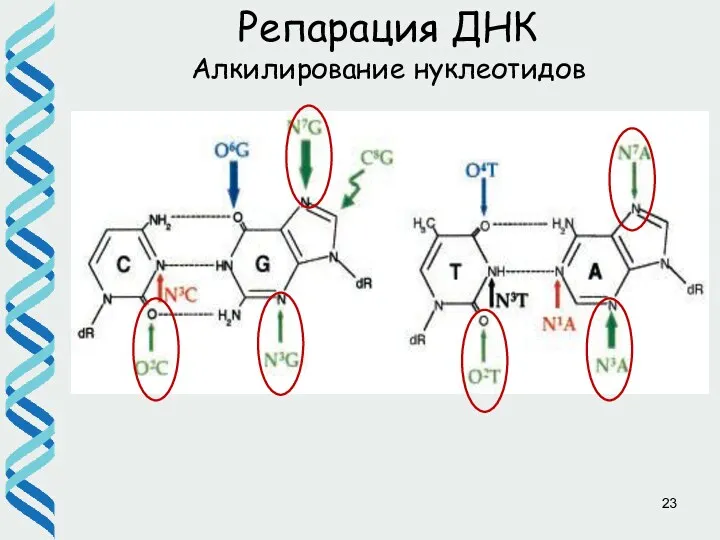
- 23. Репарация ДНК Алкилирование нуклеотидов
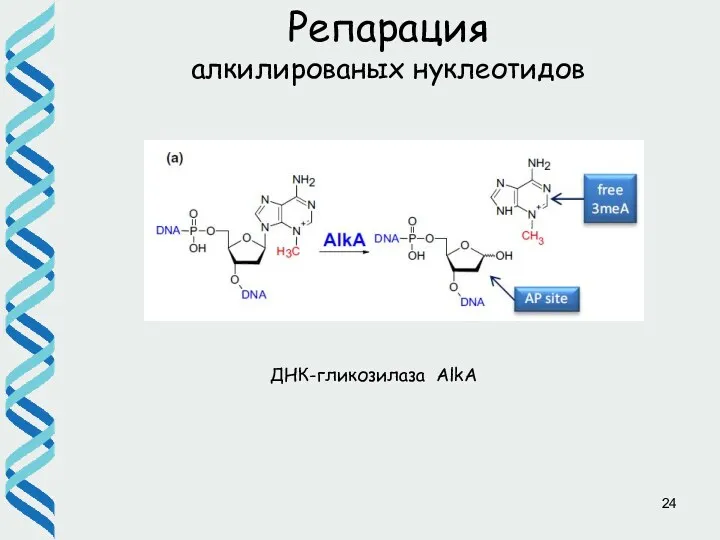
- 24. ДНК-гликозилаза AlkA Репарация алкилированых нуклеотидов
- 25. Репарация ДНК Прямое исправление повреждений (Direct reversal) (2 и >) 2. Эксцизионная репарация оснований (Base excision
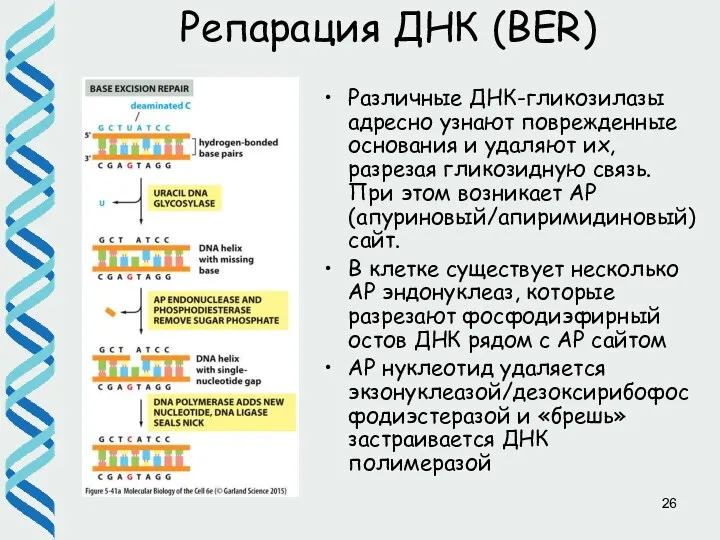
- 26. Репарация ДНК (BER) Различные ДНК-гликозилазы адресно узнают поврежденные основания и удаляют их, разрезая гликозидную связь. При
- 27. ДНК гликозилазы «выворачивают» модифицированное основание наружу и отщепляют его от сахарофосфатного остова Репарация ДНК
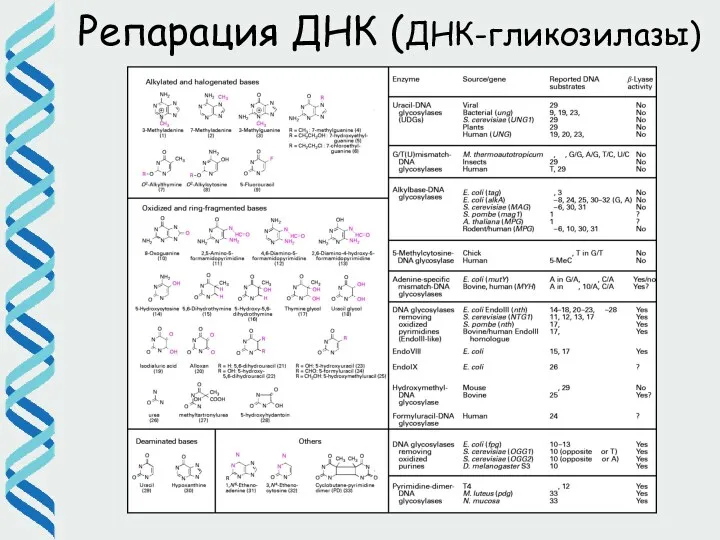
- 28. Репарация ДНК (ДНК-гликозилазы)
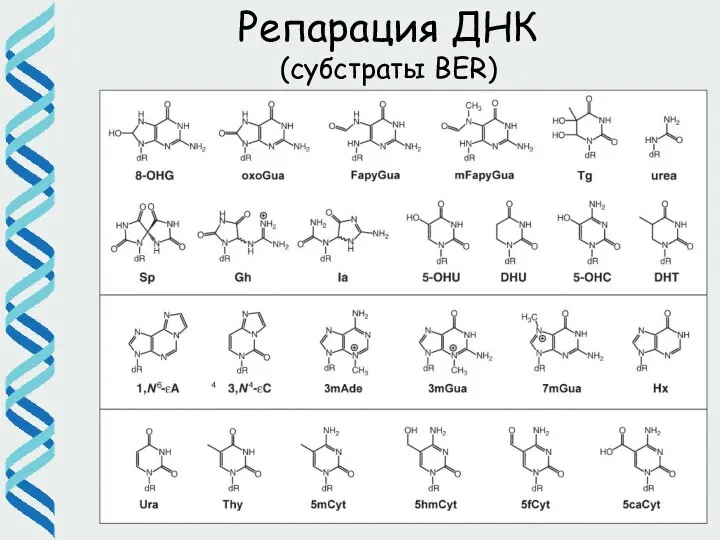
- 29. Основные типы повреждений, которые удаляются посредством BER (большая часть не блокирует репликацию) Окисленные основания, в том
- 30. Репарация ДНК (субстраты BER)
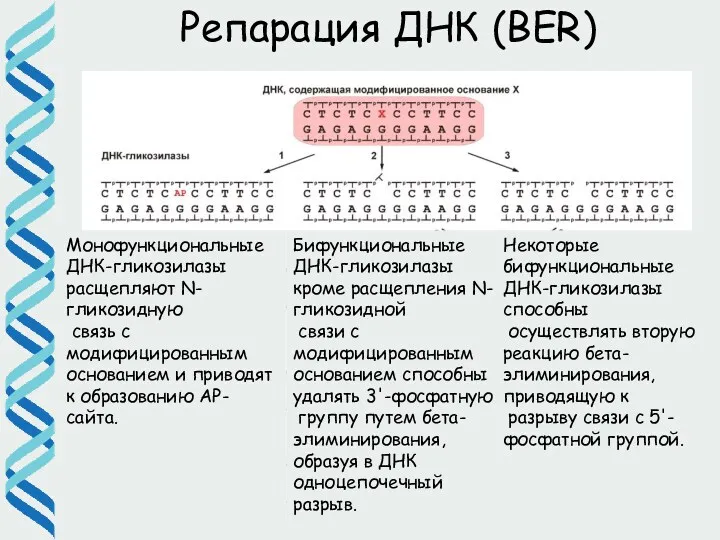
- 31. Репарация ДНК (BER) Монофункциональные ДНК-гликозилазы расщепляют N-гликозидную связь с модифицированным основанием и приводят к образованию АР-сайта.
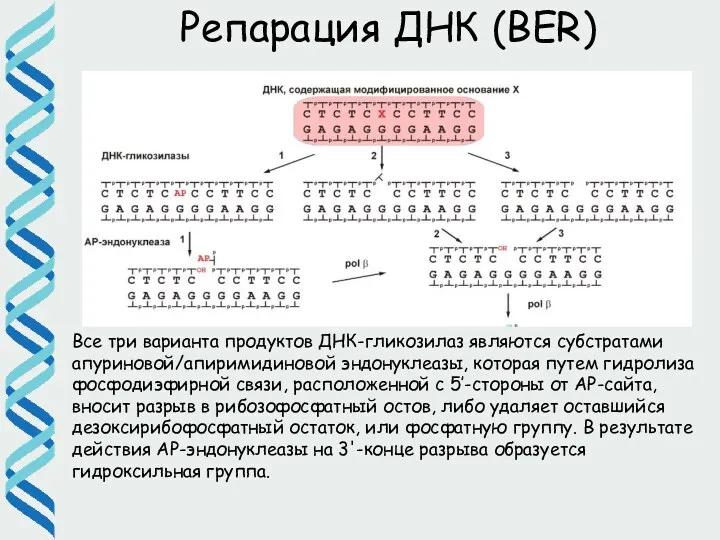
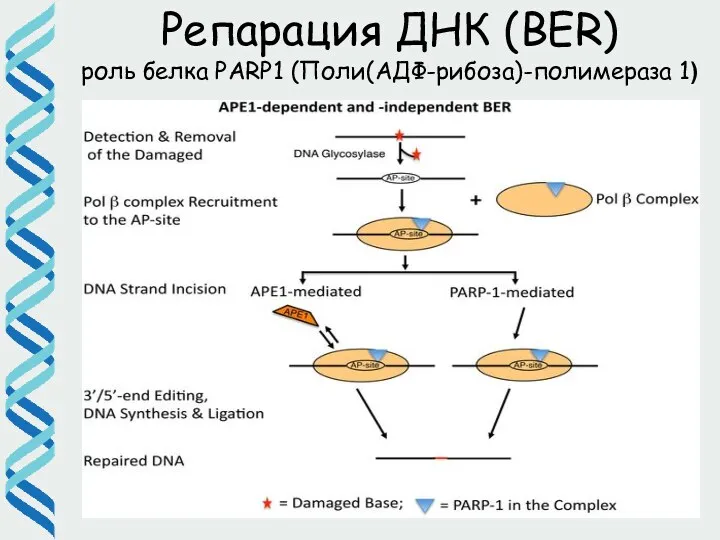
- 32. Репарация ДНК (BER) Все три варианта продуктов ДНК-гликозилаз являются субстратами апуриновой/апиримидиновой эндонуклеазы, которая путем гидролиза фосфодиэфирной
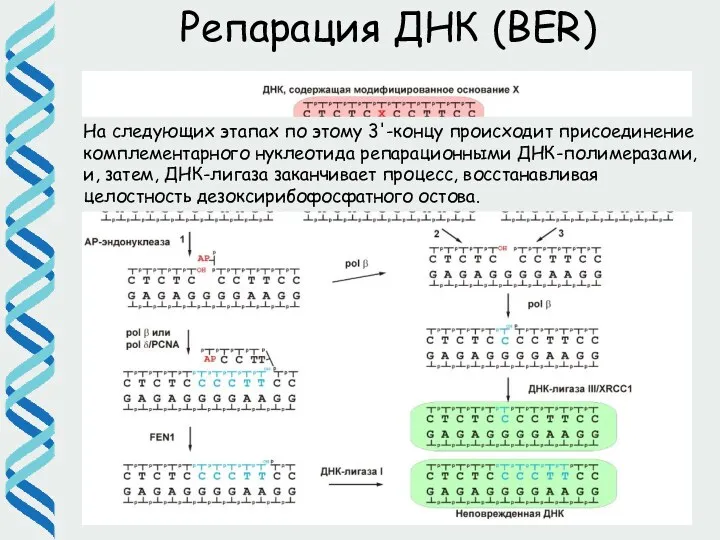
- 33. Репарация ДНК (BER) На следующих этапах по этому 3'-концу происходит присоединение комплементарного нуклеотида репарационными ДНК-полимеразами, и,
- 34. Репарация ДНК (NIR) Некоторые AP эндонуклеазы (например, APE1) могут работать как сенсор повреждений. Помимо AP сайтов
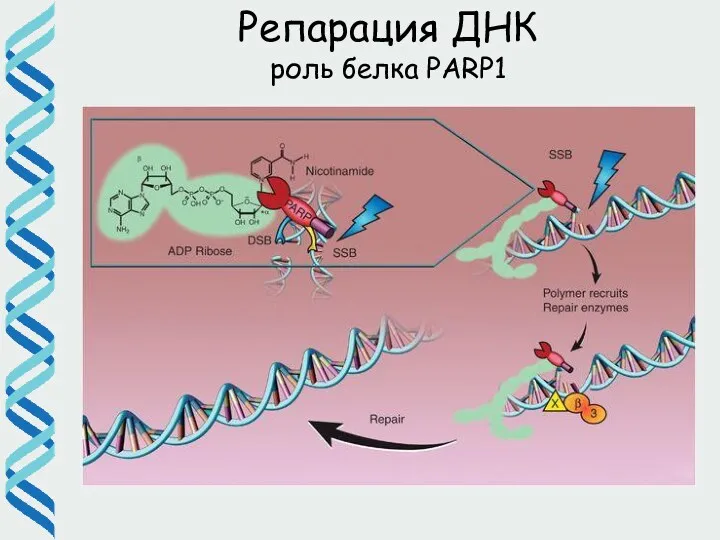
- 35. Репарация ДНК (BER) роль белка PARP1 (Поли(АДФ-рибоза)-полимераза 1)
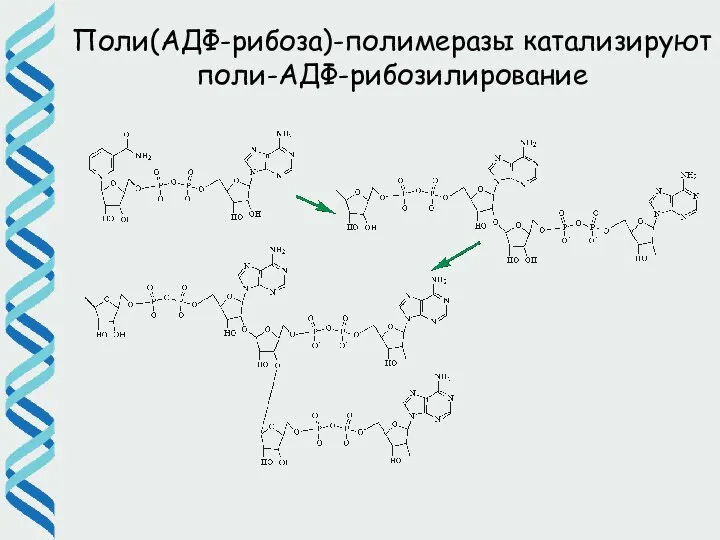
- 36. Поли(АДФ-рибоза)-полимеразы катализируют поли-АДФ-рибозилирование
- 37. Репарация ДНК роль белка PARP1
- 38. Репарация ДНК Прямое исправление повреждений (Direct reversal) (2 и >) 2. Эксцизионная репарация оснований (Base excision
- 39. Репарация ДНК (NER) Используется для коррекции «серьезных» повреждений, которые блокируют репликацию (например, у человека – тиминовые
- 40. Репарация ДНК (NER)
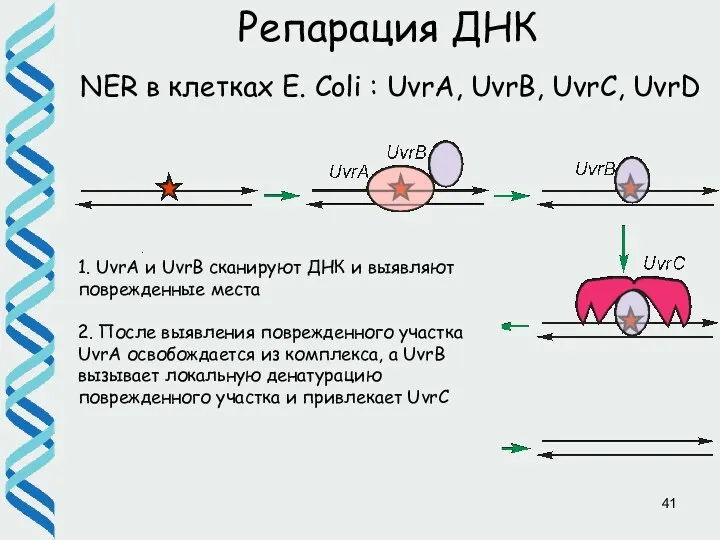
- 41. Репарация ДНК NER в клетках E. Coli : UvrA, UvrB, UvrC, UvrD 1. UvrA и UvrB
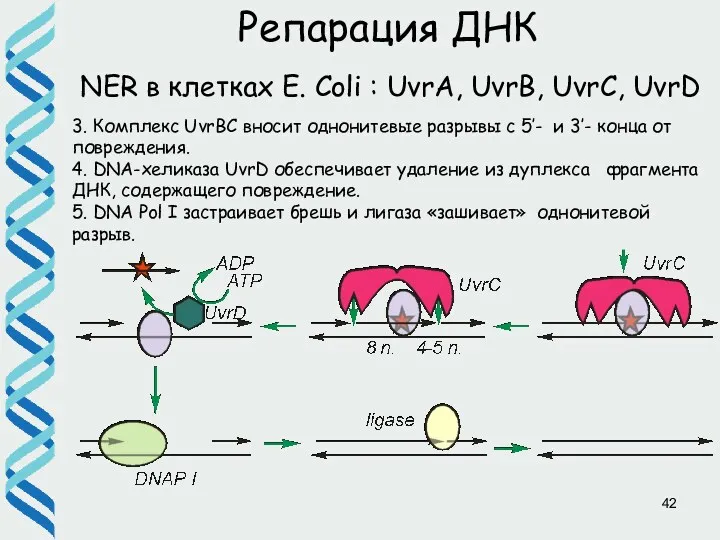
- 42. Репарация ДНК NER в клетках E. Coli : UvrA, UvrB, UvrC, UvrD 3. Комплекс UvrBС вносит
- 43. Репарация ДНК NER в клетках E. Coli : UvrA, UvrB, UvrC, UvrD Практически вся эксцизионная репарация
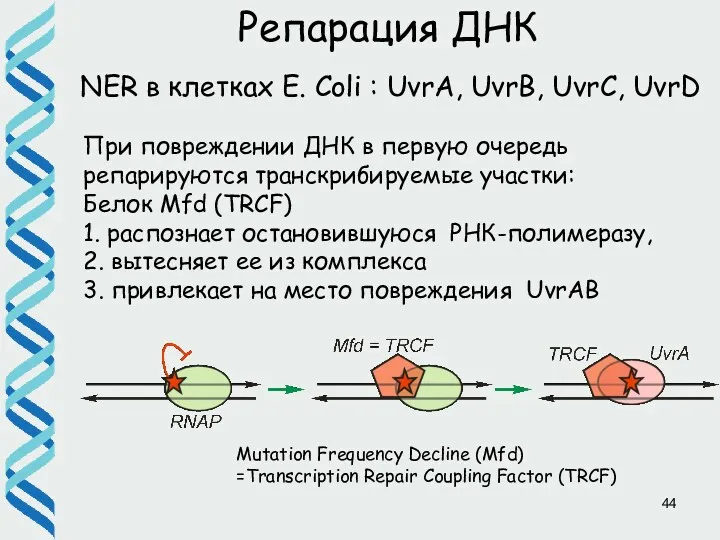
- 44. Репарация ДНК NER в клетках E. Coli : UvrA, UvrB, UvrC, UvrD Mutation Frequency Decline (Mfd)
- 45. Репарация ДНК NER в эукариотических клетках Основной принцип NER в клетках эукариот такой же, как и
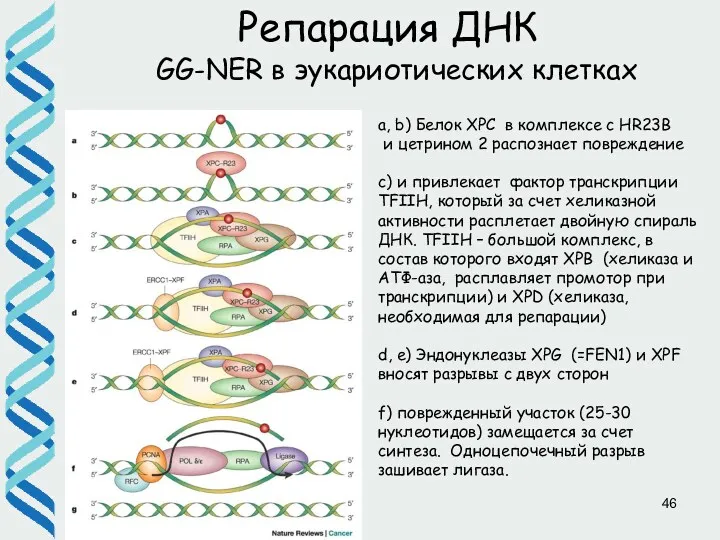
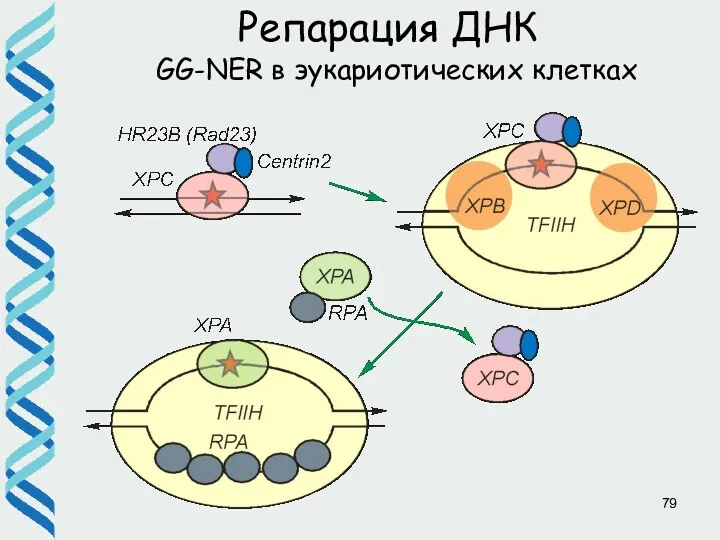
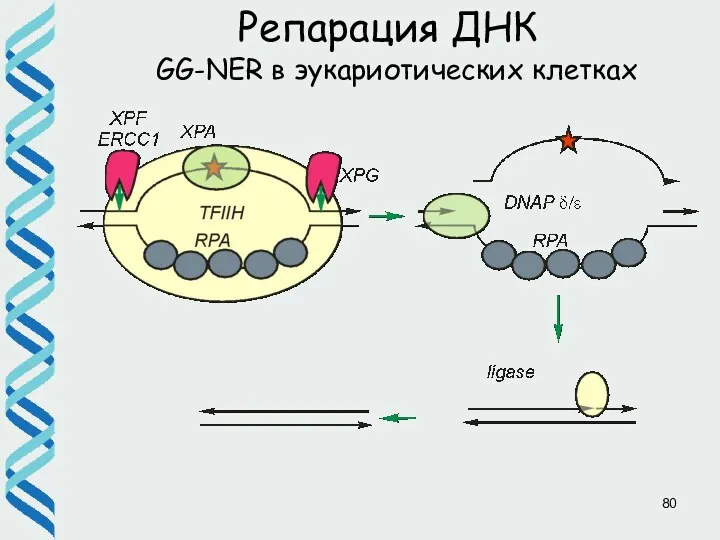
- 46. Репарация ДНК GG-NER в эукариотических клетках a, b) Белок XPC в комплексе c HR23B и цетрином
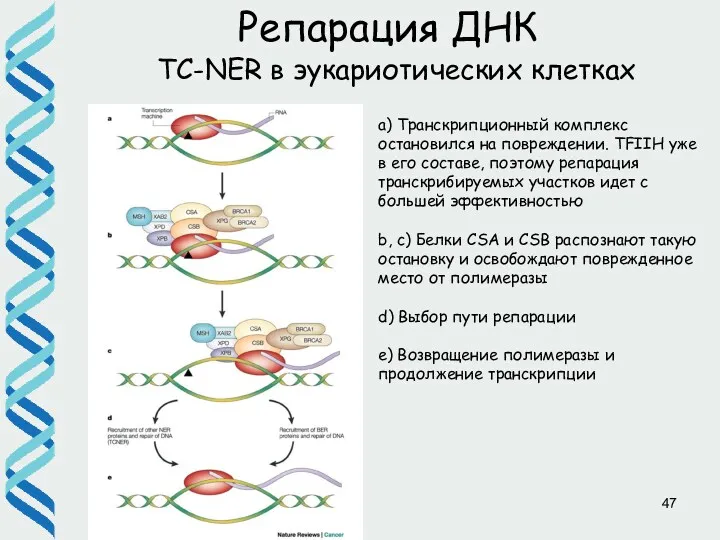
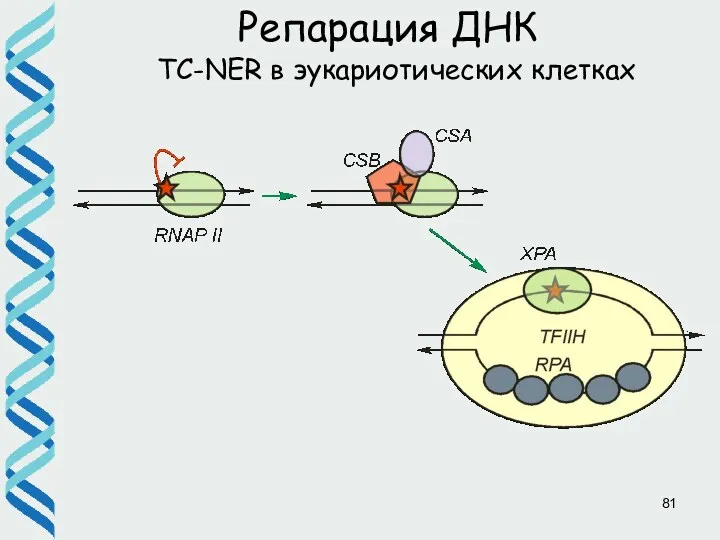
- 47. Репарация ДНК TC-NER в эукариотических клетках a) Транскрипционный комплекс остановился на повреждении. TFIIH уже в его
- 48. Репарация ДНК Прямое исправление повреждений (Direct reversal) (2 и >) 2. Эксцизионная репарация оснований (Base excision
- 49. Репарация ДНК (MMR) ДНК полимеразы (даже те, у которых есть корректирующая активность) все равно делают ошибки,
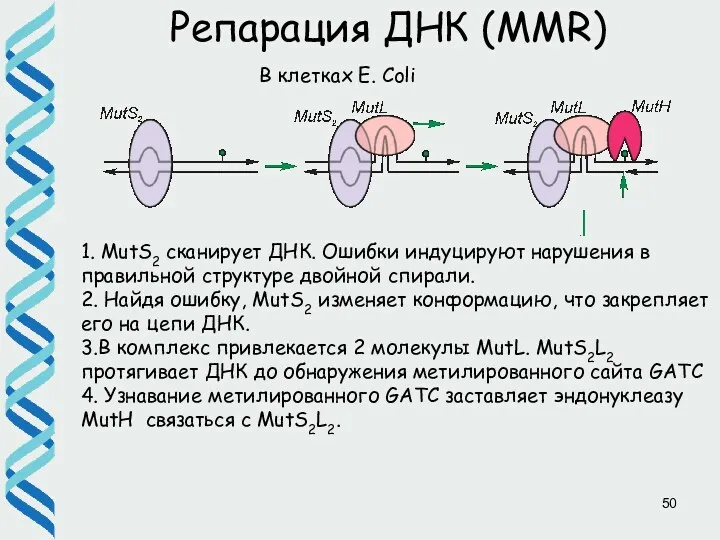
- 50. Репарация ДНК (MMR) 1. MutS2 сканирует ДНК. Ошибки индуцируют нарушения в правильной структуре двойной спирали. 2.
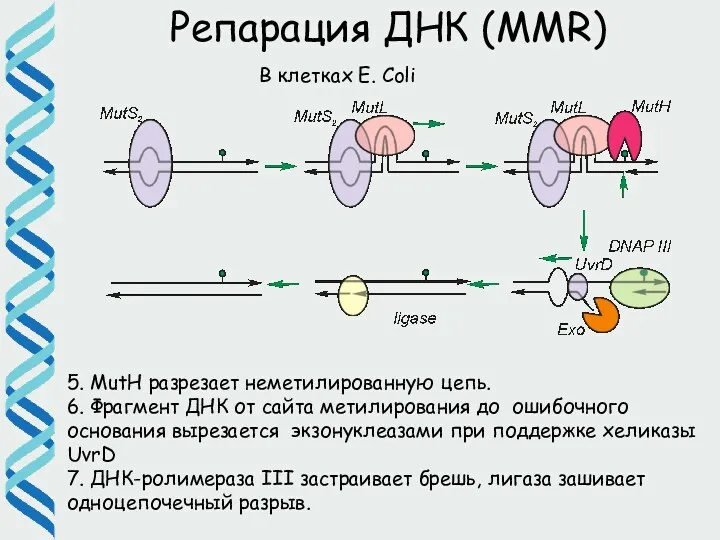
- 51. Репарация ДНК (MMR) 5. MutH разрезает неметилированную цепь. 6. Фрагмент ДНК от сайта метилирования до ошибочного
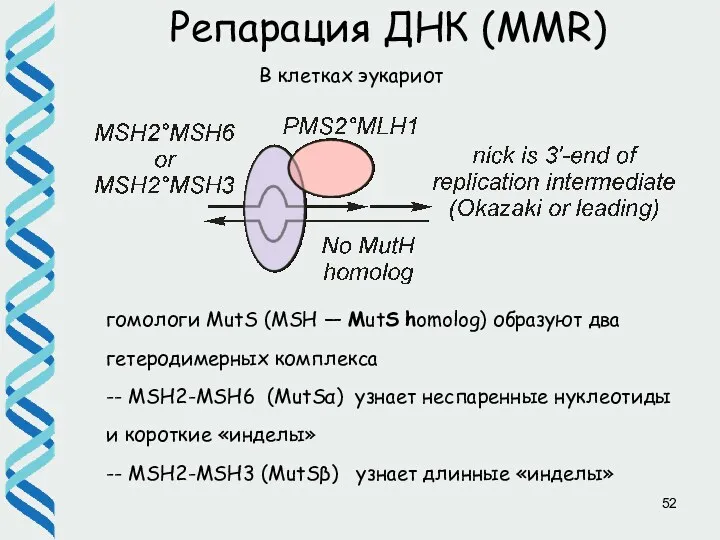
- 52. Репарация ДНК (MMR) В клетках эукариот гомологи MutS (MSH — MutS homolog) образуют два гетеродимерных комплекса
- 53. Репарация ДНК (MMR) Эксперименты по связыванию с ДНК in vitro и репарации гетеродуплексов in vivo показали,
- 54. Репарация ДНК Прямое исправление повреждений (Direct reversal) (2 и >) 2. Эксцизионная репарация оснований (Base excision
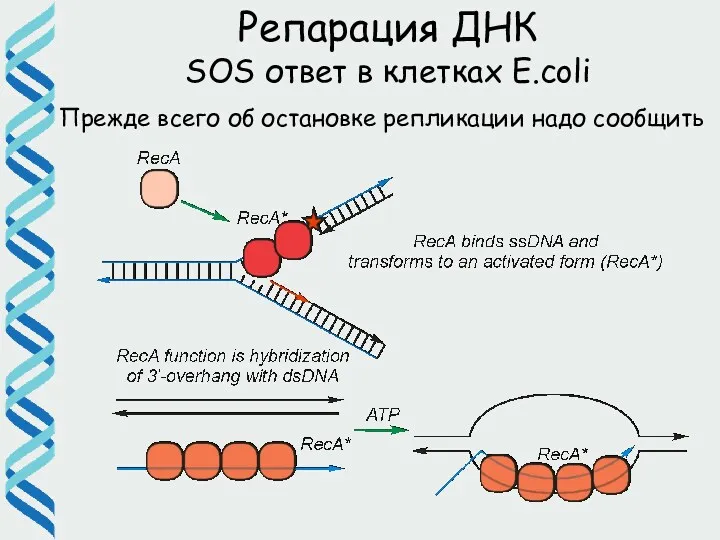
- 55. Прежде всего об остановке репликации надо сообщить Rec A Связывается с однонитевой ДНК и образует ДНК-белковые
- 56. Прежде всего об остановке репликации надо сообщить Репарация ДНК SOS ответ в клетках E.coli
- 57. Репарация ДНК SOS ответ в клетках E.coli Активированный RecA* разрезает LexA
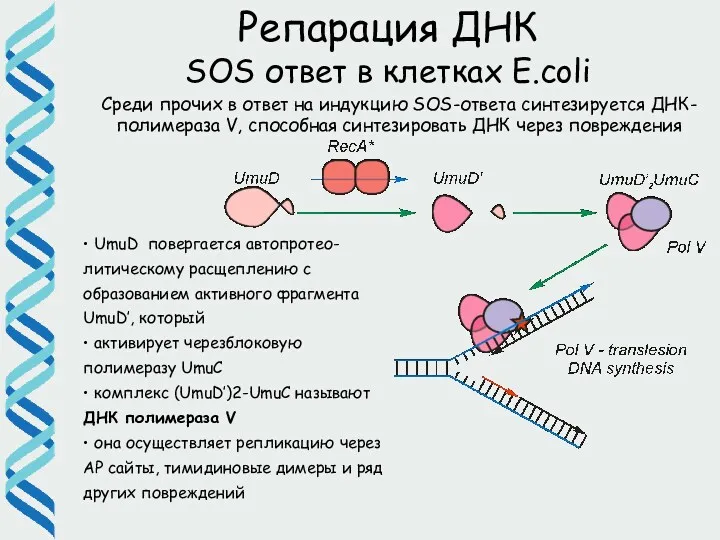
- 58. Репарация ДНК SOS ответ в клетках E.coli Среди прочих в ответ на индукцию SOS-ответа синтезируется ДНК-полимераза
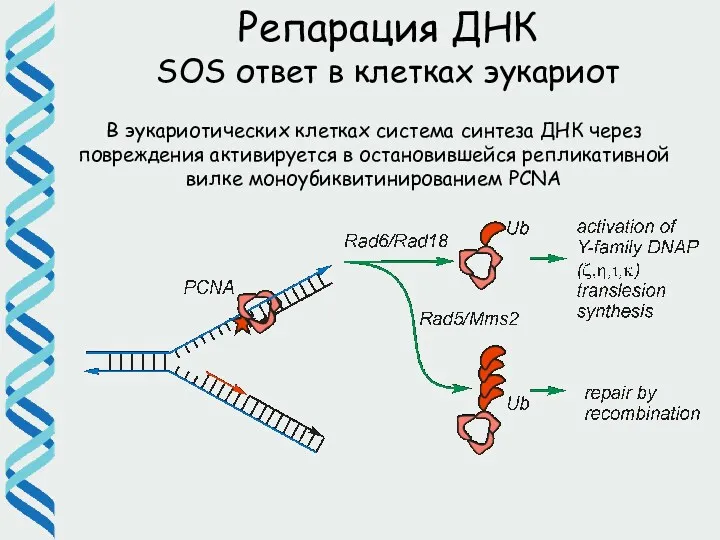
- 59. Репарация ДНК SOS ответ в клетках эукариот В эукариотических клетках система синтеза ДНК через повреждения активируется
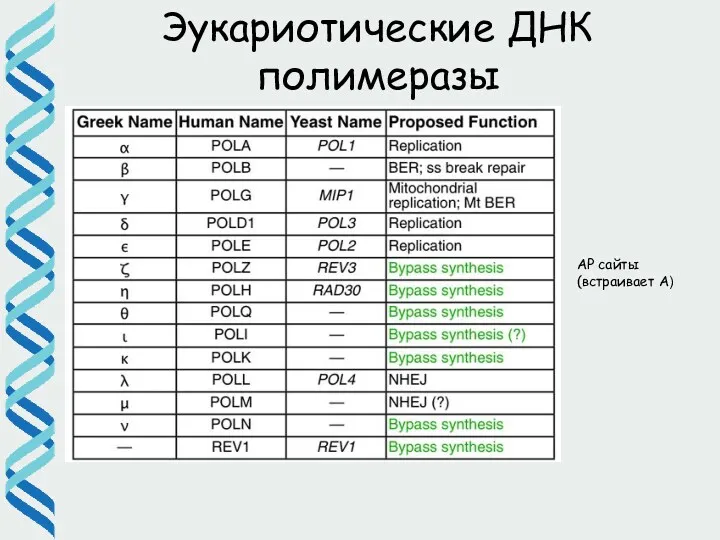
- 60. АР сайты (встраивает А) Эукариотические ДНК полимеразы
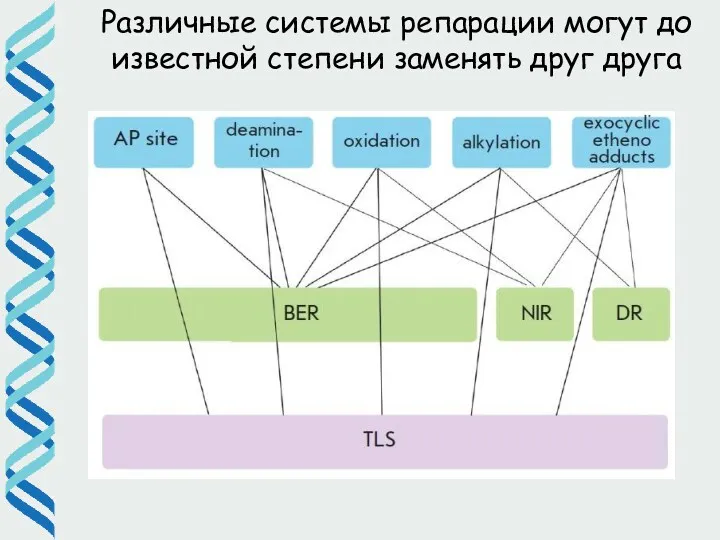
- 61. Различные системы репарации могут до известной степени заменять друг друга
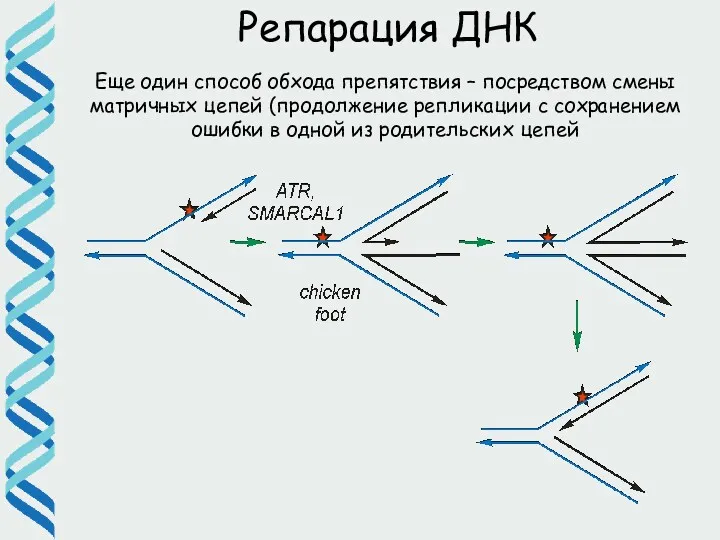
- 62. Репарация ДНК Еще один способ обхода препятствия – посредством смены матричных цепей (продолжение репликации с сохранением
- 63. Репарация ДНК Прямое исправление повреждений (Direct reversal) (2 и >) 2. Эксцизионная репарация оснований (Base excision
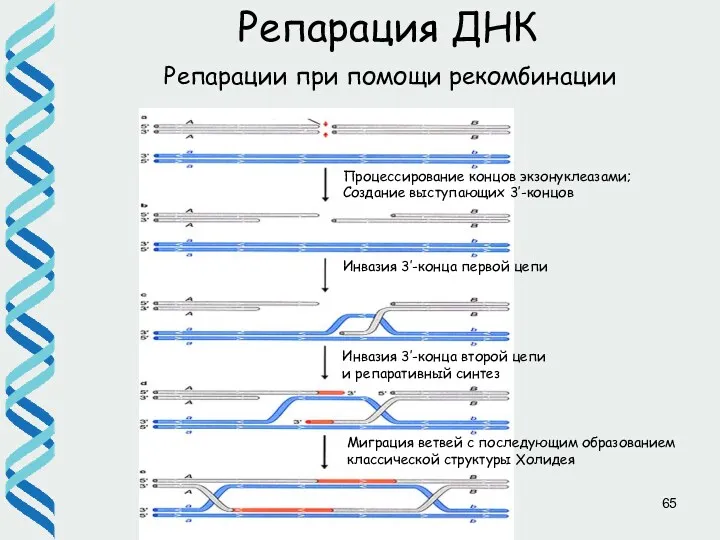
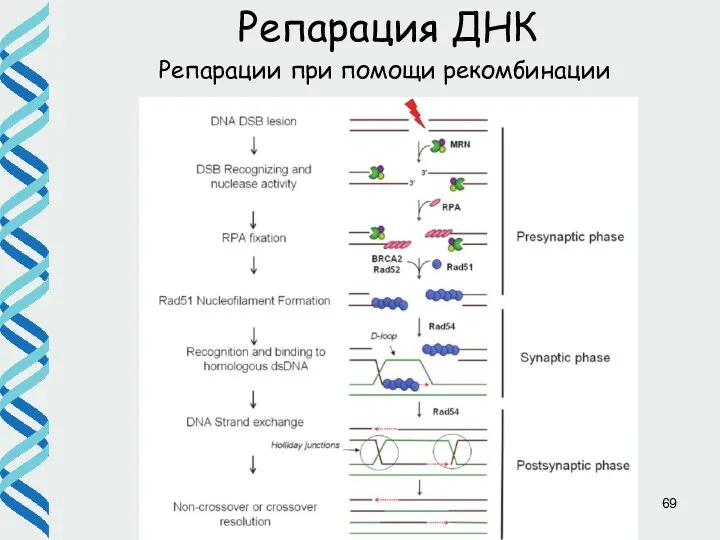
- 64. Репарации при помощи рекомбинации Репарация ДНК Для репарации двунитевых разрывов с использованием системы гомологичной рекомбинации необходимы
- 65. Репарация ДНК Репарации при помощи рекомбинации
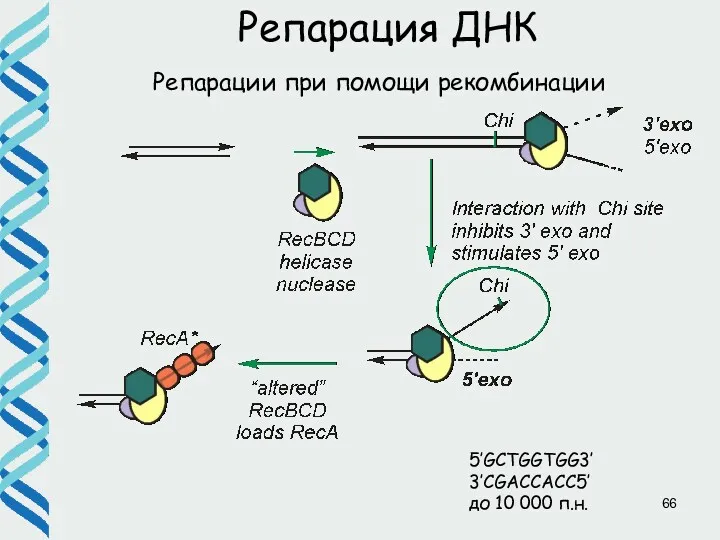
- 66. Репарации при помощи рекомбинации Репарация ДНК 5’GCTGGTGG3’ 3’CGACCACC5’ до 10 000 п.н.
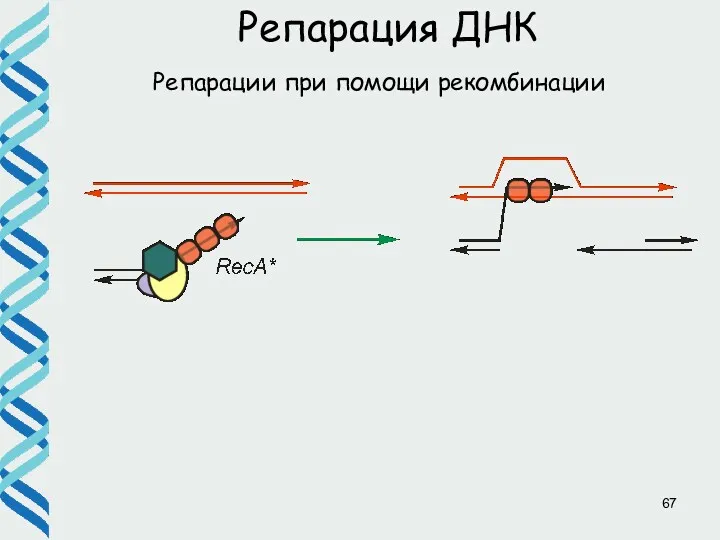
- 67. Репарации при помощи рекомбинации Репарация ДНК
- 68. Репарации при помощи рекомбинации Репарация ДНК
- 69. Репарации при помощи рекомбинации Репарация ДНК
- 70. Репарация ДНК Прямое исправление повреждений (Direct reversal) (2 и >) 2. Эксцизионная репарация оснований (Base excision
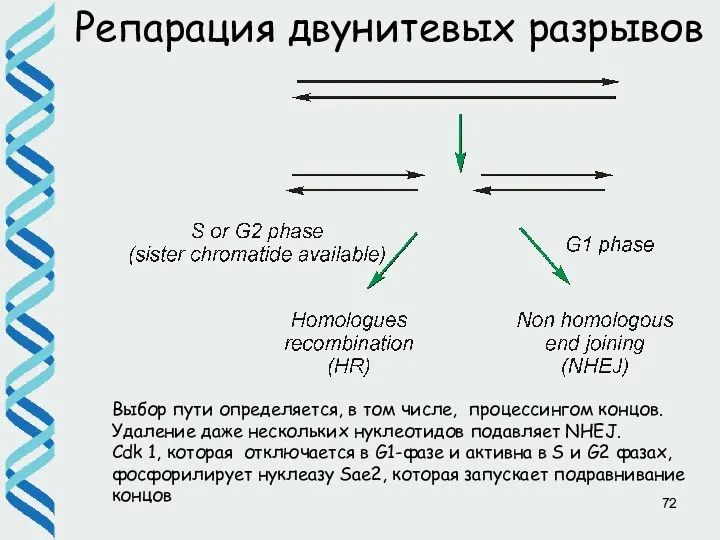
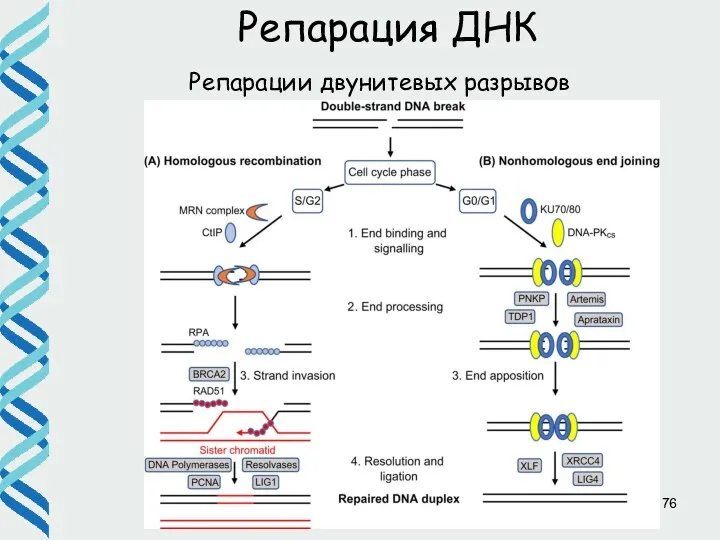
- 71. Репарация двунитевых разрывов Существует два основных пути репарации двунитевых разрывов: • гомологичная рекомбинация • негомологичное соединение
- 72. Репарация двунитевых разрывов Выбор пути определяется, в том числе, процессингом концов. Удаление даже нескольких нуклеотидов подавляет
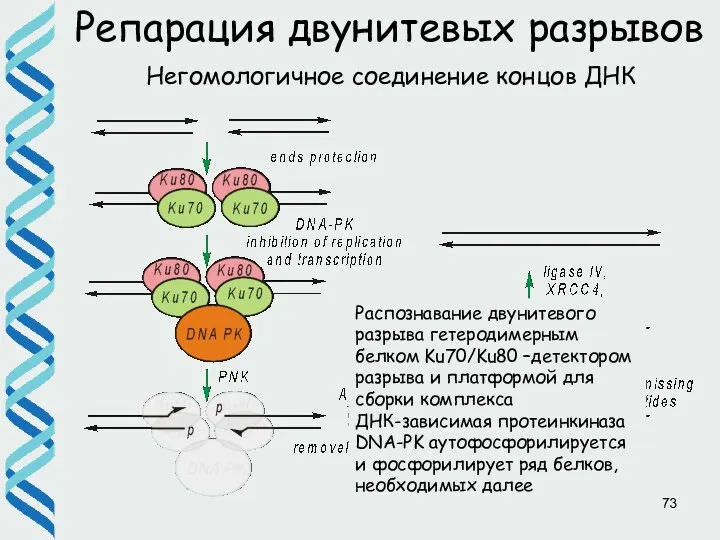
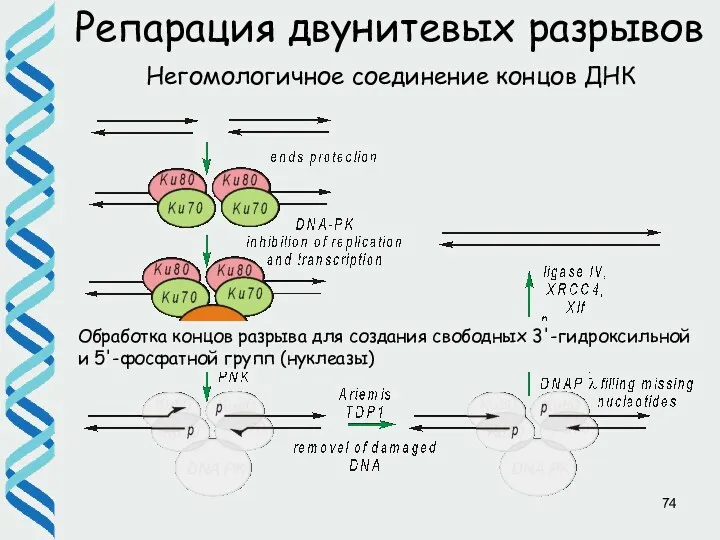
- 73. Репарация двунитевых разрывов Негомологичное соединение концов ДНК Распознавание двунитевого разрыва гетеродимерным белком Ku70/Ku80 –детектором разрыва и
- 74. Репарация двунитевых разрывов Негомологичное соединение концов ДНК Обработка концов разрыва для создания свободных 3'-гидроксильной и 5'-фосфатной
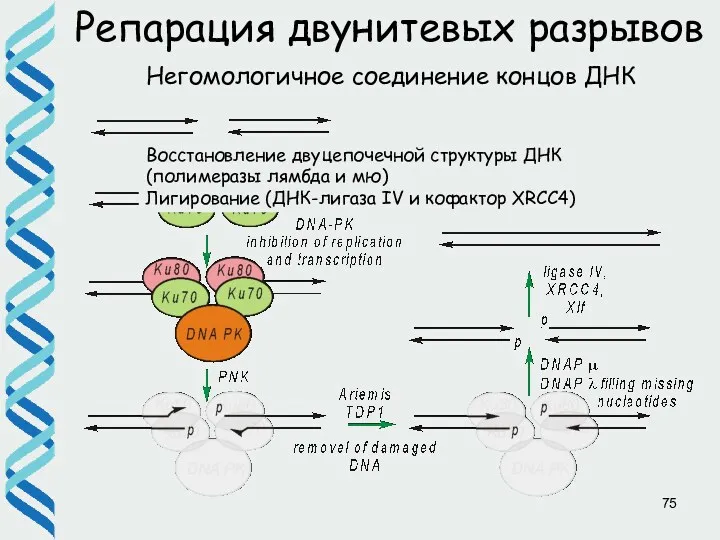
- 75. Репарация двунитевых разрывов Негомологичное соединение концов ДНК Восстановление двуцепочечной структуры ДНК (полимеразы лямбда и мю) Лигирование
- 76. Репарации двунитевых разрывов Репарация ДНК
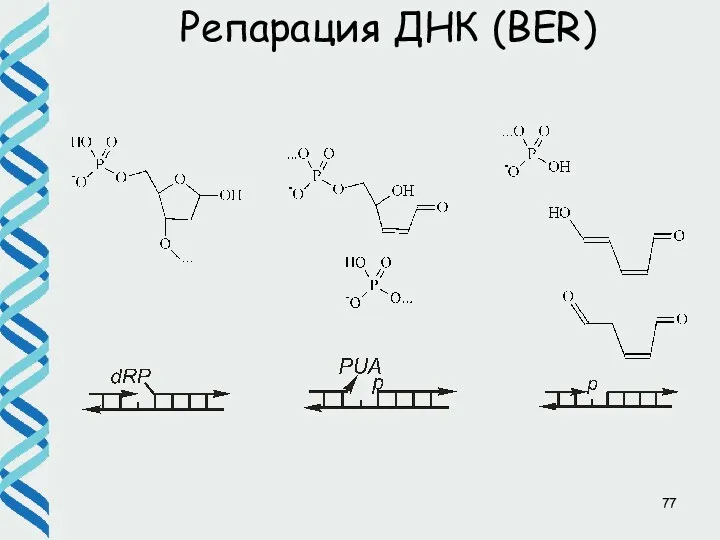
- 77. Репарация ДНК (BER)
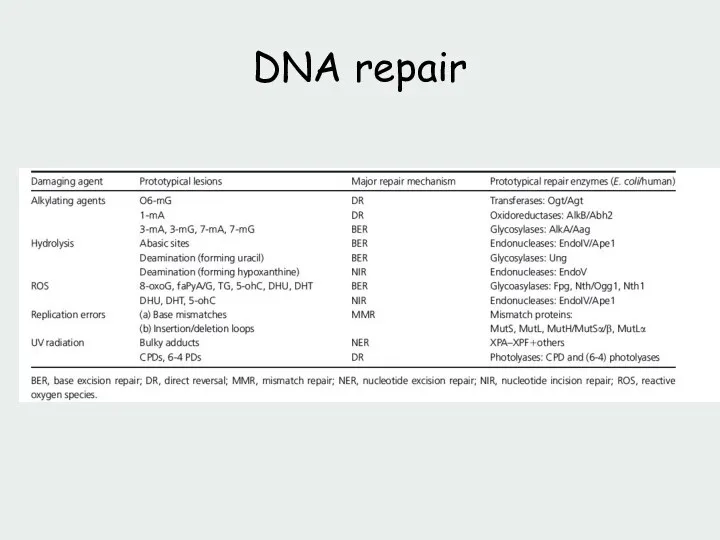
- 78. DNA repair
- 79. Репарация ДНК GG-NER в эукариотических клетках
- 80. Репарация ДНК GG-NER в эукариотических клетках
- 81. Репарация ДНК TC-NER в эукариотических клетках
- 83. Скачать презентацию
























 Основные этапы развития животного мира на Земле
Основные этапы развития животного мира на Земле Картоптың алтын түстес жұмырқұрты
Картоптың алтын түстес жұмырқұрты Биология клетки в культуре. Клеточная и генная инженерия 2
Биология клетки в культуре. Клеточная и генная инженерия 2 Будова тварин. Клітини, тканини
Будова тварин. Клітини, тканини Зимующие птицы (для дошкольников)
Зимующие птицы (для дошкольников) Жасуша және оның құрылысы
Жасуша және оның құрылысы Parts of Human Skeleton
Parts of Human Skeleton Тип Членистоногие
Тип Членистоногие Индивидуальное развитие организмов (онтогенез)
Индивидуальное развитие организмов (онтогенез) Продолговатый мозг и мост
Продолговатый мозг и мост Микроскопические грибы
Микроскопические грибы Біохімія гормонів
Біохімія гормонів Метаболизм сложных белков. (Тема 2)
Метаболизм сложных белков. (Тема 2) Вивчення захворювань і пошкоджень яблук та овочів
Вивчення захворювань і пошкоджень яблук та овочів Перенос веществ в организме беспозвоночных и позвоночных животных
Перенос веществ в организме беспозвоночных и позвоночных животных газообмен в легких
газообмен в легких Тепловые свойства почв
Тепловые свойства почв Гистология – учение о тканях. Классификация тканей
Гистология – учение о тканях. Классификация тканей Торможение условных рефлексов
Торможение условных рефлексов Межвидовая конкуренция
Межвидовая конкуренция Методическая разработка урока биологии по теме Обмен веществ 6 класс
Методическая разработка урока биологии по теме Обмен веществ 6 класс Жизнь организмов в морях и океанах
Жизнь организмов в морях и океанах Фенологические наблюдения за деревом
Фенологические наблюдения за деревом Птицы леса
Птицы леса История развития эволюционных идей
История развития эволюционных идей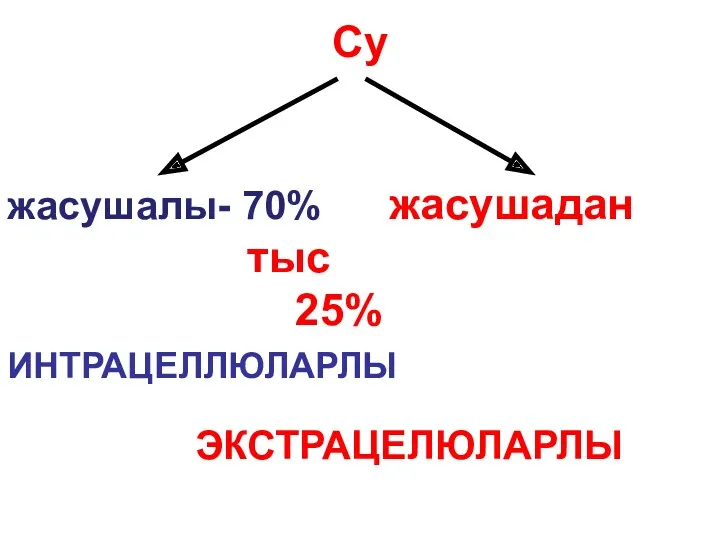 Су табиғаттың ерекше туындысы
Су табиғаттың ерекше туындысы Послепосадочный уход за деревьями и кустарниками
Послепосадочный уход за деревьями и кустарниками МОХОВИДНЫЕ 7 класс
МОХОВИДНЫЕ 7 класс