Содержание
- 3. cdc-гены, сеll division control Реакции обратимого фосфорования: киназы, активируемые циклинами: 2 субъединицы – CDK – каталитическая
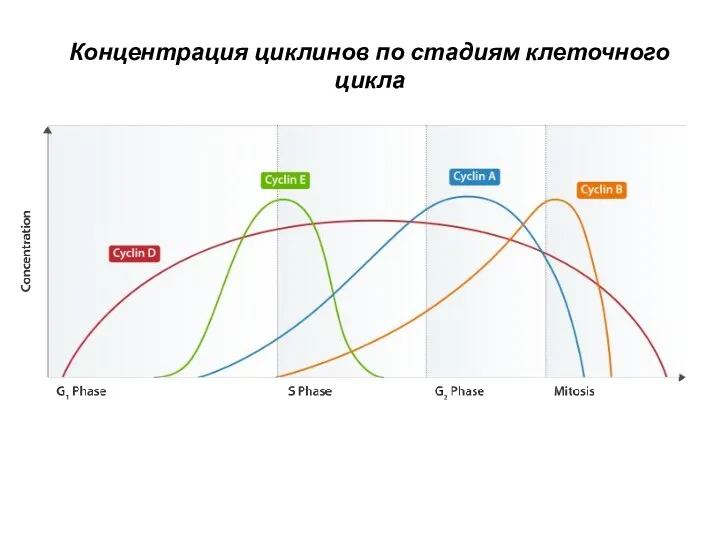
- 4. Концентрация циклинов по стадиям клеточного цикла
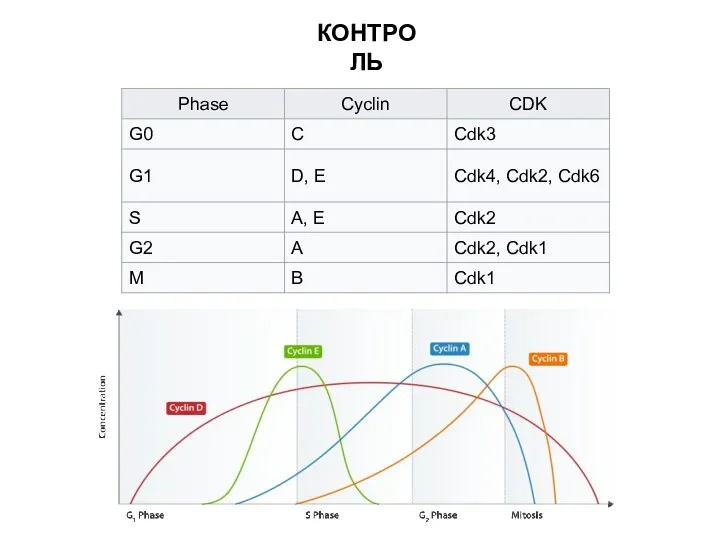
- 5. КОНТРОЛЬ
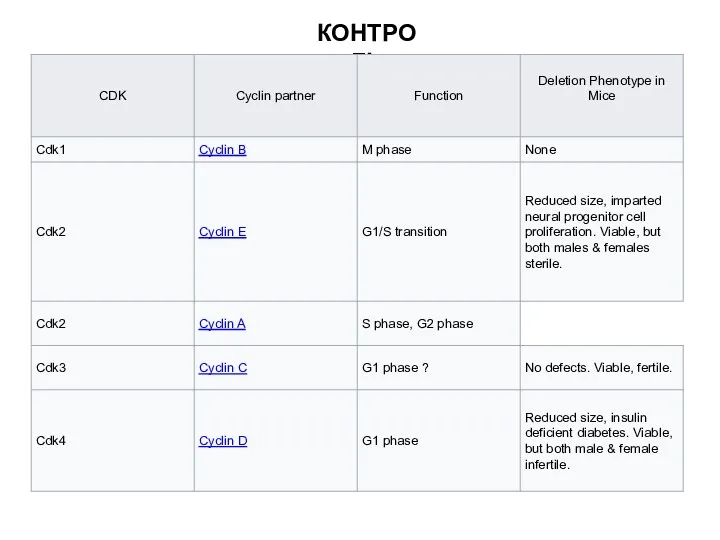
- 6. КОНТРОЛЬ
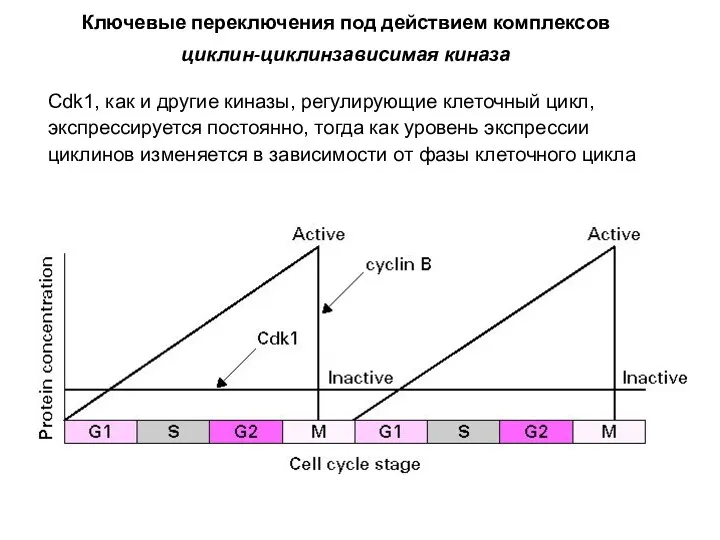
- 7. Cdk1, как и другие киназы, регулирующие клеточный цикл, экспрессируется постоянно, тогда как уровень экспрессии циклинов изменяется
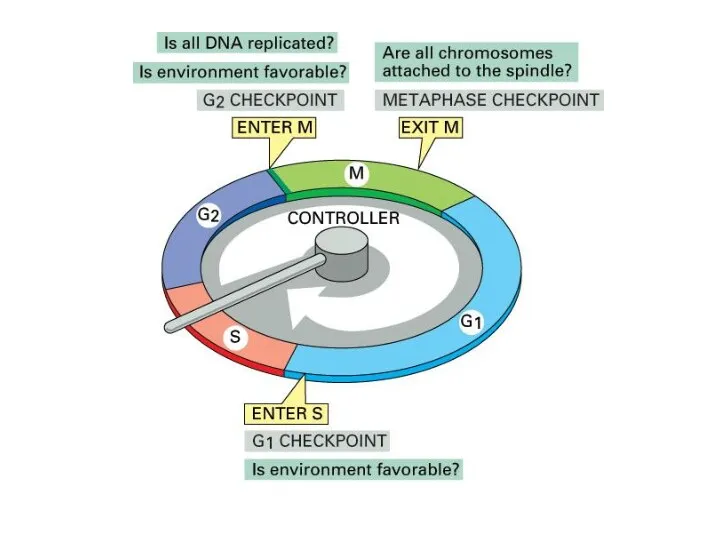
- 8. Фосфорилирование целевых белков “включает или выключает” процесс G1a - R (restriction point) - G1b – CycD/Cdc4,
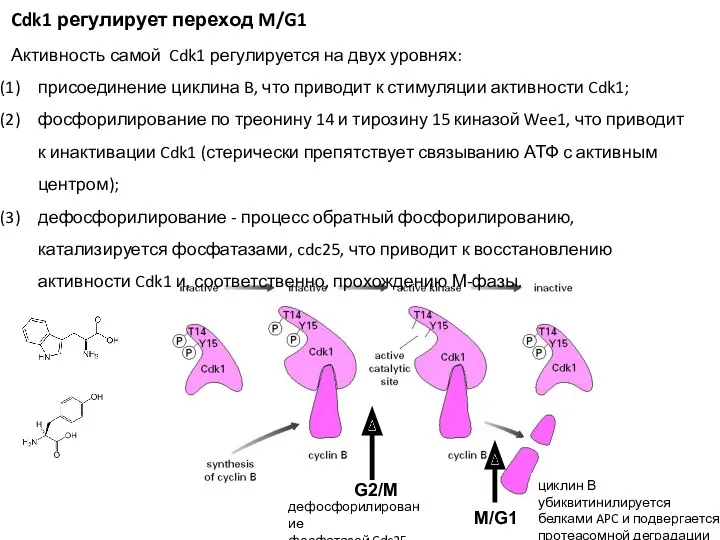
- 9. Cdk1 регулирует переход M/G1 Активность самой Cdk1 регулируется на двух уровнях: присоединение циклина B, что приводит
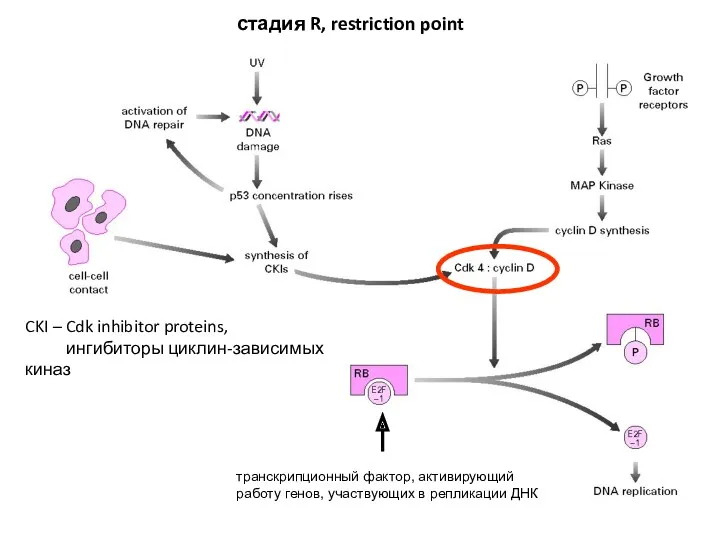
- 10. транскрипционный фактор, активирующий работу генов, участвующих в репликации ДНК стадия R, restriction point CKI – Cdk
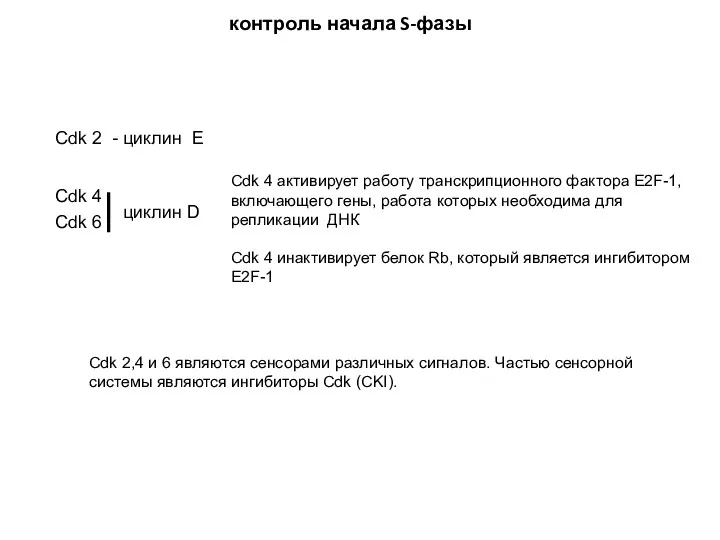
- 11. Cdk 2 - циклин E Сdk 4 Cdk 6 циклин D Cdk 2,4 и 6 являются
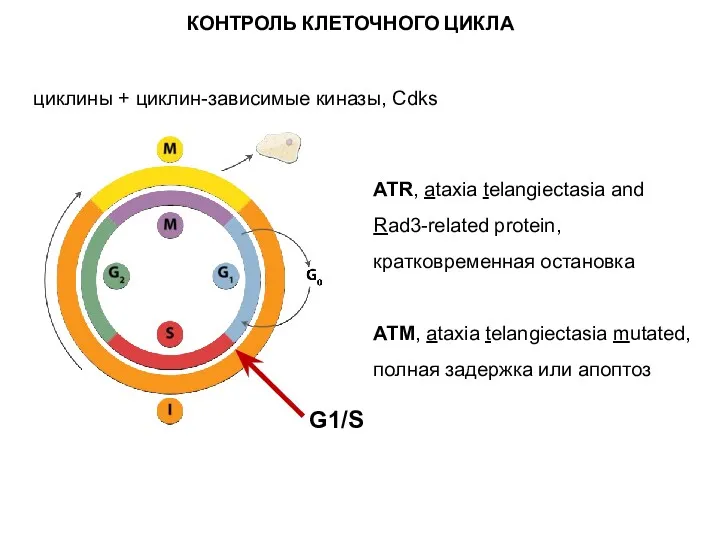
- 12. циклины + циклин-зависимые киназы, Cdks G1/S ATR, ataxia telangiectasia and Rad3-related protein, кратковременная остановка ATM, ataxia
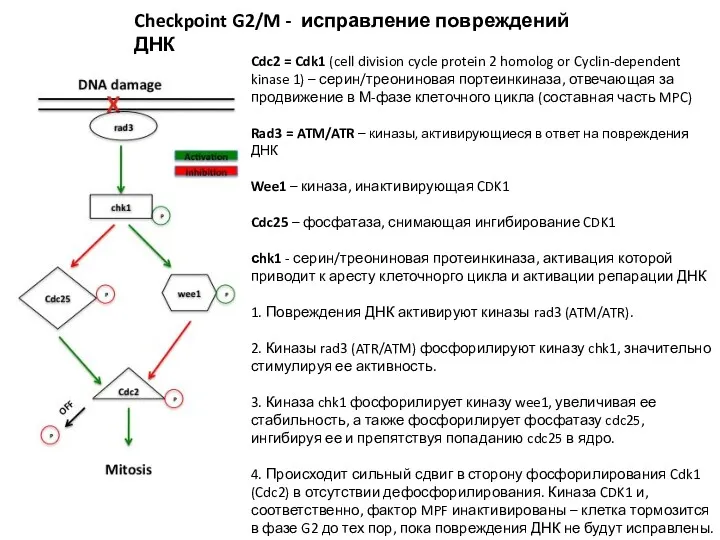
- 13. Cdc2 = Cdk1 (cell division cycle protein 2 homolog or Cyclin-dependent kinase 1) – серин/треониновая портеинкиназа,
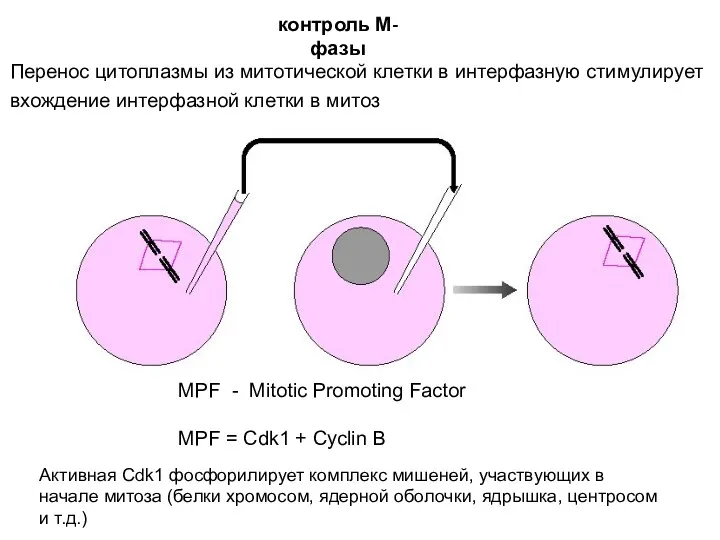
- 14. Перенос цитоплазмы из митотической клетки в интерфазную стимулирует вхождение интерфазной клетки в митоз MPF - Mitotic
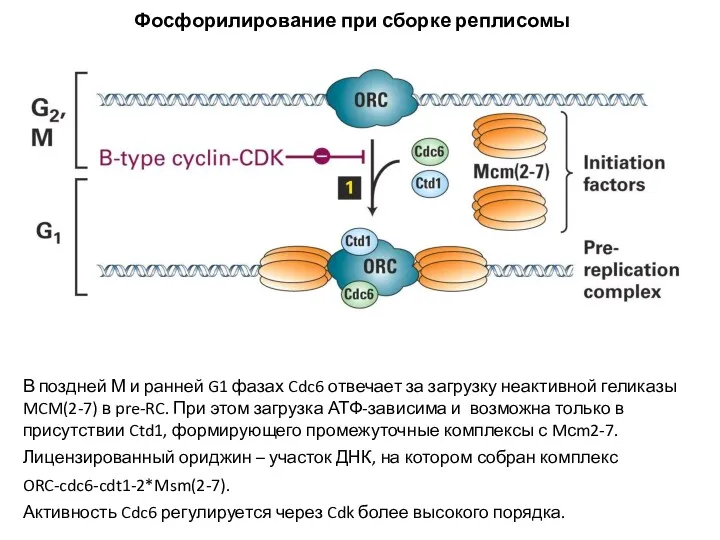
- 15. В поздней М и ранней G1 фазах Cdc6 отвечает за загрузку неактивной геликазы MCM(2-7) в pre-RC.
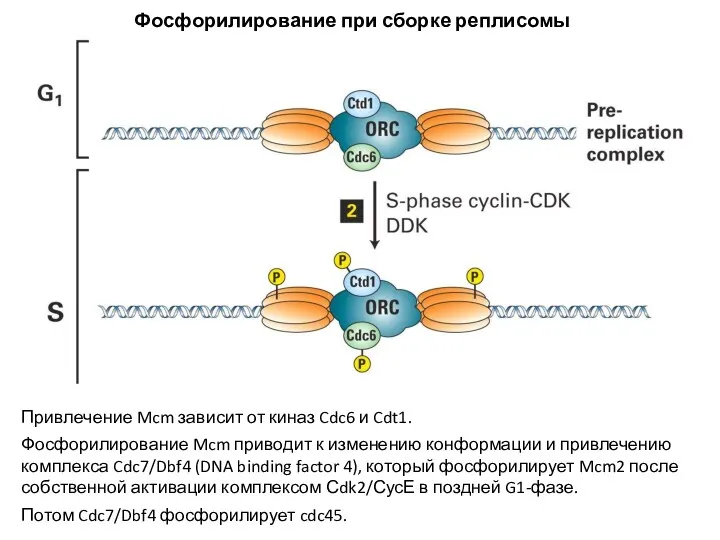
- 16. Привлечение Mcm зависит от киназ Cdc6 и Cdt1. Фосфорилирование Mcm приводит к изменению конформации и привлечению
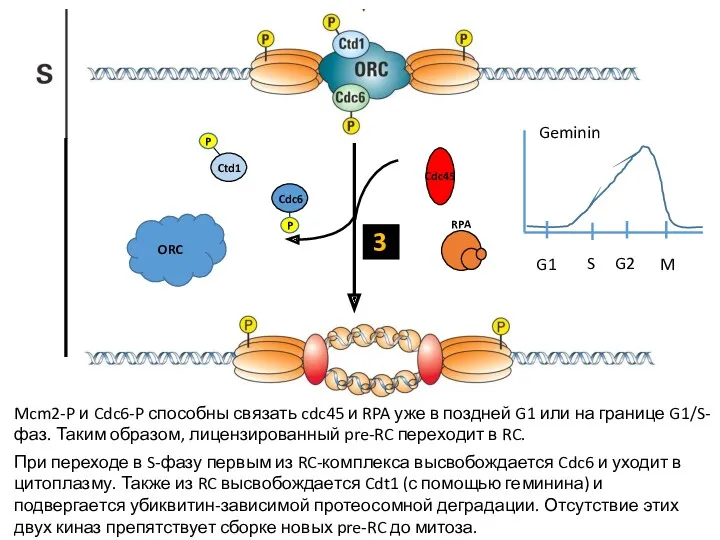
- 17. Mcm2-P и Cdc6-P способны связать cdc45 и RPA уже в поздней G1 или на границе G1/S-фаз.
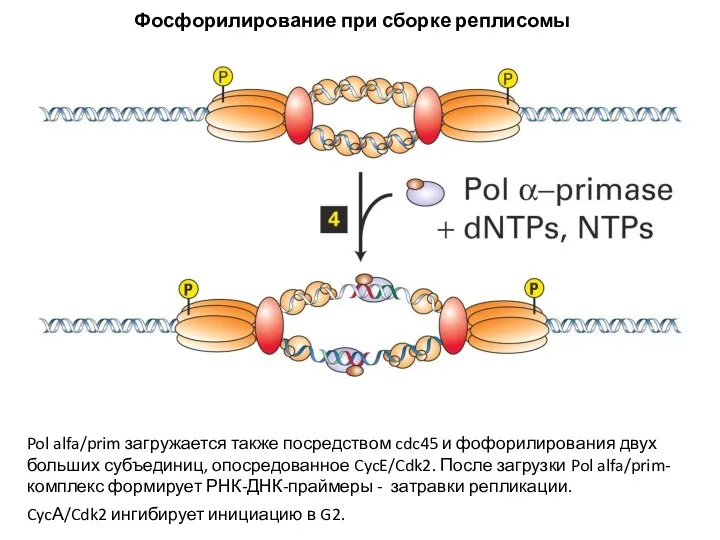
- 18. Pol alfa/prim загружается также посредством cdc45 и фофорилирования двух больших субъединиц, опосредованное CycE/Cdk2. После загрузки Pol
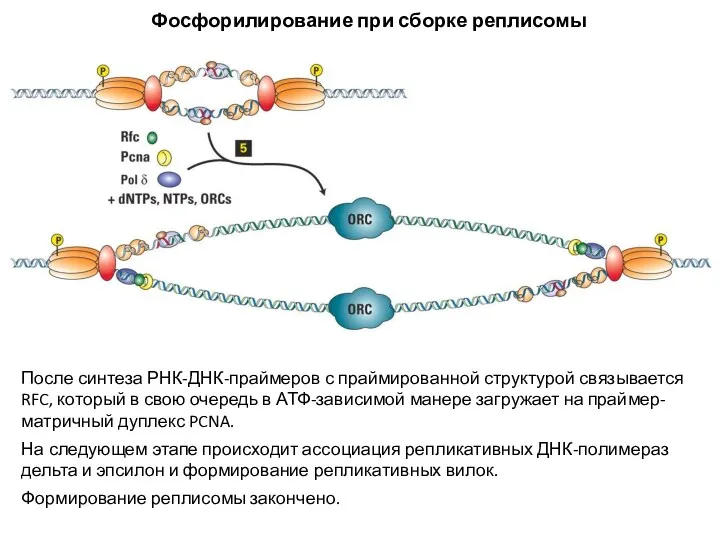
- 19. После синтеза РНК-ДНК-праймеров с праймированной структурой связывается RFC, который в свою очередь в АТФ-зависимой манере загружает
- 20. После того, как синтез ДНК закончен, ori вновьАТФ-зависимо заполняются комплексом ORC на протяжении частично G2 и
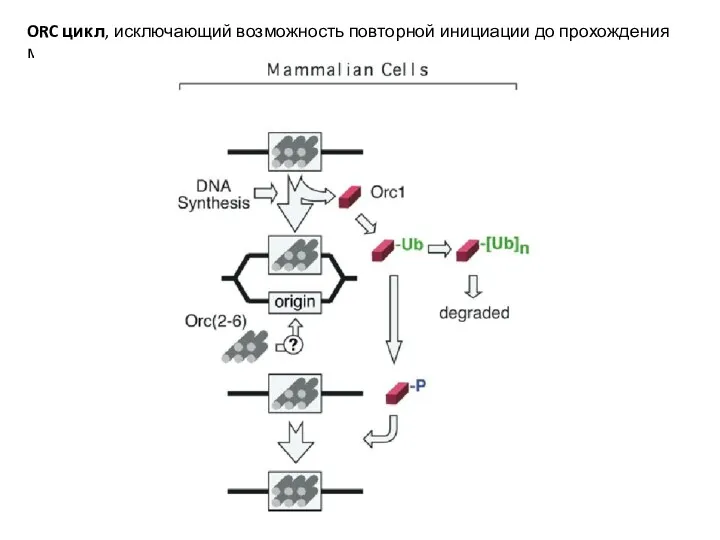
- 21. ORC цикл, исключающий возможность повторной инициации до прохождения митоза
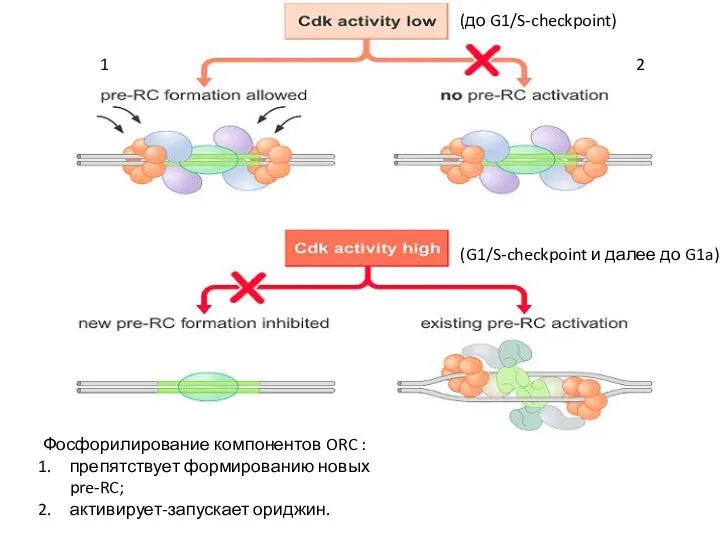
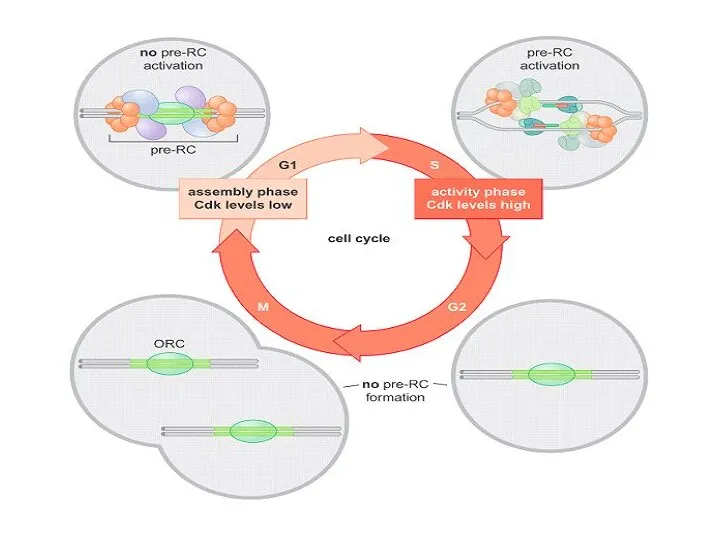
- 22. Фосфорилирование компонентов ORC : препятствует формированию новых pre-RC; активирует-запускает ориджин. 1 2 (до G1/S-checkpoint) (G1/S-checkpoint и
- 24. Начало клеточного цикла – restriction point (R) – - решается вопрос о дальнейшем продвижении по G1-фазе
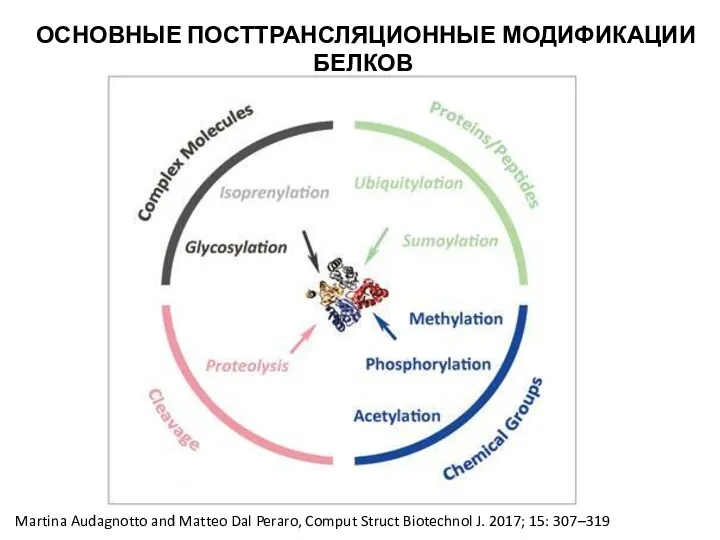
- 25. ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ Martina Audagnotto and Matteo Dal Peraro, Comput Struct Biotechnol J. 2017; 15:
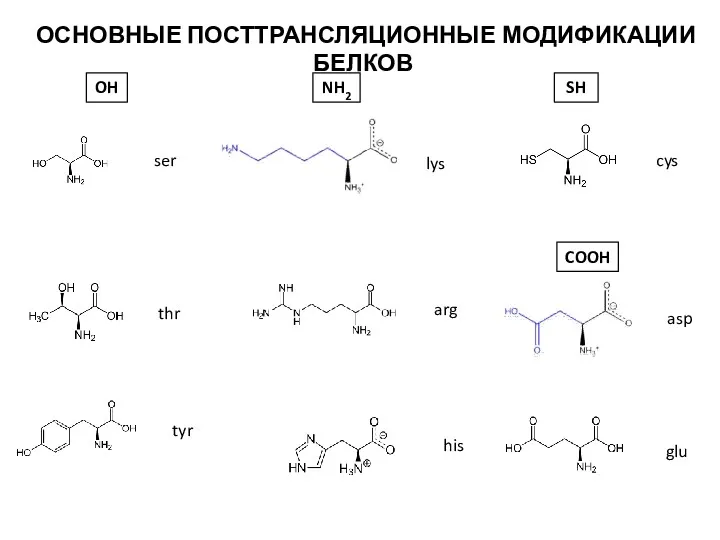
- 26. ser thr tyr lys arg his OH NH2 cys SH asp COOH glu ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ
- 27. ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ 108222 Phosphorylation 104966 N-linked glycosylation 33291 Acetylation 10295 Methylation 6069 Palmitoylation 5548
- 28. ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ небольшие химические группы: фосфорилирование, гликозилирование, S-нитрозилирование, метилирование, N-ацетилирование; липиды: пальмитилирование - присоединение
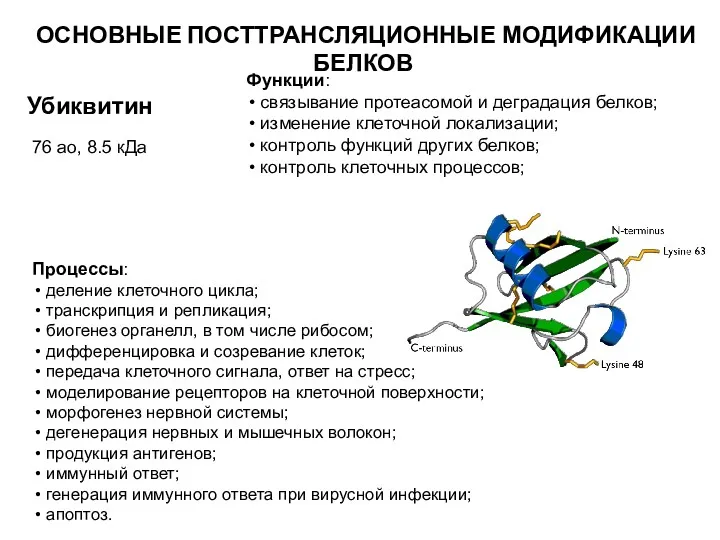
- 29. Убиквитин 76 ао, 8.5 кДа Функции: связывание протеасомой и деградация белков; изменение клеточной локализации; контроль функций
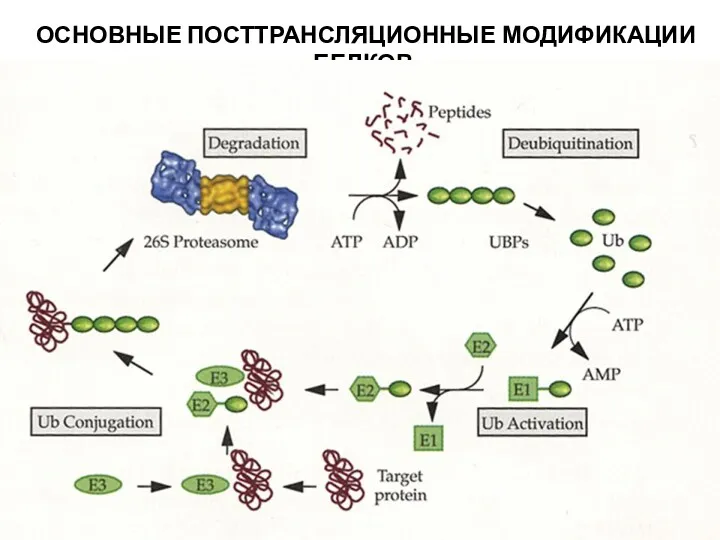
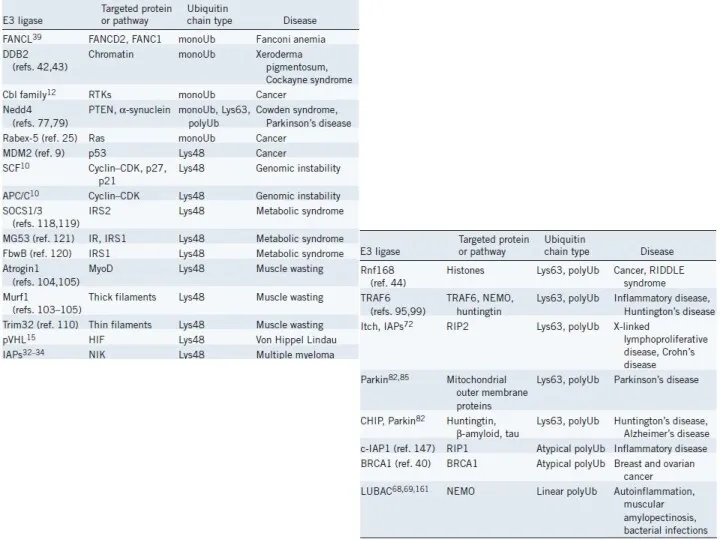
- 30. ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ
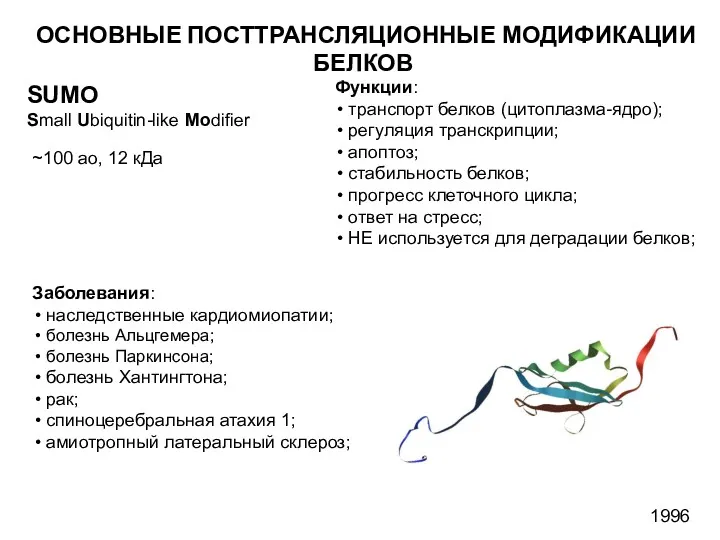
- 32. SUMO Small Ubiquitin-like Modifier ~100 ао, 12 кДа Заболевания: наследственные кардиомиопатии; болезнь Альцгемера; болезнь Паркинсона; болезнь
- 34. Скачать презентацию






 Методы исследования биологии
Методы исследования биологии Ферменты в генетической инженерии. Тема 2
Ферменты в генетической инженерии. Тема 2 Внешнее строение листа
Внешнее строение листа Клиническая физиология КЩС
Клиническая физиология КЩС Происхождение человека
Происхождение человека Цветок – орган генеративного размножения
Цветок – орган генеративного размножения General Musculoskeletal Screening: Upper Extremities
General Musculoskeletal Screening: Upper Extremities Эволюционные теории и взгляды
Эволюционные теории и взгляды Систематика растений
Систематика растений Дуб - царь деревьев
Дуб - царь деревьев Эпизоотологическое и эпидемиологическое значение грызунов. Дератизация
Эпизоотологическое и эпидемиологическое значение грызунов. Дератизация Значение водорослей в природе и жизни человека
Значение водорослей в природе и жизни человека презентация к уроку по теме: Цветок. Строение и значение цветка
презентация к уроку по теме: Цветок. Строение и значение цветка Антропогенез. Гипотезы возникновения человека. Сходство и различия человека и животных. Часть 4
Антропогенез. Гипотезы возникновения человека. Сходство и различия человека и животных. Часть 4 Живі фільтри
Живі фільтри Слух. Среднее и внутреннее ухо. Функции среднего уха. Строение улитки
Слух. Среднее и внутреннее ухо. Функции среднего уха. Строение улитки Анатомия и физиология ЦНС. Свойства и принципы функционирования нервных центров. Строение СМ. Цереброспинальная жидкость
Анатомия и физиология ЦНС. Свойства и принципы функционирования нервных центров. Строение СМ. Цереброспинальная жидкость Ферменты,структура и механизм действия. Классификация и номенклатура. (Лекция 4)
Ферменты,структура и механизм действия. Классификация и номенклатура. (Лекция 4) Практика по общей биологии
Практика по общей биологии Простейшие – эукариотические одноклеточные микроорганизмы
Простейшие – эукариотические одноклеточные микроорганизмы Главные направления эволюции органического мира
Главные направления эволюции органического мира Желудочная секреция
Желудочная секреция Строение, химический состав и жизнедеятельность растительной клетки
Строение, химический состав и жизнедеятельность растительной клетки презентация по биологии Экологическая задача Ч.Дарвина
презентация по биологии Экологическая задача Ч.Дарвина Nervové mechanismy regulace dýchání
Nervové mechanismy regulace dýchání Минеральные вещества
Минеральные вещества Что такое хвоинки
Что такое хвоинки Глюконеогенез. Регуляция гликолиза и глюконеогенеза. Цикл кори. Пентозофосфатный путь превращения глюкозы. Спиртовое брожение
Глюконеогенез. Регуляция гликолиза и глюконеогенеза. Цикл кори. Пентозофосфатный путь превращения глюкозы. Спиртовое брожение