Содержание
- 2. Санитарное состояние объектов внешней среды определяют по двум основным показателям: общее микробное число – общее количество
- 3. Санитарно-показательные микроорганизмы воды – это бактерии группы кишечной палочки (БГКП). Они также называются колиформными (от лат.
- 4. Санитарное состояние почвы оценивают на основании нескольких показателей: содержания общего количества микроорганизмов (общее микробное число), наличия
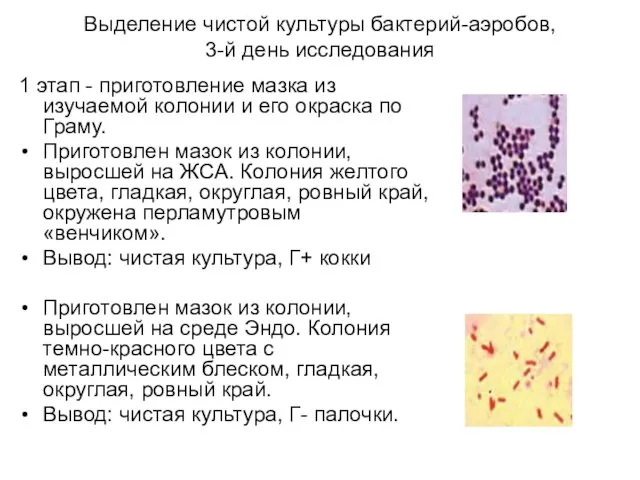
- 5. Выделение чистой культуры бактерий-аэробов, 3-й день исследования 1 этап - приготовление мазка из изучаемой колонии и
- 6. 2 этап – посев выделенных чистых культур на среды Гисса и Олькеницкого для определения биохимических свойств.
- 7. Выделение чистой культуры бактерий-аэробов, 4-й день исследования Учёт результатов определения биохимической активности аэробных бактерий на средах
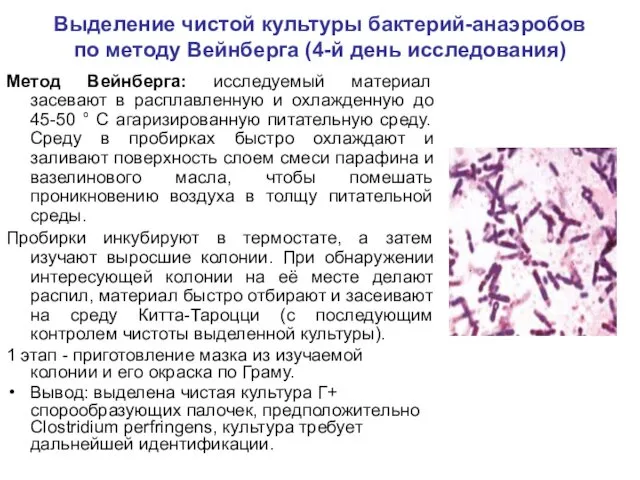
- 8. Выделение чистой культуры бактерий-анаэробов по методу Вейнберга (4-й день исследования) Метод Вейнберга: исследуемый материал засевают в
- 9. Определение ОМЧ водопроводной воды (1-й день исследования) Отбор проб: Для взятия проб воды используют стерильную посуду.
- 10. Общее микробное число воды определяют путем культивирования содержащихся в пробах бактерий в плотных питательных средах. По
- 11. Определение общего микробного числа (ОМЧ) воздуха в лаборатории седиментационным методом и с помощью аппарата Кротова (1-й
- 12. Аспирационный метод основан на ударном действии воздушной струи о поверхность питательной среды, на которую оседают микроорганизмы.
- 13. Определение общего микробного числа (ОМЧ) воздуха (2-й день исследования) После инкубации подсчитывают суммарное количество колоний, выросших
- 14. Изучение нормальной микрофлоры организма человека (1-й день исследования) Смыв с кожи рук (отбор материала для исследования).
- 15. Изучение нормальной микрофлоры организма человека (2-й день исследования) Изучены 2 вида колоний после посева мазка из
- 17. Скачать презентацию












 Эволюция растений
Эволюция растений презентация Самые высокие горы
презентация Самые высокие горы Оценка качества почвы с помощью растения – биоиндикатора
Оценка качества почвы с помощью растения – биоиндикатора Мінеральне та повітряне живлення рослин
Мінеральне та повітряне живлення рослин Биология оқыту үрдісінде тәрбиелеу Ептіліктердің және білімдердің қалыптастыру
Биология оқыту үрдісінде тәрбиелеу Ептіліктердің және білімдердің қалыптастыру Генетические основы селекции.
Генетические основы селекции. Поджелудочная железа
Поджелудочная железа Интерактивная игра Кто? Как? Почему? Играя, вспоминаем для 8 класса (по материалу I полугодия)
Интерактивная игра Кто? Как? Почему? Играя, вспоминаем для 8 класса (по материалу I полугодия) Лекарственные растения
Лекарственные растения Презентация к уроку биологии на тему Витамины.
Презентация к уроку биологии на тему Витамины. Gardis. Хвойные декоративные растения (каталог)
Gardis. Хвойные декоративные растения (каталог) Семейство Rosacea. Розоцветные
Семейство Rosacea. Розоцветные Эволюция нервной, кровеносной и выделительной систем органов
Эволюция нервной, кровеносной и выделительной систем органов Общая характеристика типа Моллюски
Общая характеристика типа Моллюски Биопестициды
Биопестициды В гостях у природы
В гостях у природы Тканевый обмен веществ
Тканевый обмен веществ Морфологія, будова та хімічний склад бактеріальної клітини
Морфологія, будова та хімічний склад бактеріальної клітини Функциональное состояние в структуре поведения
Функциональное состояние в структуре поведения Болезни эмбрионов с/х птицы
Болезни эмбрионов с/х птицы Иван Владимирович Мичурин (1855-1935)
Иван Владимирович Мичурин (1855-1935) Основні закономірності незалежного та зчепленого успадкування
Основні закономірності незалежного та зчепленого успадкування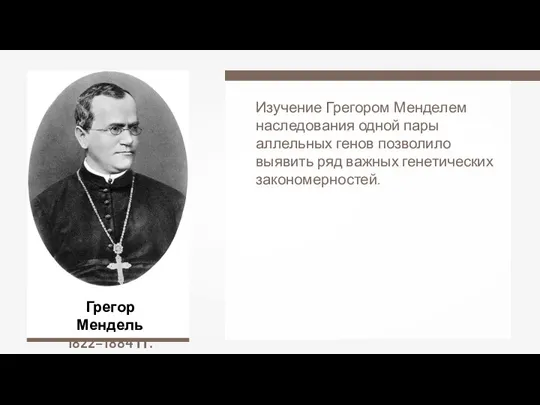 Дигибридное скрещивание. Закон независимого наследования признаков
Дигибридное скрещивание. Закон независимого наследования признаков Презентация по биологии Класс Птицы для 7 класса.
Презентация по биологии Класс Птицы для 7 класса. Свободные жирные кислоты и кальциевый гомеостаз скелетно-мышечных клеток
Свободные жирные кислоты и кальциевый гомеостаз скелетно-мышечных клеток Основные понятия о системе движений. Задача биомеханики двигательных действий. (Лекция 2)
Основные понятия о системе движений. Задача биомеханики двигательных действий. (Лекция 2) Бесполое размножение клетки
Бесполое размножение клетки Биотехнологии. Генная инженерия
Биотехнологии. Генная инженерия