Содержание
- 2. СЕПТЫ (от лат. septum, saeptum, перегородка) – перегородки, разделяющие гифу на компартменты или клетки после деления
- 3. Функции септ структурная поддержка гифы, разделение мицелия на компартменты (с разными физиологическими и биохимическими процессами, например,
- 4. Быстрое закупоривание септальной поры у аскомицетов (включая дейтеромицеты с аскомицетным аффинитетом) и гомобазидиомицетов Markham, 1994
- 5. Органеллы, которые закрывают септальную пору. 1.-2. Тельца Воронина 1.Электронно-плотные тельца Воронина округлой формы, одно закрыло пору,
- 7. Химический состав септ аско- и базидиомицетов Грибная септа содержит хитин, который отсутствует у животных и растений.
- 8. Типы септ у разных таксономических групп грибов (Lutzoni et al., 2004) Плазмодесмы (=десмопоры)— микроскопические цитоплазматические мостики,
- 9. Типы септ у вегетативных клеток разных таксономических групп грибов (Lutzoni et al., 2004) пор.Kickxellales пор.Mucorales мицелий
- 10. Типы септ у вегетативных клеток разных таксономических групп грибов (Lutzoni et al., 2004) диаметр поры 50-500
- 11. Однопоровая септа с поровыми включениями
- 12. Долипоровая септа с парентосомой
- 13. Септы с плазмодесмами между ризоидом и спорангиумом у Chytridium confervae из отдела Chytridiomycota
- 14. Септы с плазмодесмами у дрожжей Fig. 9. Saccharomycopsis synnaedendra. Plasrnodesmata in septum of a hypha. Fig.
- 15. Септа Geotrichum candidum с микропорами
- 16. Септы с одной порой с вильчатым утолщением и внутрипоровым включением (пор Kickzellales класс Zygomycetes отдела Zygomycota)
- 17. Однопоровые (=простые) септы с тельцами Воронина у Aspergillus nidulans (А,В) и Neurospora crassa (C)
- 18. Септы в генеративных клетках Sordaria humana : аскогенные гифы (5-8) и сумки (9)
- 19. Ультраструктура септы и септальной поры у Basidiomycota
- 20. Pucciniomycetes представлены ржавчинными грибами, которые имеют септы как у мицелиальных Ascomycota, но без телец Воронина (к
- 21. Pucciniomycetes
- 22. Ustilaginomycetes или головневые грибы. Имеют септы близкие по структуре к септам ржавчинных грибов, но могут иметь
- 23. Редко у Tilletiales и Entorrhizomycetales – долипоровые септы без шапочек и парентосом, иногда могут иметь окружение
- 24. Долипора - бочонкообразное вздутие вокруг поры (долипора) окружена группой везикул или трубочек (структурно идентичных ЭР) класс
- 25. Tremella globospora
- 26. Долипора без парентосомы, окружена мембранами ЭПР Cryptococcus (Filobasidiella neoformans) из пор.Tremellales
- 27. Auricularia auricula-judae Lu, H. and D. J. McLaughlin (1991) Auriculariaceae, Auriculariales, Incertae sedis, Agaricomycetes, Basidiomycota, Fungi
- 28. Долипора с перфорированной парентосомой и маленькими перфорациями как у Schizophyllum commune. Диаметр SPC (septal pore cap)
- 29. Долипора с перфорированной парентосомой и крупными перфорациями у Rhizoctonia solani Диаметр SPC Rhizoctonia solani от 1600
- 30. У некоторых агарикоидных грибов еще наблюдается наружная шапочка, например, у Agaricus bisporus, Coprinus cinereus, Agrocybe praecox,
- 31. Диаграмма продольного среза септального аппарата показывающая нормальное положение (точковая линия) и модифицированное с током цитоплазмы (твердая
- 32. Парентосома – субдомен ЭПР, многослойная структура, у которой внутренняя и наружная мембраны образованы мембранами ЭПР. Модель
- 33. Начинается с лизиса долипорового утолщения. Долипоровое вздутие прогрессивно исчезает, пока не исчезнет совсем. Реорганизация септы как
- 34. Частичный лизис долипорового вздутия у шампиньона двуспорового
- 35. Септирование и цитокинез у грибов Септирование или формирование септы и цитокинез (деление цитоплазмы после митотического деления
- 36. Грибы проявляют одну из двух моделей роста: дрожжеподобную или мицелиальную. Дрожжеподобный рост, примером которого может быть
- 37. Цитокинез и формирование септы - завершающие этапы клеточного цикла и поэтому нуждаются в тщательном генетическом контроле,
- 38. Формирование септы у мицелиальных грибов имеет место в прорастающих спорах, в апикальных компартментах гифы и в
- 39. Выбор сайта деления у Saccharomyces cerevisiae (А) и Schizosaccharomyces pombe (Б) голодание
- 40. Образцы септирования у мицелия
- 41. Сборка белкового комплекса у S.cerevisiae (А) Aspergillus oryzae (Б) (септинов в том числе)
- 42. Образование септы у почкующихся дрожжей. Кольцо из септинов (желтым) лежит под клеточной мембраной, неизвестные белки (черные
- 43. Формирование септы у Saccharomyces cerevisiae Формирование септы происходит в три этапа. А. Первый этап происходит очень
- 44. Цитокинез у Schizosaccharomyces pombe Сdс ("cell division cycle«) proteins - фосфатазы
- 45. Механизм сборки сократительного кольца у делящихся дрожжей
- 46. Митозы и септирование после прорастания конидии у A.nidulans
- 47. Изображение схематичной модели сборки и динамики септальной пластинки у Aspergillus nidulans. Сегменты гифы ориентированы параллельно друг
- 48. Формирование септы на структурном уровне происходит следующим образом. Вслед за инвагинацией плазмалеммы с небольшим количеством материала
- 49. Формирование долипоровой септы и парентосомы (septal pore cap, SPC) вокруг поры. Долипора формируется в процессе синтеза
- 50. Ранние стадии развития долипоровой септы Pisolithus tinctorius (5 мин)
- 52. Формирование септального аппарата у Auricularia auricula-judae Септа формируется за 4 минуты.: На ранних этапах появляются тонкие
- 56. Скачать презентацию
 Презентация по биологии. Контрольная работа в 11 классе по теме: Биосфера
Презентация по биологии. Контрольная работа в 11 классе по теме: Биосфера Селекция ягодных культур
Селекция ягодных культур Cільськогосподарські рослини
Cільськогосподарські рослини Наследственная изменчивость
Наследственная изменчивость Овощи: капуста, пасленовые, тыквенные
Овощи: капуста, пасленовые, тыквенные Ұтымды тамақтану және оны ұйымдастыруға қойылатын гигиеналық талаптар
Ұтымды тамақтану және оны ұйымдастыруға қойылатын гигиеналық талаптар Презентация Сцепленное наследование признаков
Презентация Сцепленное наследование признаков Мутагенез
Мутагенез Общая характеристика грибов
Общая характеристика грибов Исследовательские работы учащихся
Исследовательские работы учащихся Наглядное пособие о способах выживания в природе
Наглядное пособие о способах выживания в природе Введение в общую биологию. (критерии и уровни организации жизни)
Введение в общую биологию. (критерии и уровни организации жизни) Nfectology. Concept of infectious disease
Nfectology. Concept of infectious disease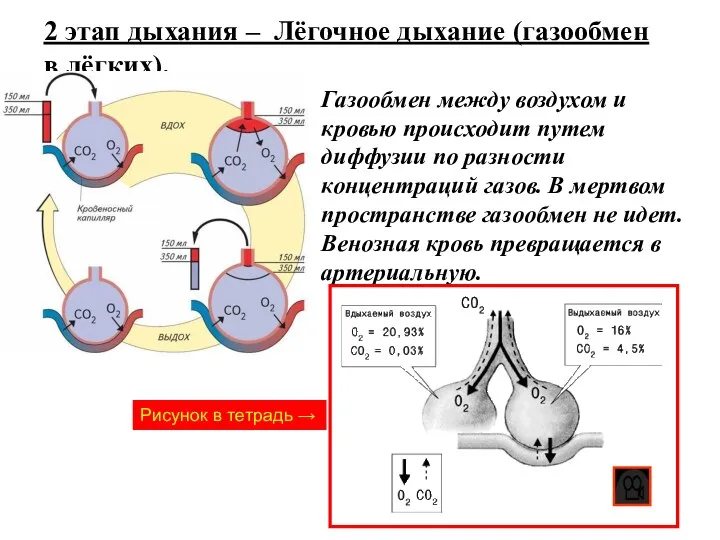 Газообмен в легких и тканях
Газообмен в легких и тканях Клеточное строение листа
Клеточное строение листа Урок 10 класс Бионика, или Удивительный мир живой природы
Урок 10 класс Бионика, или Удивительный мир живой природы Путешествие в царство Природы
Путешествие в царство Природы Уақытша байланыстар механизмдері
Уақытша байланыстар механизмдері Обычный — бразильский кот: Бакс
Обычный — бразильский кот: Бакс Эмбриология (определение, виды)
Эмбриология (определение, виды) Интегрированный урок Выявление модификационной изменчивости организмов методом построения диаграмм
Интегрированный урок Выявление модификационной изменчивости организмов методом построения диаграмм Почемучкина наука для больших и маленьких. Мультимедиа игра Мы - друзья леса
Почемучкина наука для больших и маленьких. Мультимедиа игра Мы - друзья леса Среды обитания живых организмов
Среды обитания живых организмов Плоды. Сухие плоды
Плоды. Сухие плоды Конспект урока. Внутреннее строение рыбы
Конспект урока. Внутреннее строение рыбы Строение и функции органов дыхания
Строение и функции органов дыхания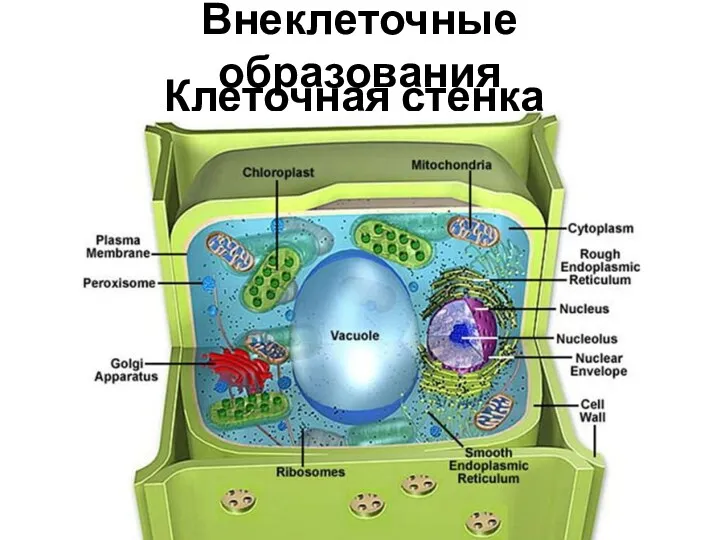 Внеклеточные образования. Клеточная стенка
Внеклеточные образования. Клеточная стенка Применение препаратов НЭСТ М в защите плодовых
Применение препаратов НЭСТ М в защите плодовых