Содержание
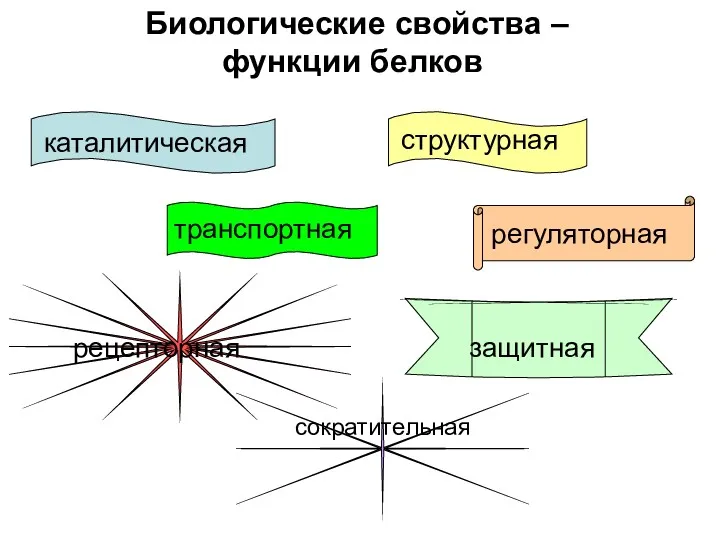
- 2. Биологические свойства – функции белков
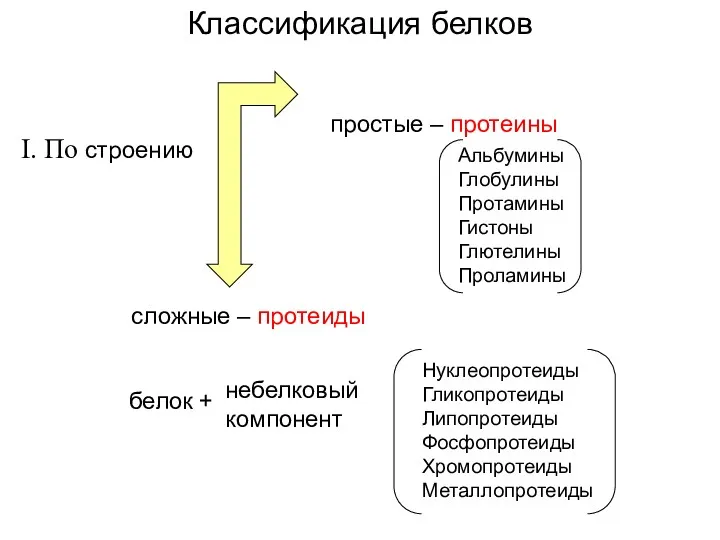
- 3. I. По строению простые – протеины сложные – протеиды Классификация белков
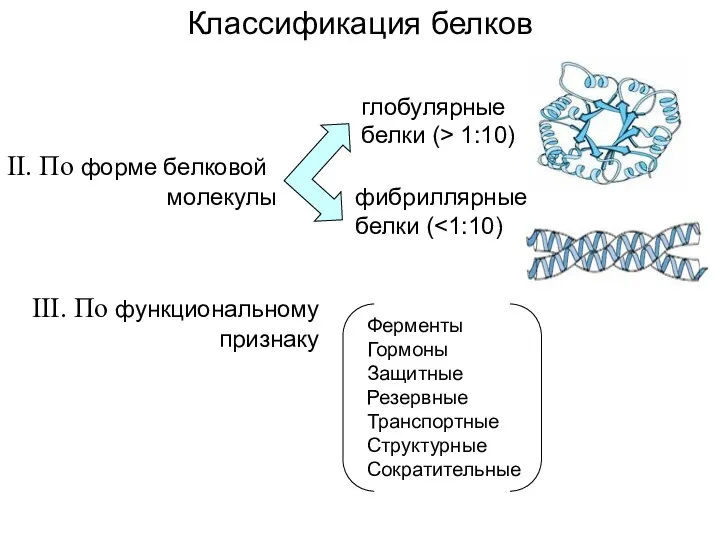
- 4. II. По форме белковой молекулы глобулярные белки (> 1:10) фибриллярные белки ( III. По функциональному признаку
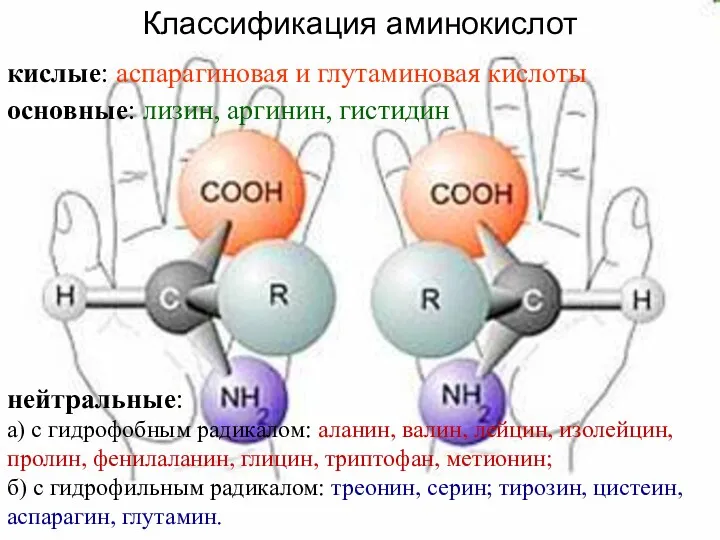
- 5. кислые: аспарагиновая и глутаминовая кислоты основные: лизин, аргинин, гистидин нейтральные: а) с гидрофобным радикалом: аланин, валин,
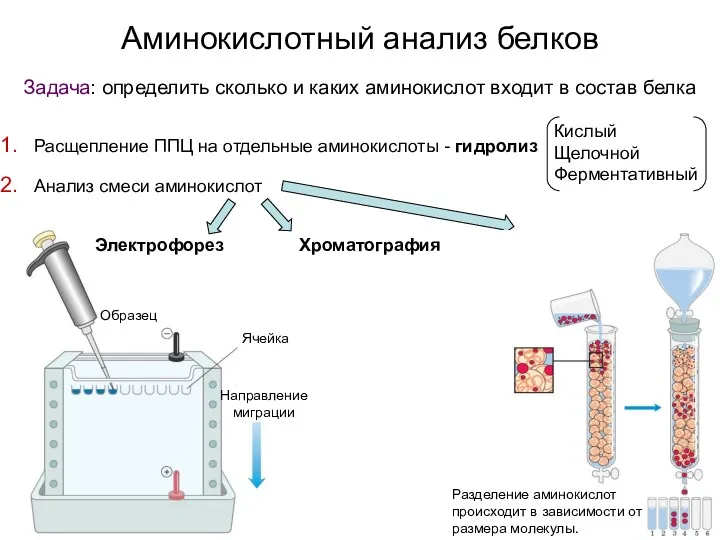
- 6. Аминокислотный анализ белков Задача: определить сколько и каких аминокислот входит в состав белка Расщепление ППЦ на
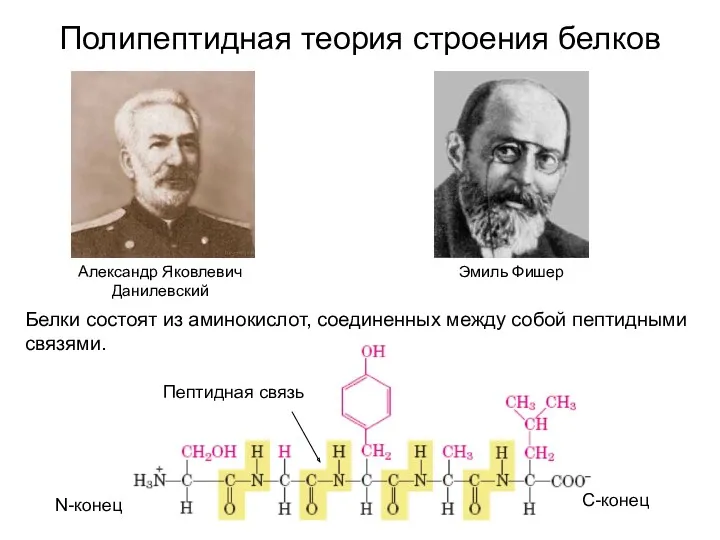
- 7. Полипептидная теория строения белков Александр Яковлевич Данилевский Эмиль Фишер Белки состоят из аминокислот, соединенных между собой
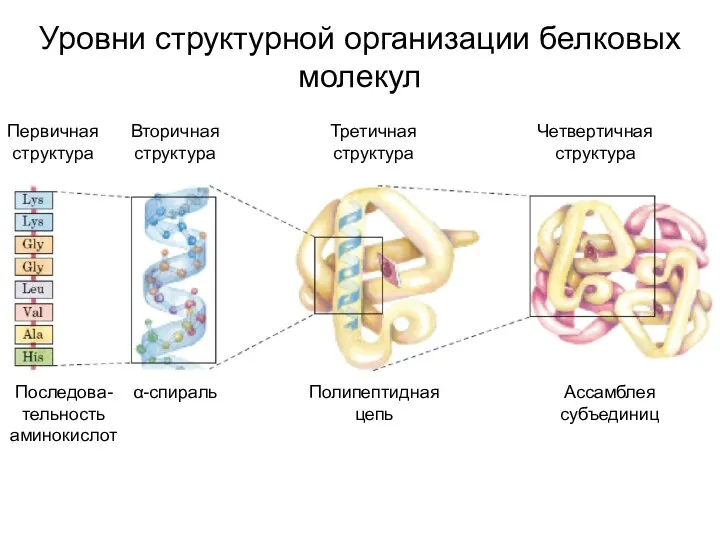
- 8. Уровни структурной организации белковых молекул Первичная структура Вторичная структура Третичная структура Четвертичная структура Последова-тельность аминокислот α-спираль
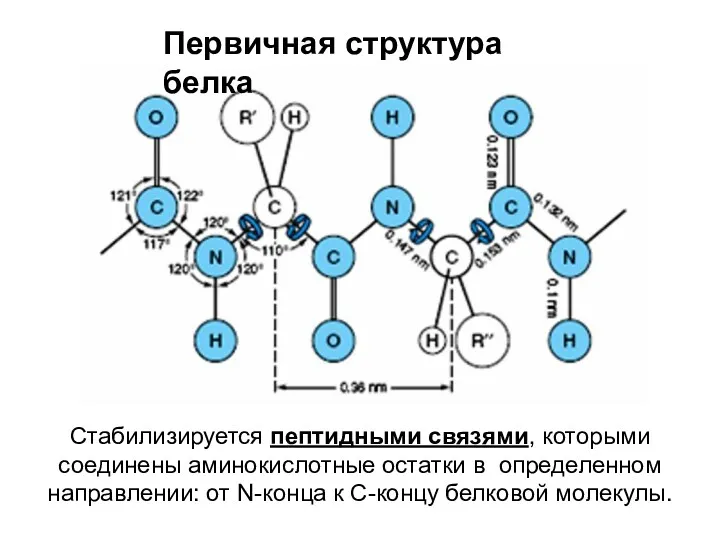
- 9. Стабилизируется пептидными связями, которыми соединены аминокислотные остатки в определенном направлении: от N-конца к С-концу белковой молекулы.
- 10. Методы определения аминокислотной последовательности белка Химическая модификация концевых аминокислот N-концевая а/к – метод Сэнжера С-концевая а/к
- 11. Frederick Senger A цепь В цепь Аминокислотная последовательность инсулина быка Дисульфидные мостики в молекуле инсулина
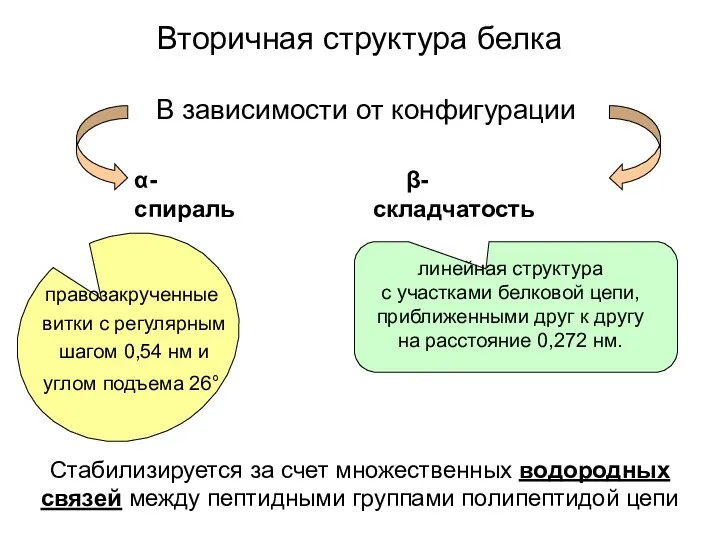
- 12. Стабилизируется за счет множественных водородных связей между пептидными группами полипептидой цепи Вторичная структура белка
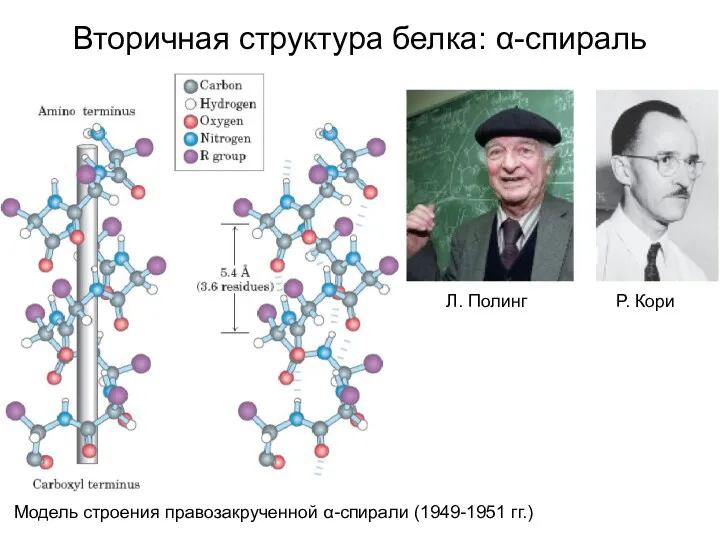
- 13. Вторичная структура белка: α-спираль Модель строения правозакрученной α-спирали (1949-1951 гг.) Л. Полинг Р. Кори
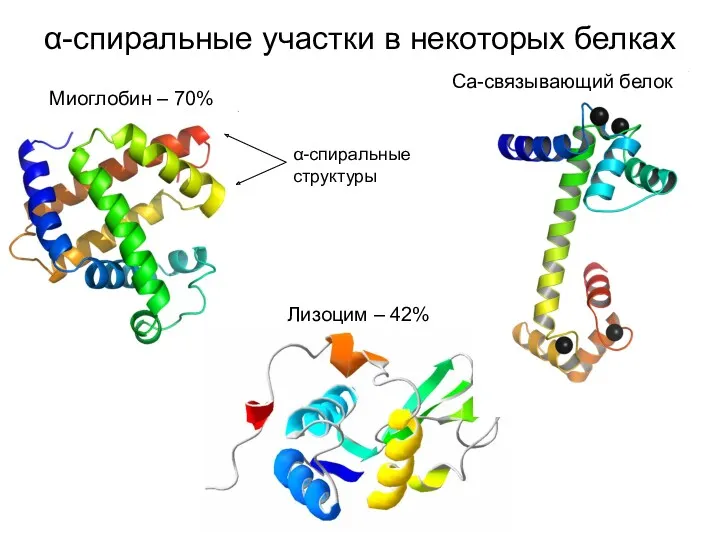
- 14. α-спиральные участки в некоторых белках Миоглобин – 70% Лизоцим – 42% Ca-связывающий белок α-спиральные структуры
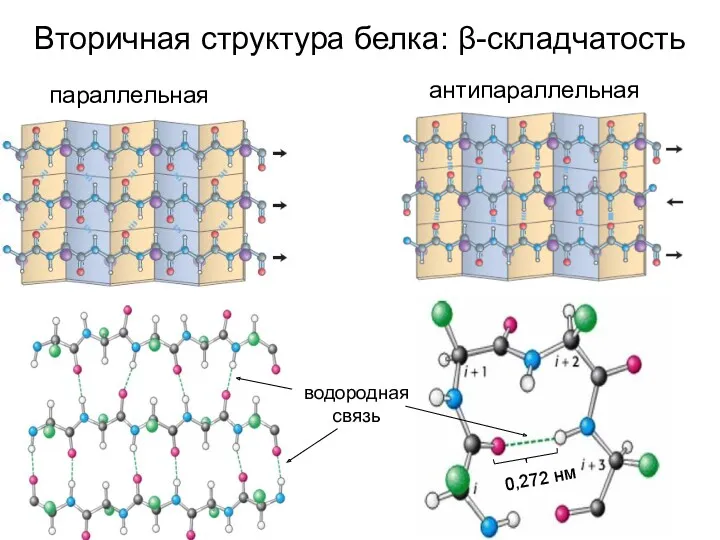
- 15. Вторичная структура белка: β-складчатость параллельная антипараллельная водородная связь
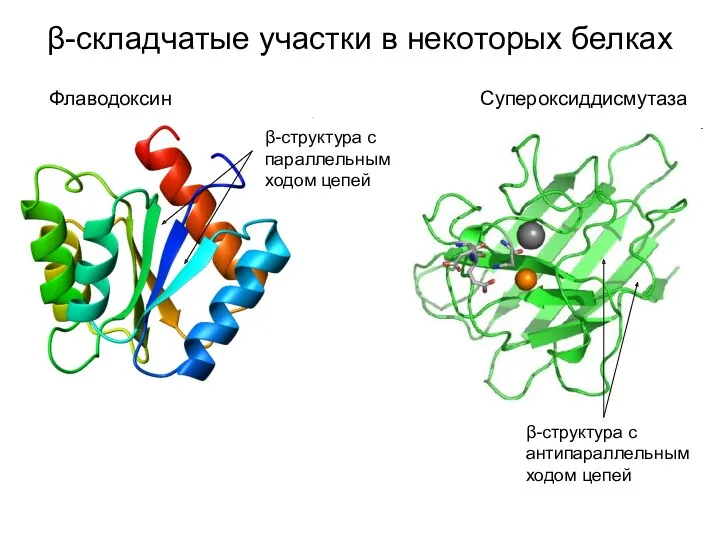
- 16. β-складчатые участки в некоторых белках Флаводоксин β-структура с параллельным ходом цепей Супероксиддисмутаза β-структура с антипараллельным ходом
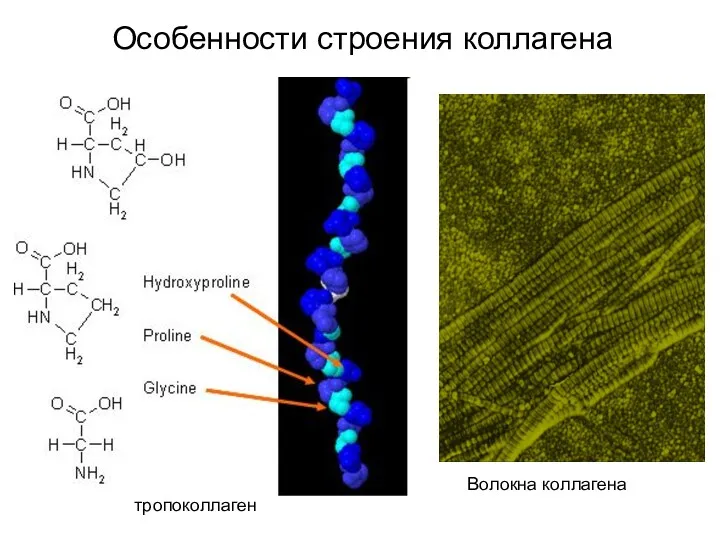
- 17. Особенности строения коллагена тропоколлаген Волокна коллагена
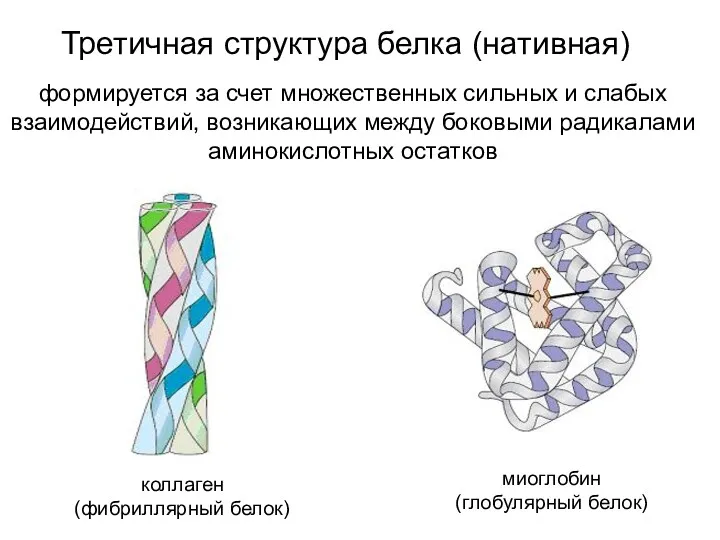
- 18. коллаген (фибриллярный белок) миоглобин (глобулярный белок) Третичная структура белка (нативная) формируется за счет множественных сильных и
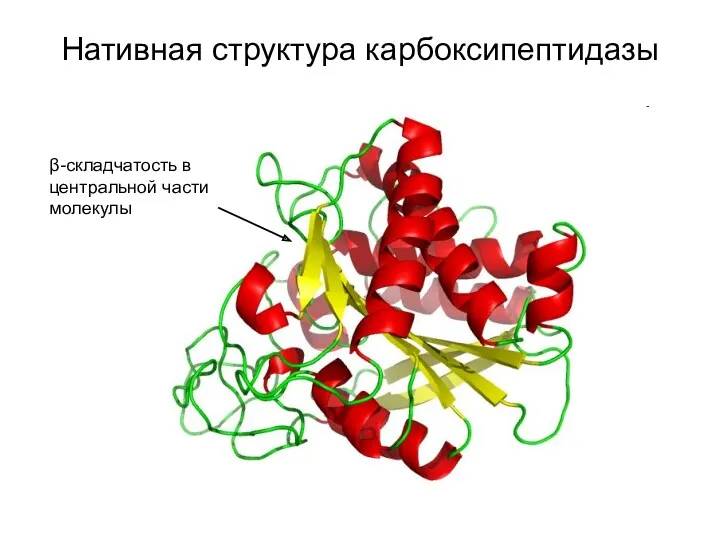
- 19. Нативная структура карбоксипептидазы β-складчатость в центральной части молекулы
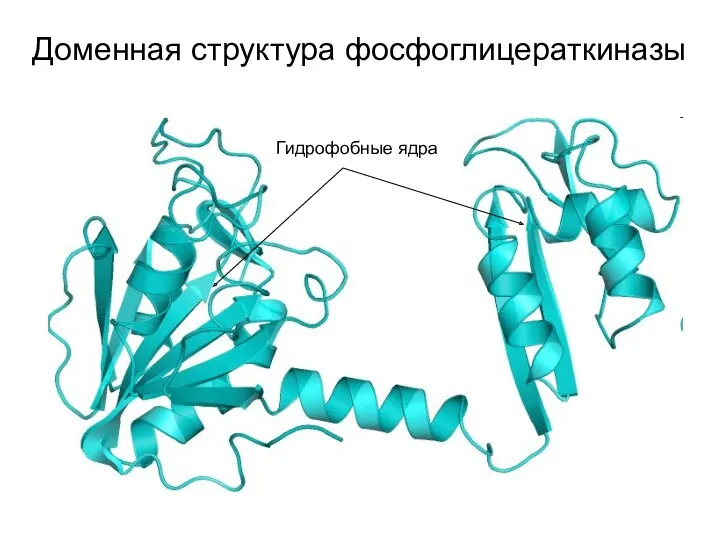
- 20. Доменная структура фосфоглицераткиназы Гидрофобные ядра
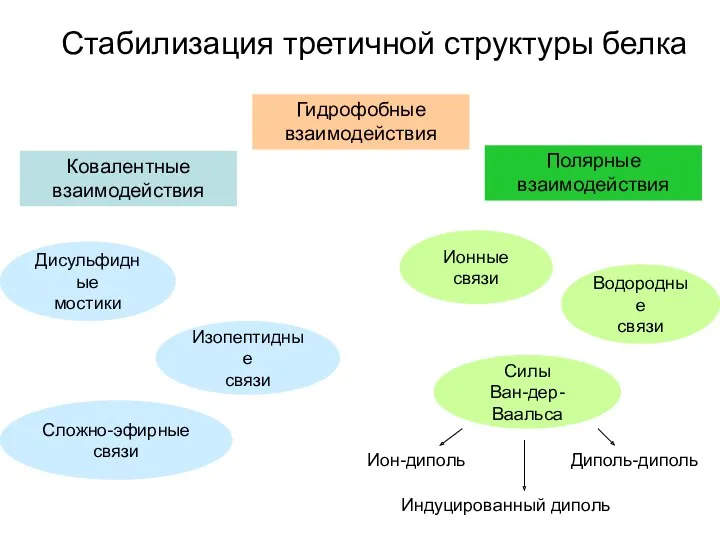
- 21. Стабилизация третичной структуры белка Ковалентные взаимодействия Полярные взаимодействия Изопептидные связи Сложно-эфирные связи Дисульфидные мостики Ионные связи
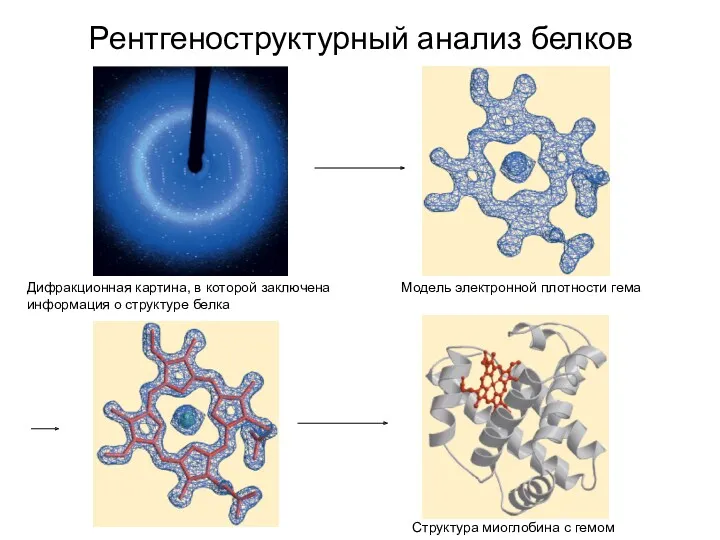
- 22. Рентгеноструктурный анализ белков Дифракционная картина, в которой заключена информация о структуре белка Структура миоглобина с гемом
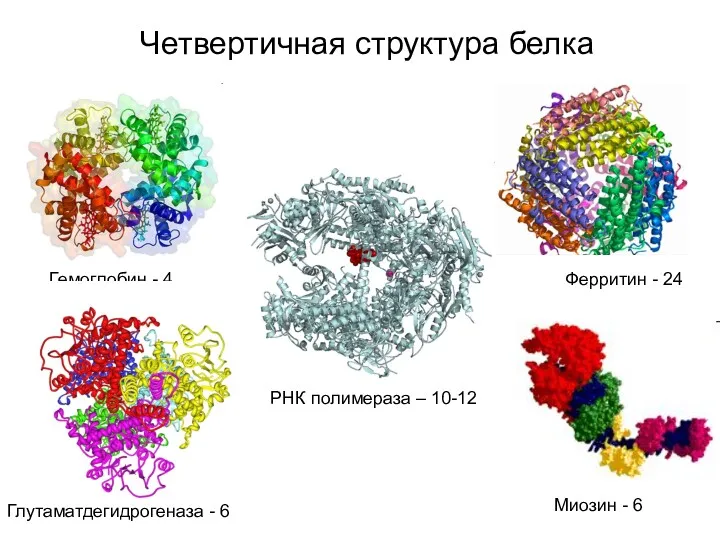
- 23. Четвертичная структура белка Гемоглобин - 4 Ферритин - 24 Глутаматдегидрогеназа - 6 Миозин - 6 РНК
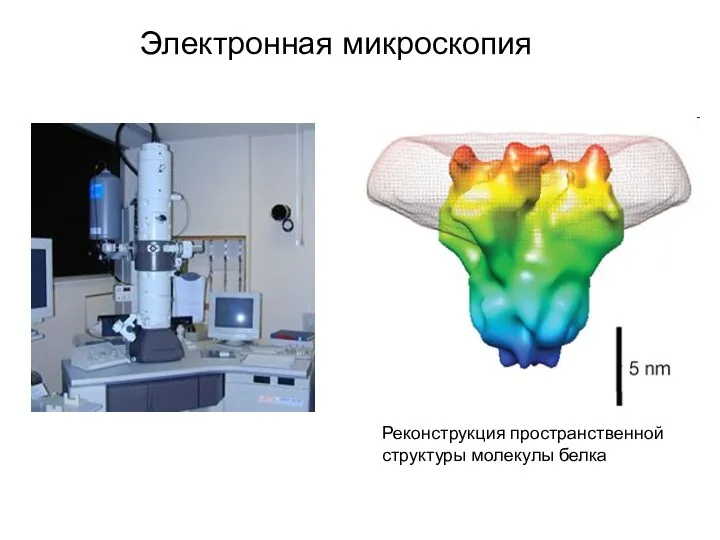
- 24. Электронная микроскопия Реконструкция пространственной структуры молекулы белка
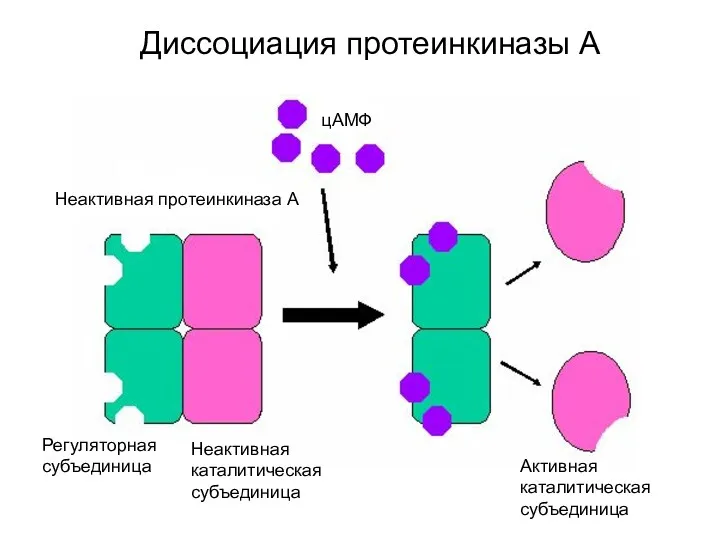
- 25. Диссоциация протеинкиназы А цАМФ Неактивная протеинкиназа А Регуляторная субъединица Неактивная каталитическая субъединица Активная каталитическая субъединица
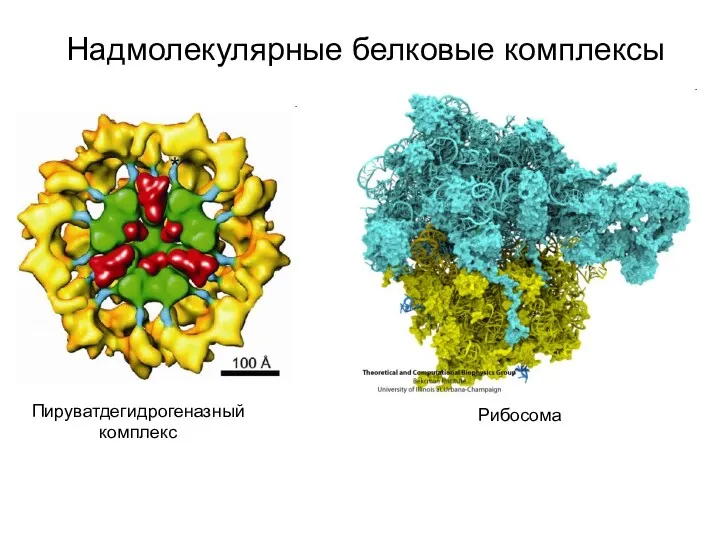
- 26. Надмолекулярные белковые комплексы Пируватдегидрогеназный комплекс Рибосома
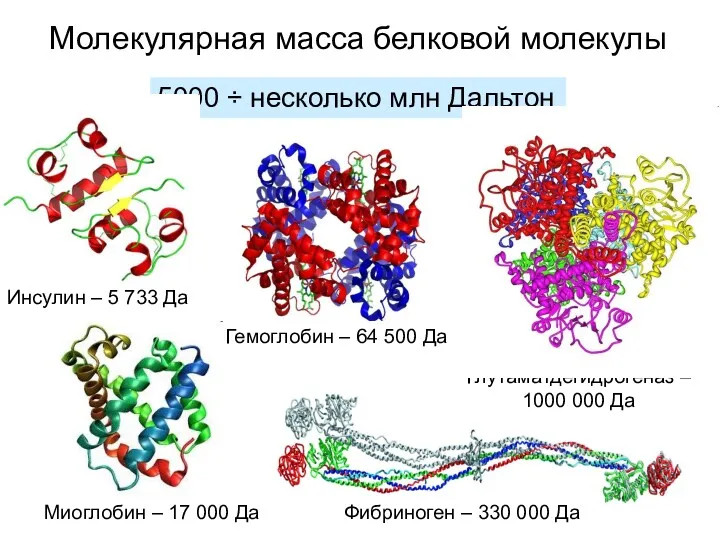
- 27. Молекулярная масса белковой молекулы 5000 ÷ несколько млн Дальтон Инсулин – 5 733 Да Миоглобин –
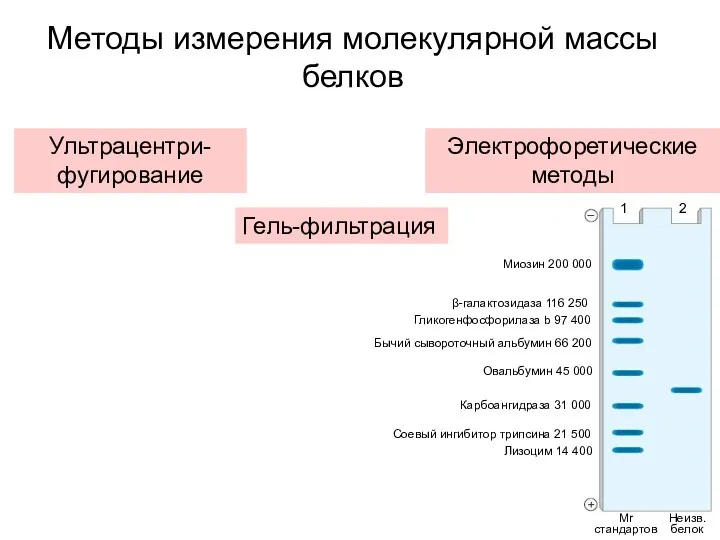
- 28. Методы измерения молекулярной массы белков Ультрацентри-фугирование Гель-фильтрация Электрофоретические методы 1 2 Миозин 200 000 β-галактозидаза 116
- 29. Растворимость белков Гидрофильные белки – растворимы в воде и солевых растворах (гемоглобин, миоглобин, амилаза, пепсин и
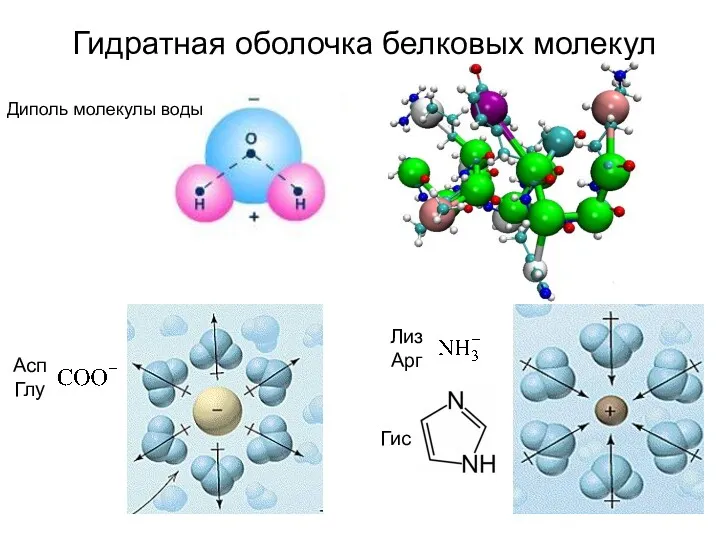
- 30. Гидратная оболочка белковых молекул Диполь молекулы воды Асп Глу Гис
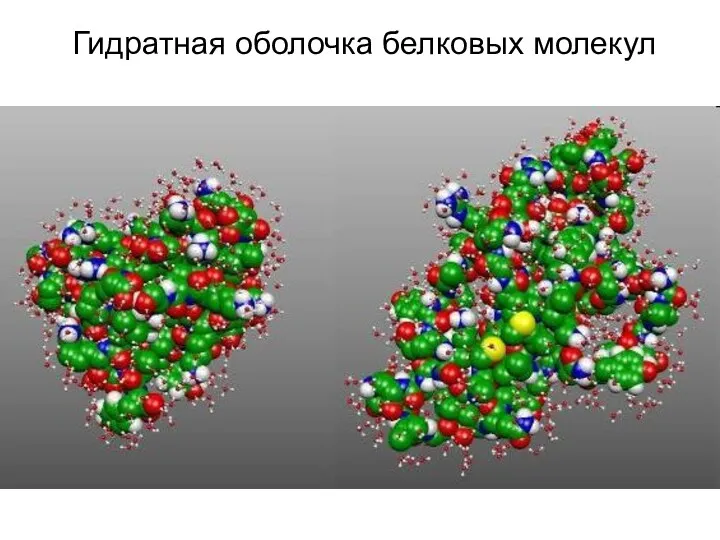
- 31. Гидратная оболочка белковых молекул
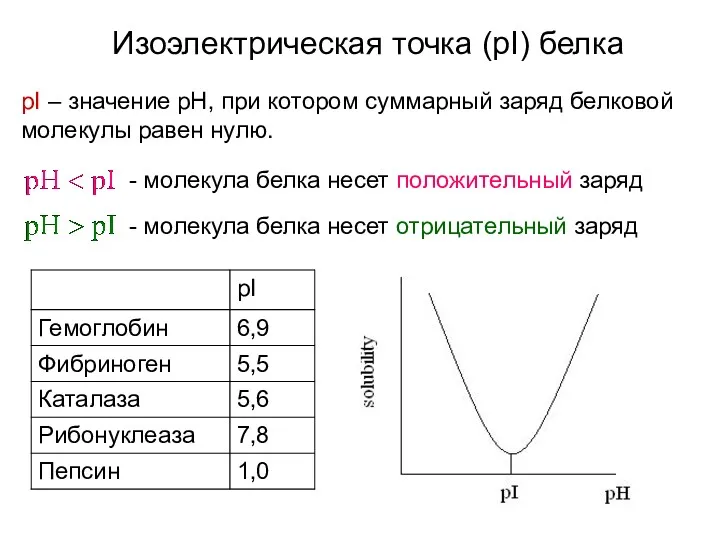
- 32. Изоэлектрическая точка (pI) белка pI – значение pH, при котором суммарный заряд белковой молекулы равен нулю.
- 33. Коллоидный раствор рассеивает свет Истинный раствор пропускает свет Свойства белковых растворов Джон Тиндаль (1820-1893) Растворы белков
- 34. Свойства белковых растворов Белки не проходят через полупроницаемые мембраны Диализ Аппарат искусственная почка (гемодиализный аппарат)
- 35. Свойства белковых растворов Водные растворы белков опалесцируют Величина показателя преломления ~ [белка] в растворе
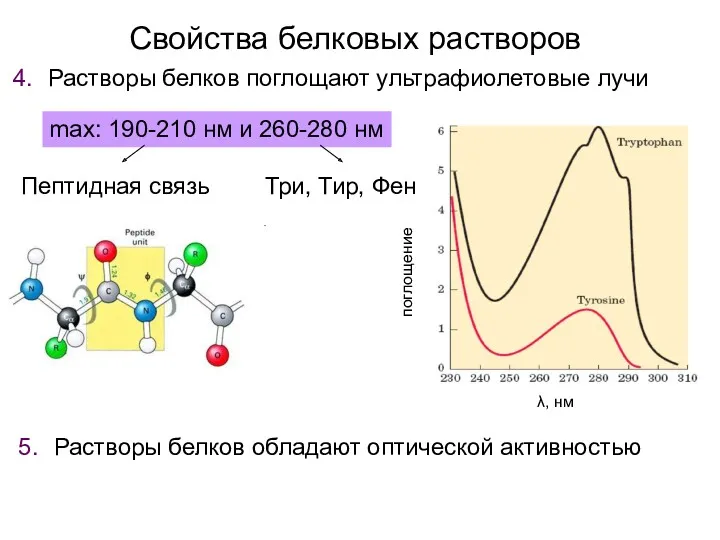
- 36. Свойства белковых растворов Растворы белков поглощают ультрафиолетовые лучи max: 190-210 нм и 260-280 нм Три, Тир,
- 37. Осаждение белков из водных растворов с сохранением пространственной структуры с нарушением пространственной структуры высаливание Нейтральные соли
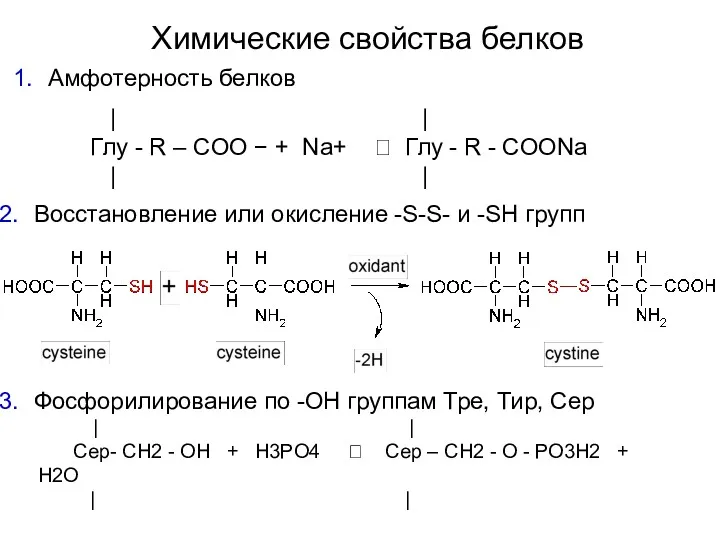
- 38. Химические свойства белков Амфотерность белков | | Глу - R – COO − + Na+ ?
- 39. Химические свойства белков Гликозилирование О-гликозидные связи (-ОН группы Сер, Тре и Тир) N-гликозидные связи (амидные группы
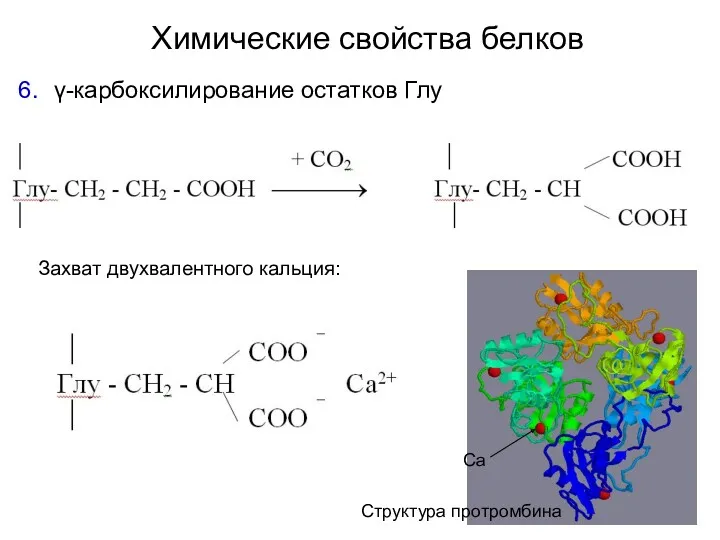
- 40. Химические свойства белков γ-карбоксилирование остатков Глу Захват двухвалентного кальция: Структура протромбина Са
- 41. Химические свойства белков Цветные реакции белков реакция Миллона на остатки Тир реакция Фолля на остатки Цис
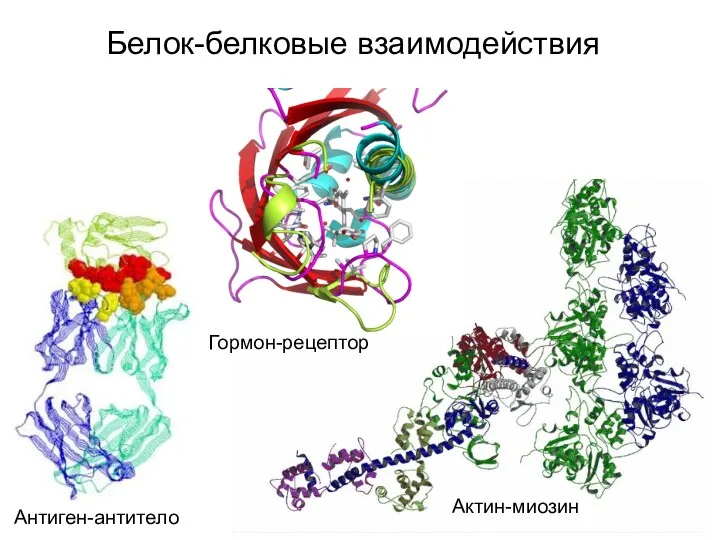
- 42. Белок-белковые взаимодействия Антиген-антитело Гормон-рецептор Актин-миозин
- 44. Скачать презентацию





![Свойства белковых растворов Водные растворы белков опалесцируют Величина показателя преломления ~ [белка] в растворе](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/308094/slide-34.jpg)



 Как сделать транскриптон? Алгоритм действий
Как сделать транскриптон? Алгоритм действий Micropropagation of ornamental pot plant via thin cell layer
Micropropagation of ornamental pot plant via thin cell layer Зайцеподібні тварини
Зайцеподібні тварини Класс Земноводные, или Амфибии
Класс Земноводные, или Амфибии Будова та розвиток нервової системи. Спинний мозок
Будова та розвиток нервової системи. Спинний мозок Применение дрожжей для снижения стоимости и улучшения качества молока
Применение дрожжей для снижения стоимости и улучшения качества молока Физиология, строение и функции нервной системы. Моторная функция нервной системы. Спинной мозг. (Тема 6-7)
Физиология, строение и функции нервной системы. Моторная функция нервной системы. Спинной мозг. (Тема 6-7) Презентация Внешнее строение корня
Презентация Внешнее строение корня Презентация про джунгарского хомяка
Презентация про джунгарского хомяка Розмноження рослин
Розмноження рослин Микроорганизмдер туғызатың биохимиялық процесстер және микроорганизмдердің генетикасы
Микроорганизмдер туғызатың биохимиялық процесстер және микроорганизмдердің генетикасы Ақуыздар, құрылысы, жіктелуі, қызметтері. Нуклеин қышқылдары, құрылысы, жіктелуі, қызметтері
Ақуыздар, құрылысы, жіктелуі, қызметтері. Нуклеин қышқылдары, құрылысы, жіктелуі, қызметтері Естественные и искусственные водоемы
Естественные и искусственные водоемы Животный мир Северной Америки
Животный мир Северной Америки Бактерії
Бактерії презентация на тему Клетка.
презентация на тему Клетка. Червона книга України
Червона книга України Вопросы ЕГЭ по зоологии
Вопросы ЕГЭ по зоологии Презентация к уроку биологии в 7 классе по образовательной системе школа 2100 на тему: Гомологичные органы
Презентация к уроку биологии в 7 классе по образовательной системе школа 2100 на тему: Гомологичные органы Клонування людини — етична і наукова проблема
Клонування людини — етична і наукова проблема Физико-химические основы патологии клетки. Митохондрии и апоптоз
Физико-химические основы патологии клетки. Митохондрии и апоптоз Как общаются животные
Как общаются животные Зимующие птицы
Зимующие птицы Обрезка плодовых деревьев и кустарников
Обрезка плодовых деревьев и кустарников Отдел плауновидные. Отдел хвощевидные
Отдел плауновидные. Отдел хвощевидные Transcription and Translation and the Genetic Code
Transcription and Translation and the Genetic Code Онтогенез. Типы онтогенеза
Онтогенез. Типы онтогенеза Дыхательная система
Дыхательная система