Содержание
- 2. В Н Е Ш Н И Й О Б М Е Н Н У К Л
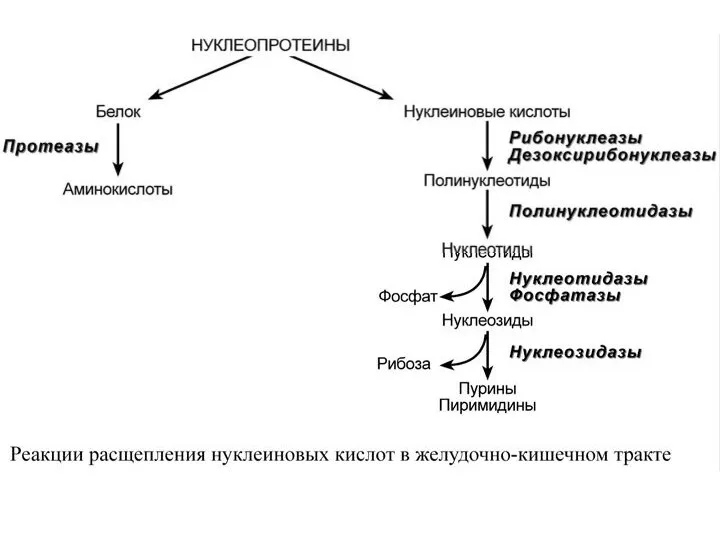
- 4. После действия панкреатических нуклеаз полинуклеотидазы (или фосфодиэстеразы) кишечника гидролизуют нуклеиновые кислоты до мононуклеотидов. Далее, под действием
- 5. Таким образом, нуклеиновые кислоты пищи не поступают из кишечника в кровоток и не выступают в роли
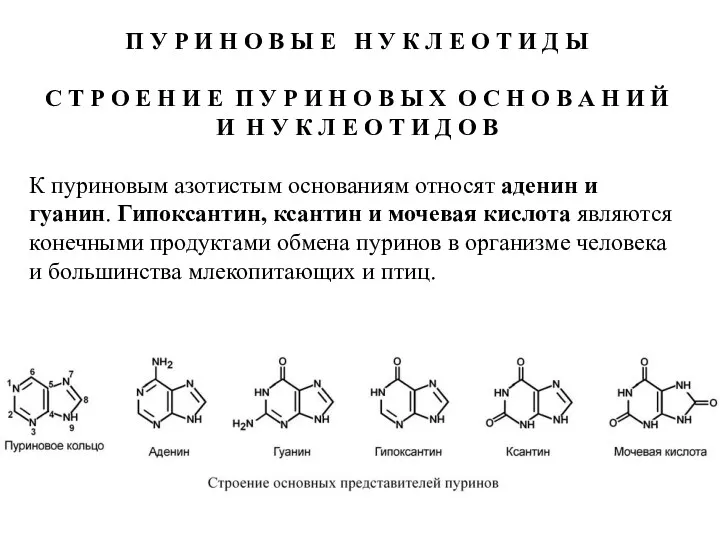
- 6. П У Р И Н О В Ы Е Н У К Л Е О Т
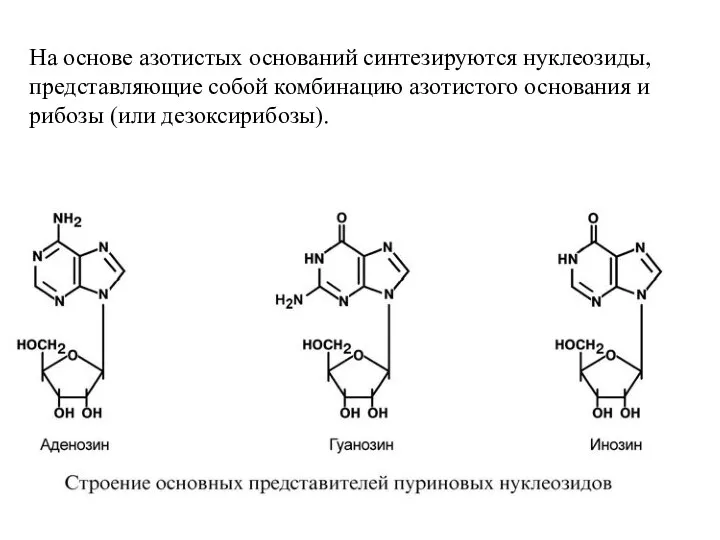
- 7. На основе азотистых оснований синтезируются нуклеозиды, представляющие собой комбинацию азотистого основания и рибозы (или дезоксирибозы).
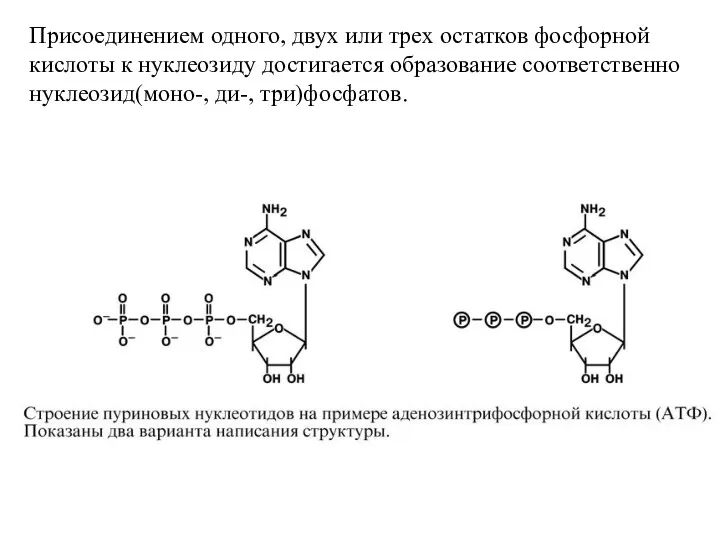
- 8. Присоединением одного, двух или трех остатков фосфорной кислоты к нуклеозиду достигается образование соответственно нуклеозид(моно-, ди-, три)фосфатов.
- 9. С И Н Т Е З П У Р И Н О В Ы Х О
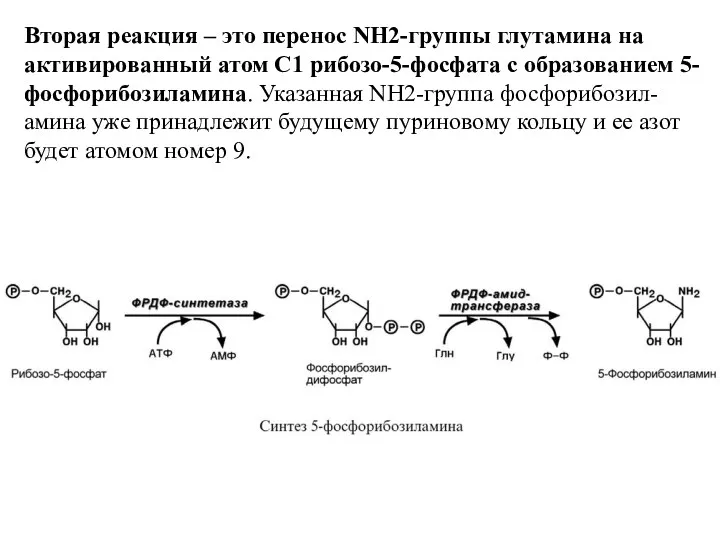
- 10. Вторая реакция – это перенос NH2-группы глутамина на активированный атом С1 рибозо-5-фосфата с образованием 5-фосфорибозиламина. Указанная
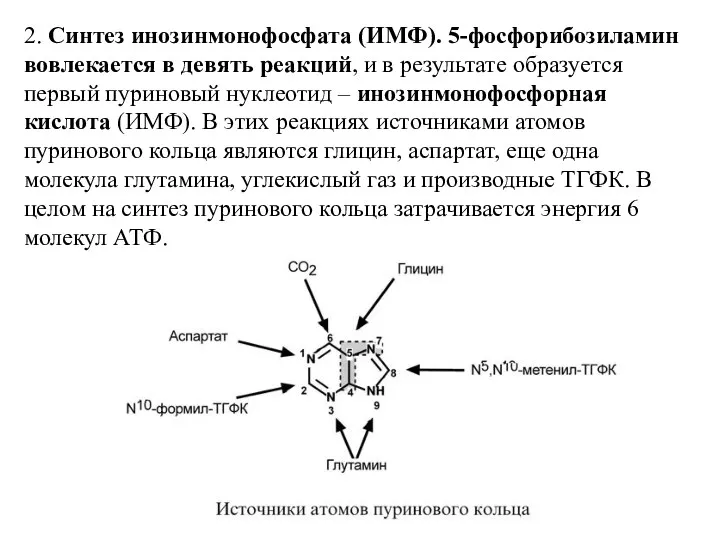
- 11. 2. Синтез инозинмонофосфата (ИМФ). 5-фосфорибозиламин вовлекается в девять реакций, и в результате образуется первый пуриновый нуклеотид
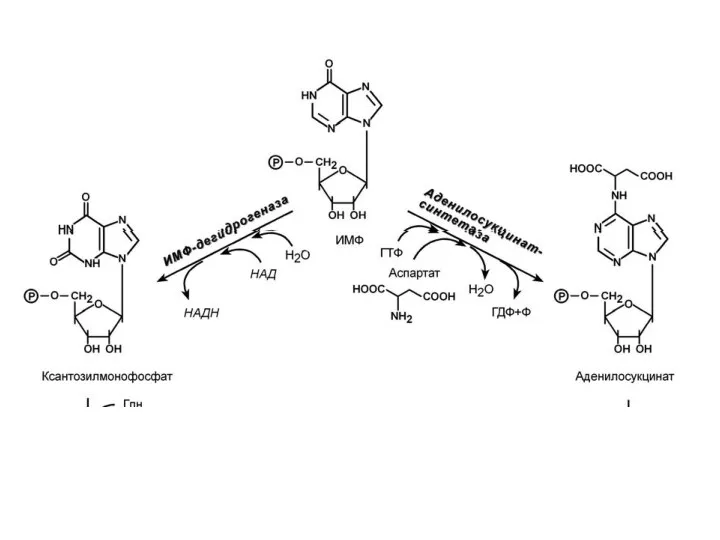
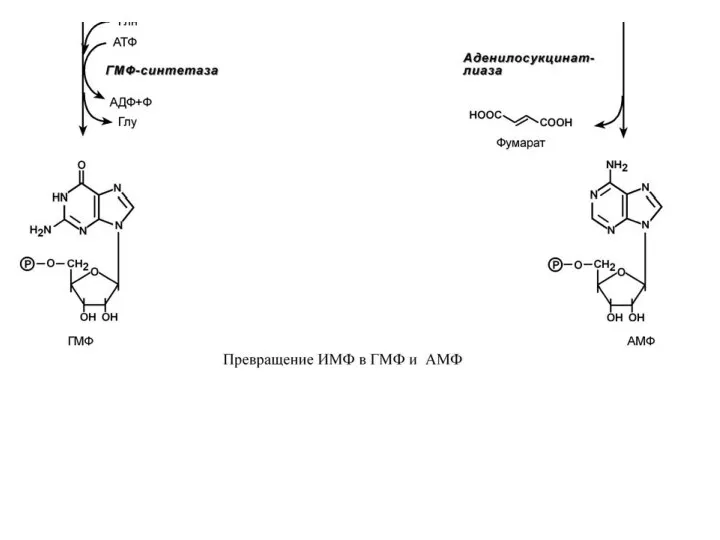
- 12. 3. Синтез аденозинмонофосфата (АМФ) и гуанозинмонофосфата (ГМФ). ГМФ образуется в двух реакциях – сначала он окисляется
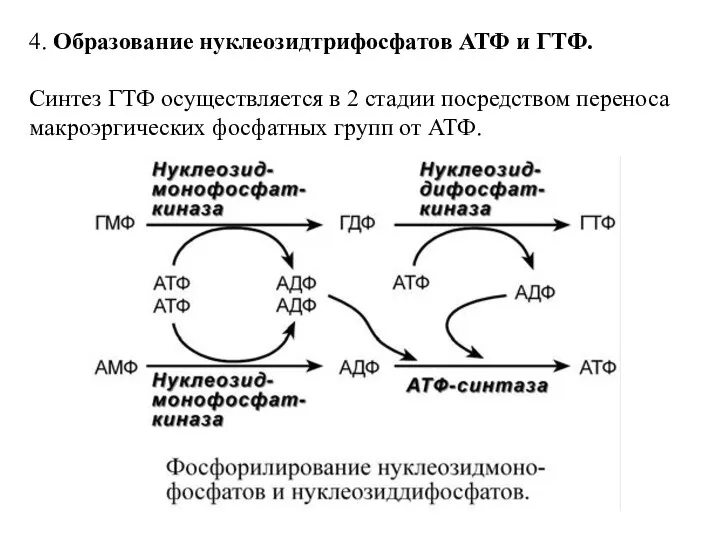
- 15. 4. Образование нуклеозидтрифосфатов АТФ и ГТФ. Синтез ГТФ осуществляется в 2 стадии посредством переноса макроэргических фосфатных
- 16. Синтез АТФ происходит несколько иначе. АДФ из АМФ образуется также за счет макроэргических связей АТФ. Для
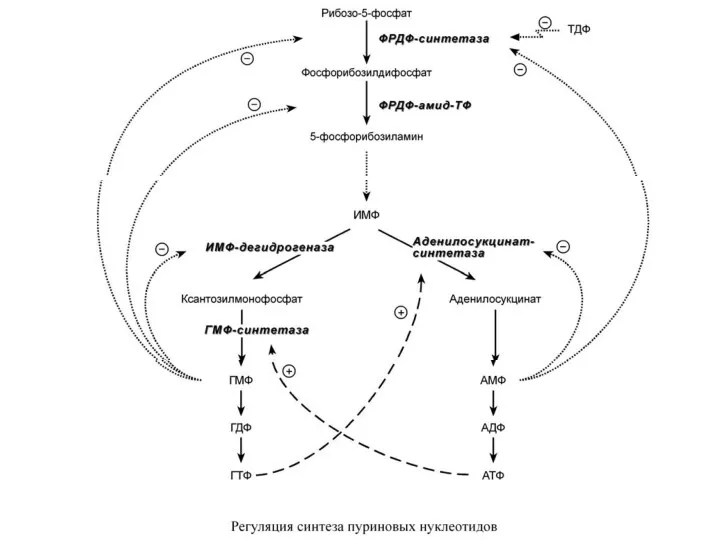
- 17. Р Е Г У Л Я Ц И Я С И Н Т Е З А
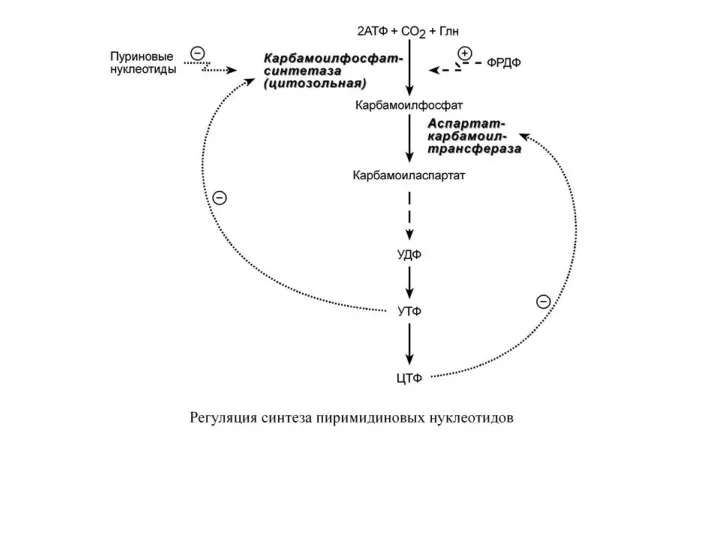
- 18. Кроме этого, имеется положительная перекрестная регуляция со стороны АТФ и ГТФ, а именно – как участник
- 19. Лекарственная регуляция При разработке новых противоопухолевых средств были предложены ингибиторы таких ферментов как ФРДФ-амидтрансфераза (азосерин, диазонорлейцин),
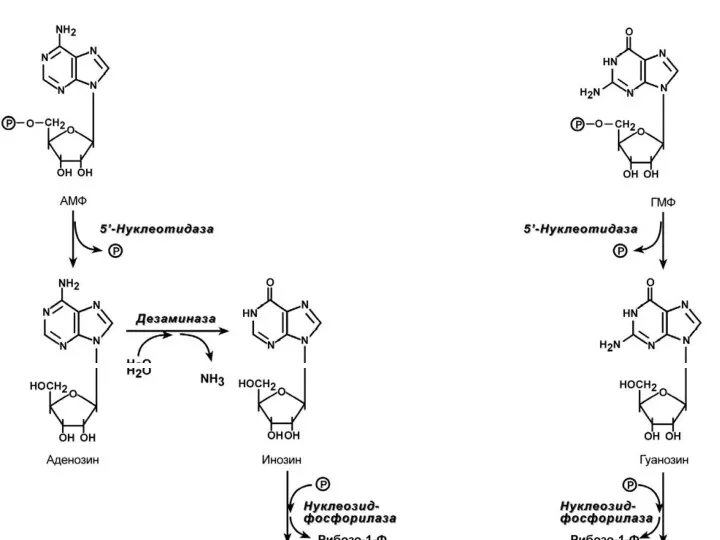
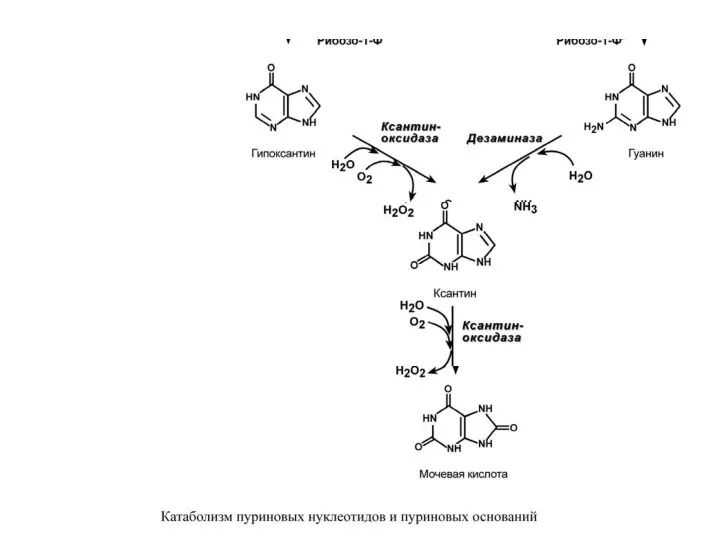
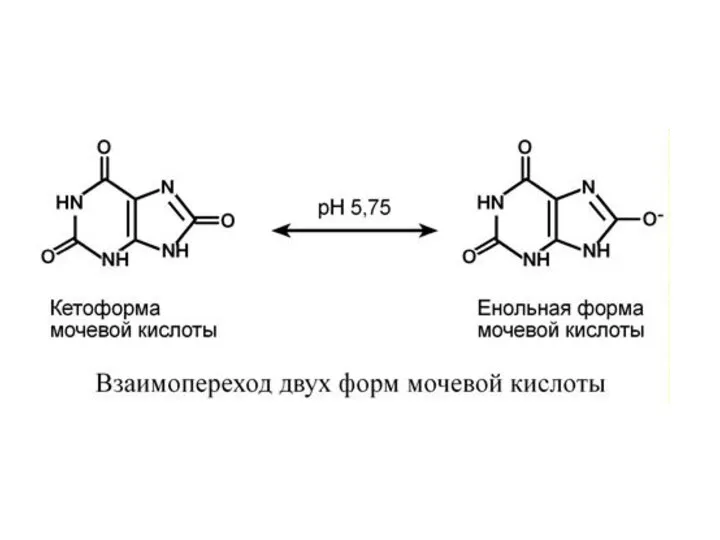
- 21. Р А С П А Д П У Р И Н О В Ы Х Н
- 24. Около 20% мочевой кислоты удаляется с желчью через кишечник, где она разрушается микрофлорой до CO2 и
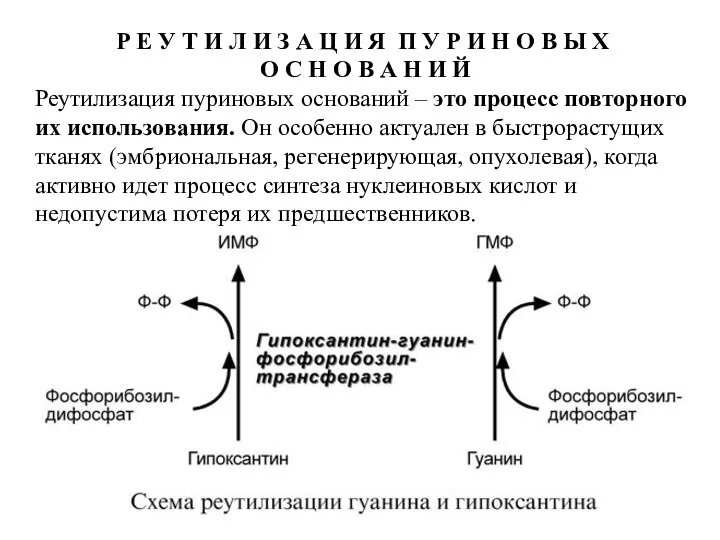
- 25. Р Е У Т И Л И З А Ц И Я П У Р И
- 26. Сущность реутилизации заключается в присоединении к аденину, гуанину или гипоксантину рибозо-5-фосфата и образовании АМФ, ГМФ или
- 27. Н А Р У Ш Е Н И Е О Б М Е Н А П
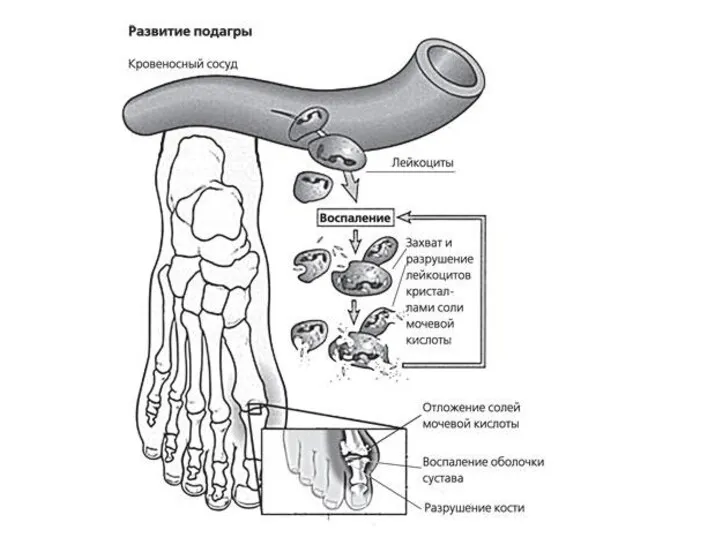
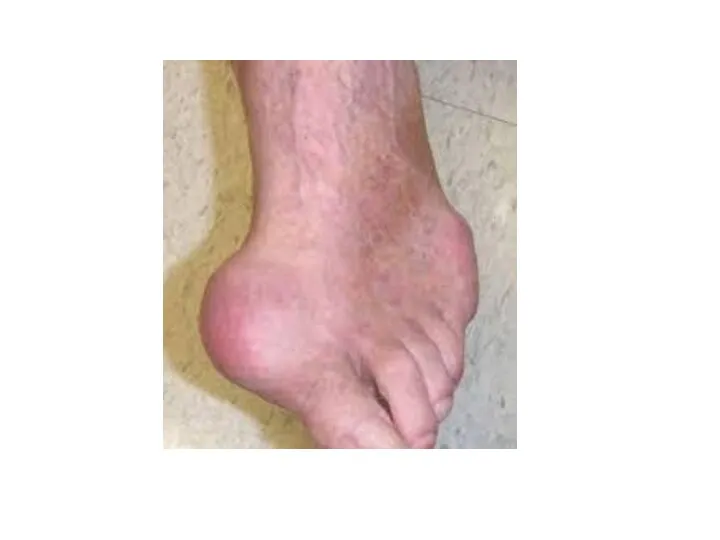
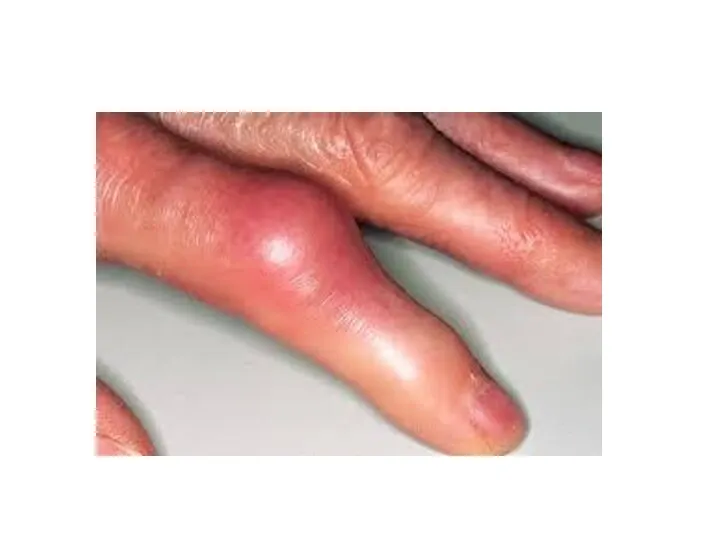
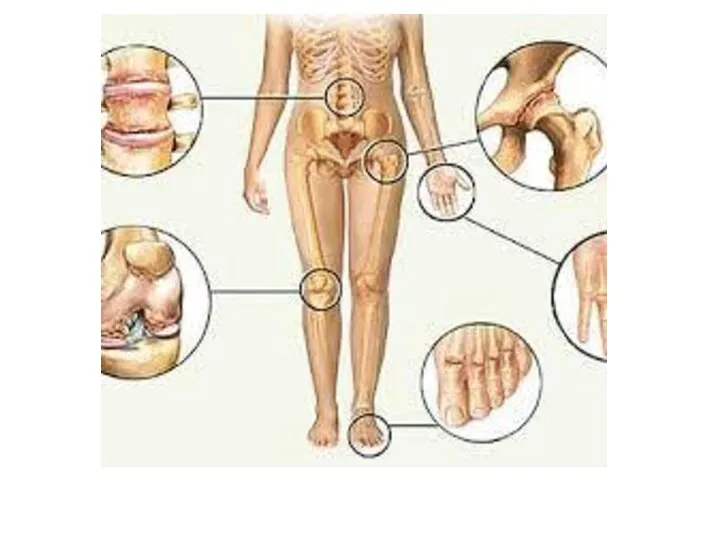
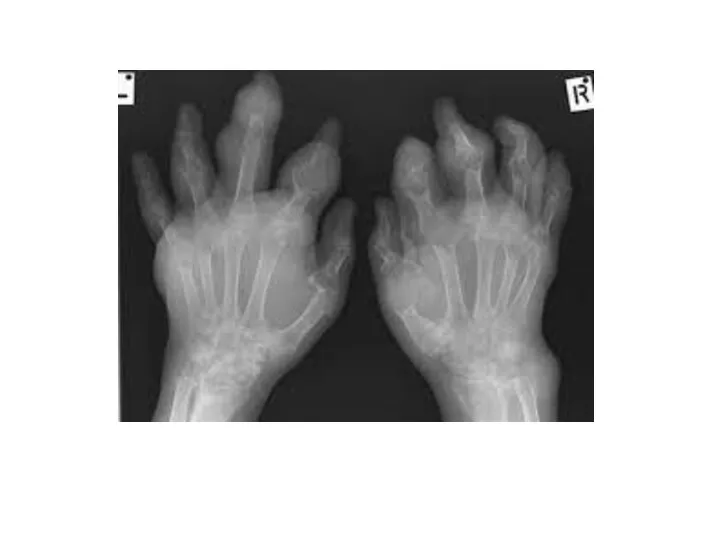
- 28. ПОДАГРА Когда гиперурикемия принимает хронический характер, говорят о развитии подагры (греч. poclos – нога, agra –
- 29. Длительное время подагру считали "болезнью гурманов", однако затем внимание исследователей переместилось к наследственному изменению активности ферментов
- 37. Основы лечения Диета – снижение поступления предшественников мочевой кислоты с пищей и уменьшение ее образования в
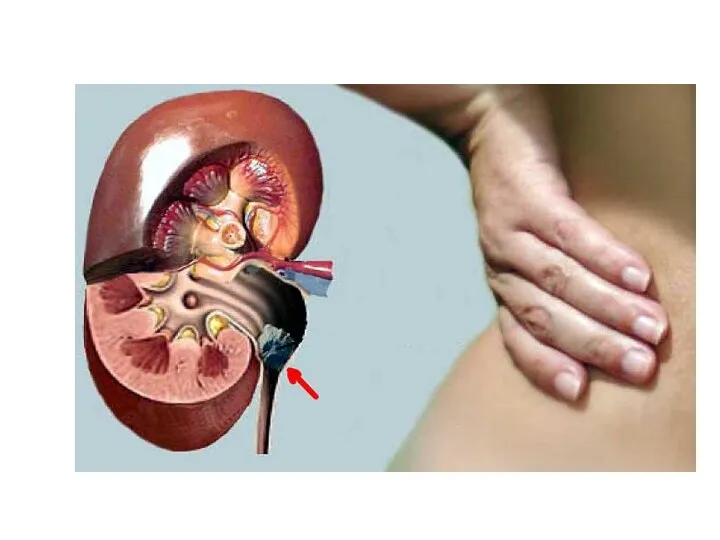
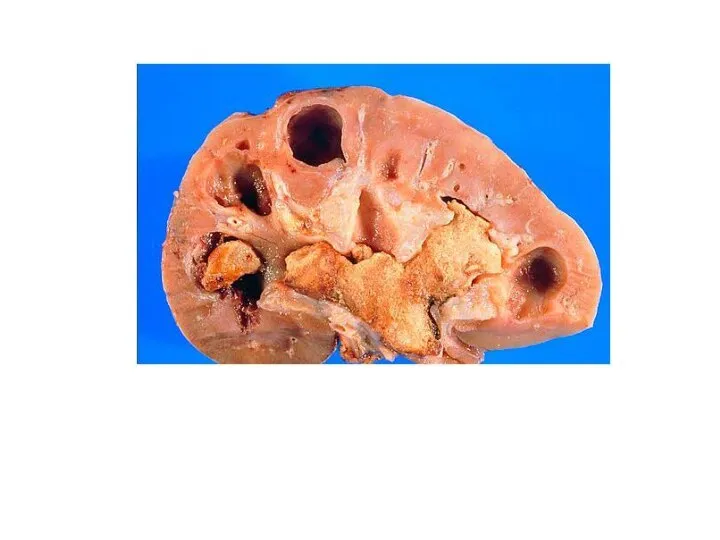
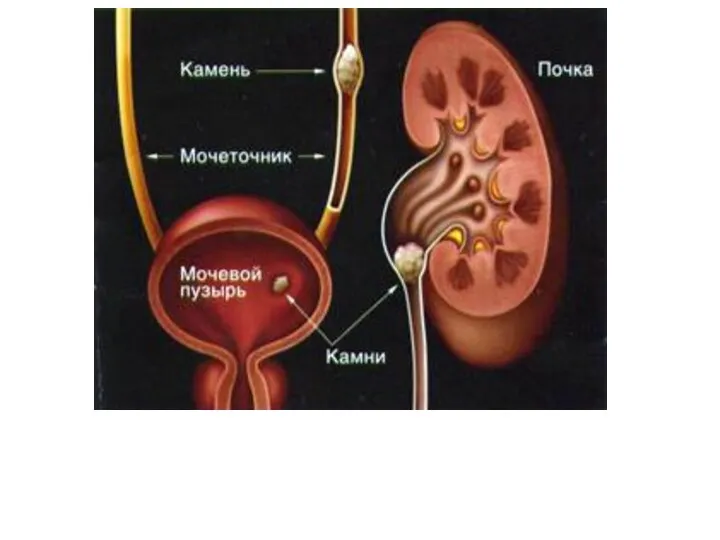
- 39. МОЧЕКАМЕННАЯ БОЛЕЗНЬ Мочекаменная болезнь заключается в образовании кристаллов (камней) в мочевыводящих путях. Мочекислые камни в мочевыводящих
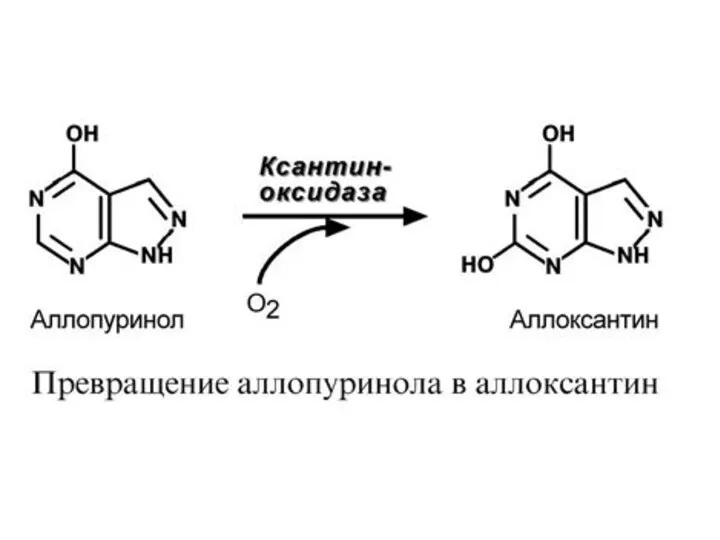
- 46. Основы лечения Так же, как при подагре, лечение сводится к беспуриновой диете и использованию аллопуринола. В
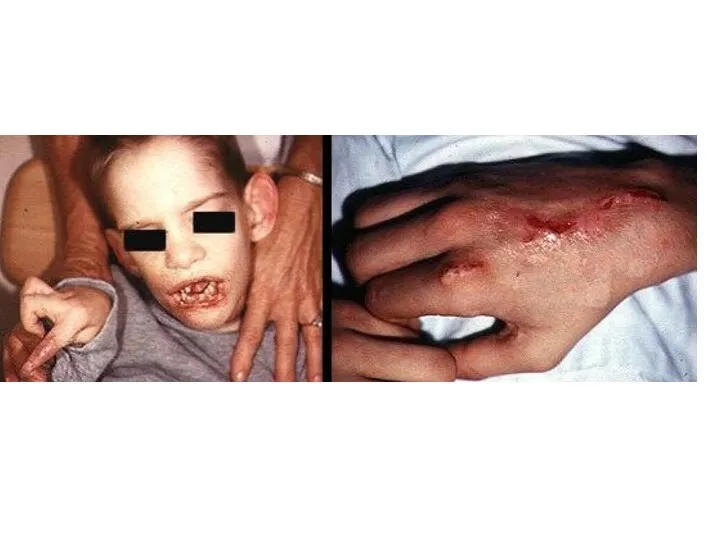
- 47. СИНДРОМ ЛЕША-НИХАНА Болезнь Леша-Нихана – это полное врожденное отсутствие активности гипоксантин-гуанин-фосфорибозил-трансферазы, фермента, отвечающего за реутилизацию пуриновых
- 48. Дети рождаются клинически нормальными, только к 4-6 месяцу обнаруживаются отклонения в развитии, а именно – отставание
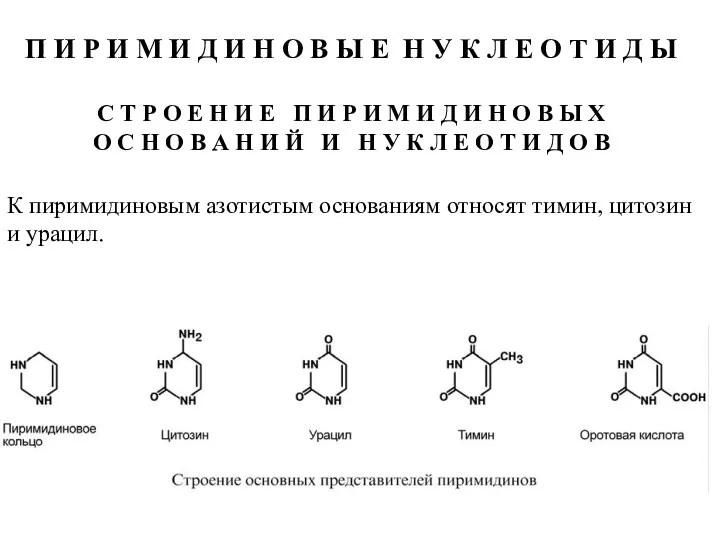
- 50. П И Р И М И Д И Н О В Ы Е Н У К
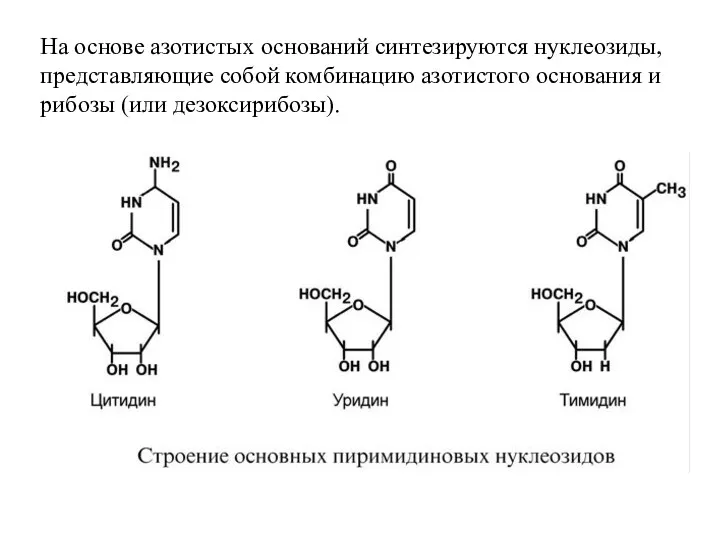
- 51. На основе азотистых оснований синтезируются нуклеозиды, представляющие собой комбинацию азотистого основания и рибозы (или дезоксирибозы).
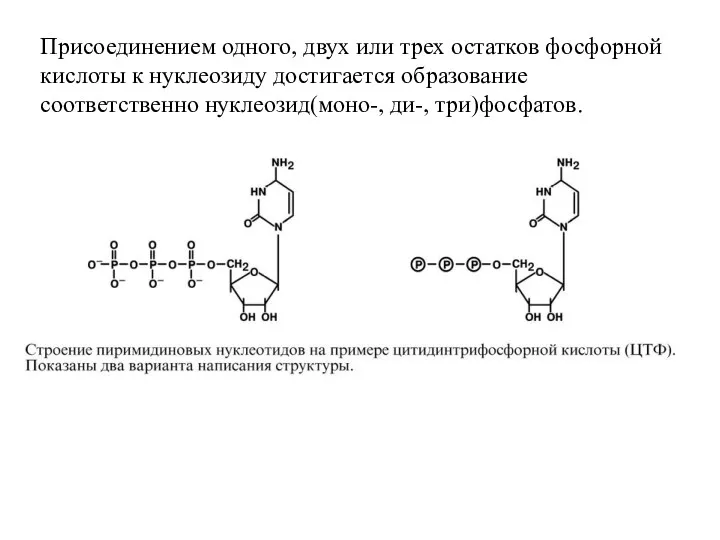
- 52. Присоединением одного, двух или трех остатков фосфорной кислоты к нуклеозиду достигается образование соответственно нуклеозид(моно-, ди-, три)фосфатов.
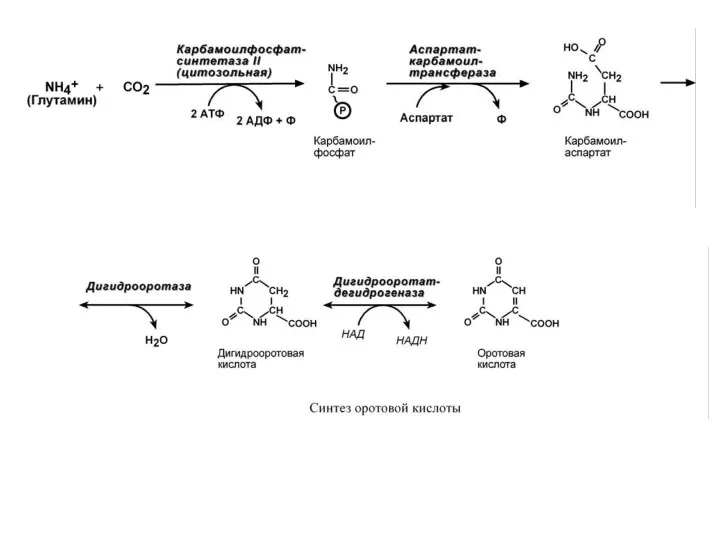
- 53. С И Н Т Е З П И Р И М И Д И Н О
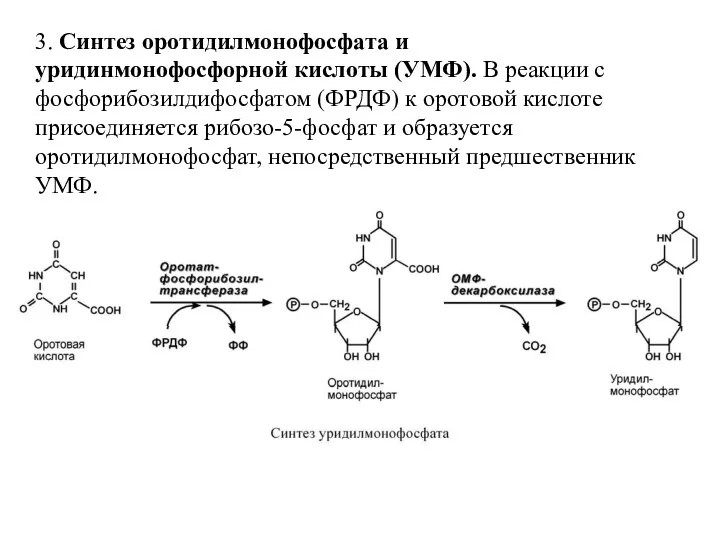
- 55. 3. Синтез оротидилмонофосфата и уридинмонофосфорной кислоты (УМФ). В реакции с фосфорибозилдифосфатом (ФРДФ) к оротовой кислоте присоединяется
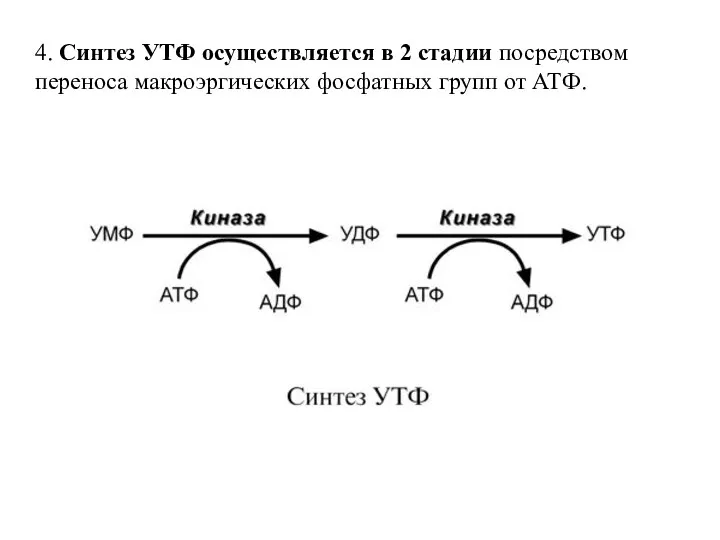
- 56. 4. Синтез УТФ осуществляется в 2 стадии посредством переноса макроэргических фосфатных групп от АТФ.
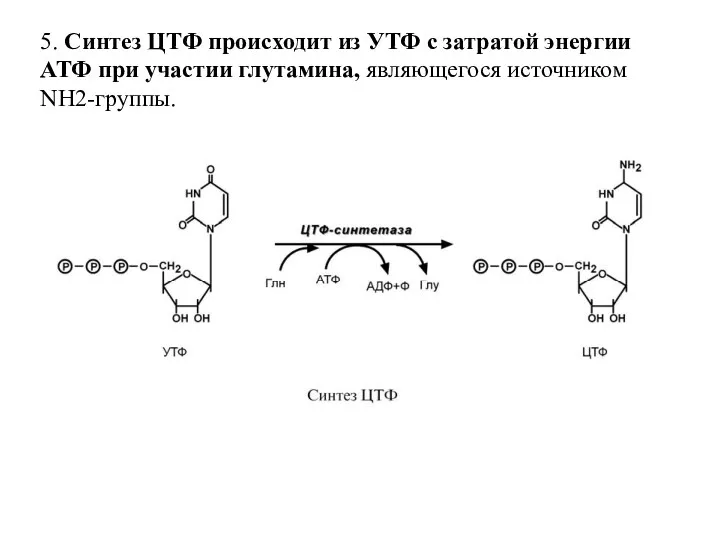
- 57. 5. Синтез ЦТФ происходит из УТФ с затратой энергии АТФ при участии глутамина, являющегося источником NH2-группы.
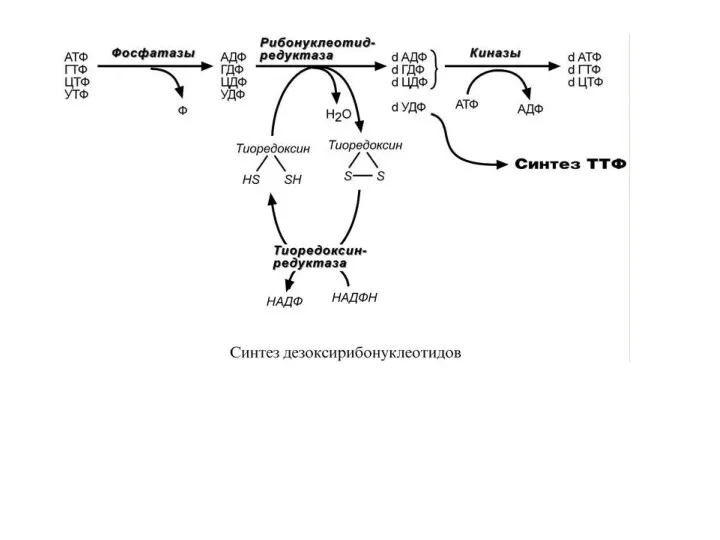
- 58. С И Н Т Е З Д Е З О К С И Р И Б
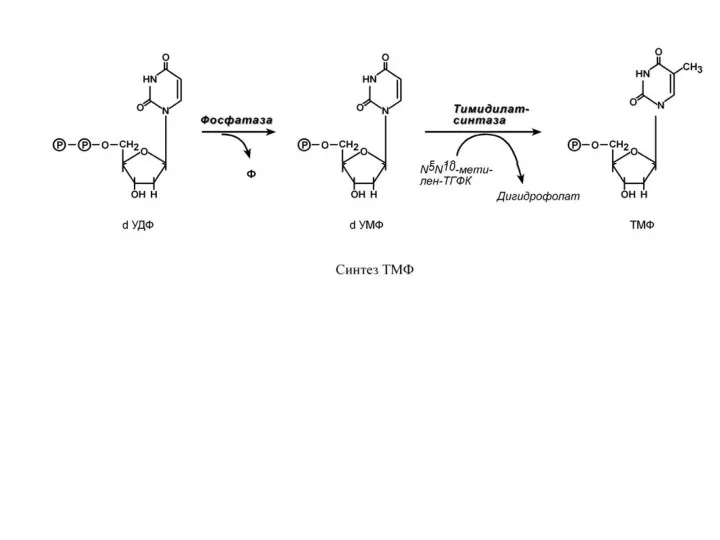
- 60. С И Н Т Е З Т И М И Д И Л Т Р И
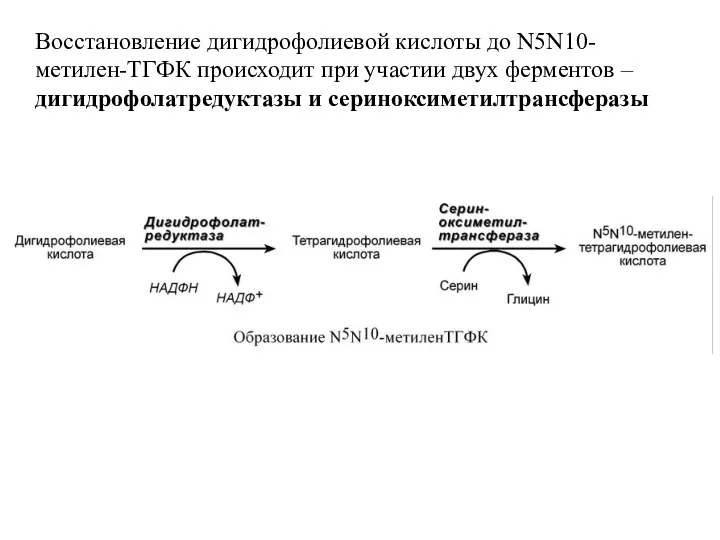
- 62. Восстановление дигидрофолиевой кислоты до N5N10-метилен-ТГФК происходит при участии двух ферментов – дигидрофолатредуктазы и сериноксиметилтрансферазы
- 63. Р Е Г У Л Я Ц И Я С И Н Т Е З А
- 65. Лекарственная регуляция Исключительная роль тимидилатсинтазы в синтезе ТМФ обусловила поиск и использование ее ингибиторов для прекращения
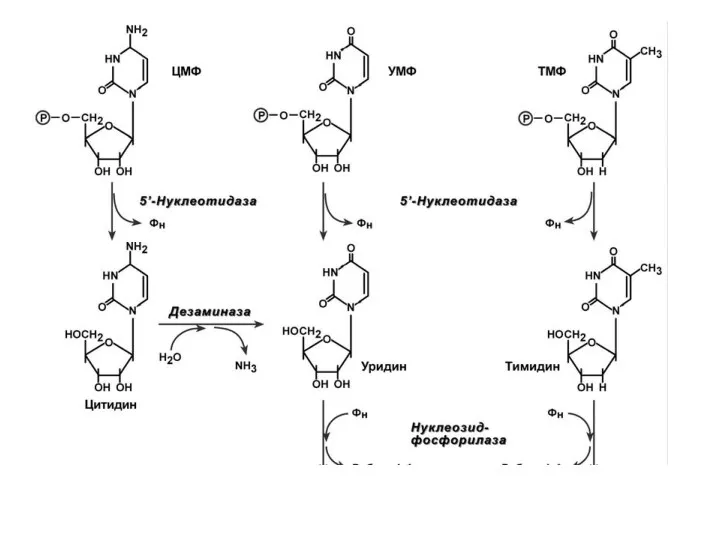
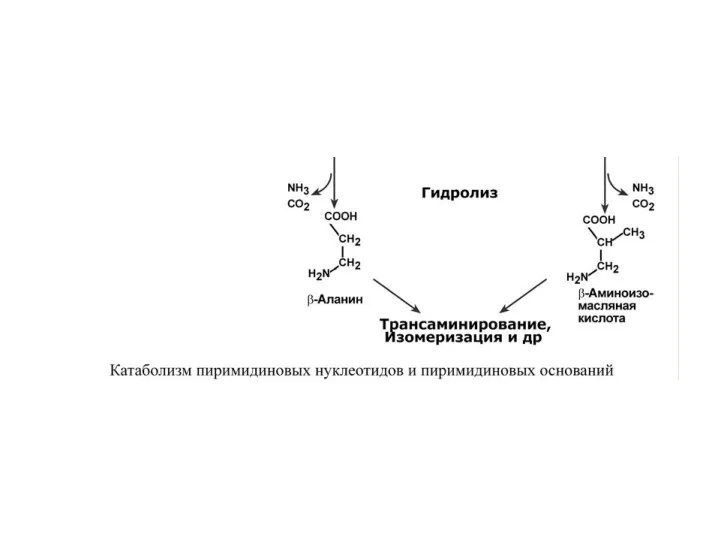
- 66. Р А С П А Д П И Р И М И Д И Н О
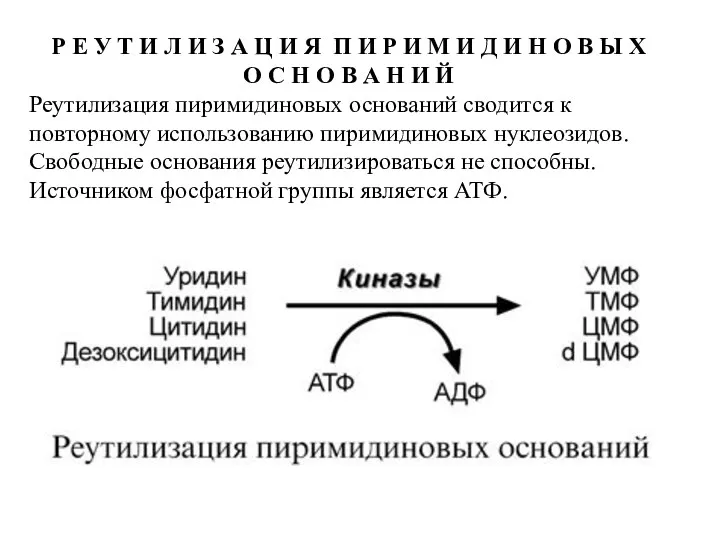
- 70. Р Е У Т И Л И З А Ц И Я П И Р И
- 71. Н А Р У Ш Е Н И Е О Б М Е Н А П
- 72. ОРОТАТАЦИДУРИЯ Оротатацидурия (или оранжевая кристаллоурия) может быть наследственной и приобретенной. Наследственная форма Наследственная форма оротатацидурии весьма
- 73. При отсутствии лечения гибель наступает в первые годы жизни. Однако, так как первопричиной заболевания является "пиримидиновый
- 75. Скачать презентацию


































 Психология и социобиология половых различий
Психология и социобиология половых различий Значение водорослей в природе и жизни человека
Значение водорослей в природе и жизни человека Вегетативная (автономная) нервная система
Вегетативная (автономная) нервная система Общая вирусология
Общая вирусология Практическая работа: Асимметрия головного мозга
Практическая работа: Асимметрия головного мозга Презентация Лист. внешнее и внутреннее строение.
Презентация Лист. внешнее и внутреннее строение. Химиотерапевтические препараты. Антибиотики. Бактериофаги
Химиотерапевтические препараты. Антибиотики. Бактериофаги Организация выращивания технического каннабиса и производства промышленных продуктов из него
Организация выращивания технического каннабиса и производства промышленных продуктов из него Популяция. Факторы эволюции. Дрейф генов. Изоляция
Популяция. Факторы эволюции. Дрейф генов. Изоляция Уход за домашними животными. Тест (окружающий мир, 1 класс)
Уход за домашними животными. Тест (окружающий мир, 1 класс) Центры происхождения комнатных растений. Многообразие растений
Центры происхождения комнатных растений. Многообразие растений Антропогенез. Гипотезы возникновения человека. Сходство и различия человека и животных
Антропогенез. Гипотезы возникновения человека. Сходство и различия человека и животных Репродуктивное здоровье - составляющая здоровья человека и общества
Репродуктивное здоровье - составляющая здоровья человека и общества Органикалық қосылыстардың табиғаттағы және адам өміріндегі маңызы
Органикалық қосылыстардың табиғаттағы және адам өміріндегі маңызы Начальные этапы биологической эволюции
Начальные этапы биологической эволюции Значение воды в жизни растений
Значение воды в жизни растений презентация Необычные растения
презентация Необычные растения Жизнь на материке Африка
Жизнь на материке Африка Inheritance, Variation and Evolution Variation
Inheritance, Variation and Evolution Variation Тип Членистоногие
Тип Членистоногие Разнообразие растений
Разнообразие растений Такая неизвестная известная гидра
Такая неизвестная известная гидра Семейство растений пасленовые
Семейство растений пасленовые Теория эволюции
Теория эволюции Семейство паслёновые
Семейство паслёновые Пленки Лэнгмюра - Блоджетт
Пленки Лэнгмюра - Блоджетт Урок биологии и презентация Биологические добавки для 10 кл.
Урок биологии и презентация Биологические добавки для 10 кл. Ластоногие. Семейство Моржовые
Ластоногие. Семейство Моржовые