Слайд 2

Биохимия – наука о химическом составе живых организмов и химических процессах
в них протекающих.
Слайд 3

Основные разделы биохимии:
1 – статическая
2 – динамическая
3 – функциональная
Слайд 4

Задачи
статической БХ – изучение химического состава организмов и структуры составляющих их
молекул (белков, аминокислот, нуклеиновых кислот, нуклеотидов, углеводов, липидов, витаминов, гормонов)
Слайд 5

динамической БХ - изучение химических превращений, происходящих в процессе жизнедеятельности организма
функциональной
БХ - изучение химических основ функционирования отдельных органов и тканей.
Слайд 6

Биохимия человека
Молекулярная биология
Генная инженерия
Биотехнология
Медицинская биохимия
Экологическая биохимия
Эволюционная биохимия
Квантовая биохимия
и т.д.
Слайд 7

Константин Сигизмундо-вич Кирхгоф (русский химик, академик Петербург-ской АН
(1764-1833)
Слайд 8

Академик А.Я. Данилевский - один из основопо-ложников биохимии в России
(1838-1923)
Слайд 9

Николай Иванович Лунин
(1853-1937)
Слайд 10

немецкий химик Эмиль Фишер (1853-1919)
Слайд 11

Алексей Николаевич Бах
(1857-1948)
Слайд 12

Альберт Лестер Ленинджер –один из осново-положников биоэнер-гетики (1917-1986)
Слайд 13

Энгельгардт Владимир Александ-рович
(1894 -1984)
Слайд 14

Белки - это полипептиды, способные самопроизвольно формировать и удерживать определенную пространственную
структуру.
Слайд 15

Функции белков
каталитическая (ферменты),
регуляторная (гормоны),
строительная (структурообрузующие белки),
двигательная (сократит. белки),
транспортная
защитная
(антитела),
энергетическая (белки, уч-щие в энергетическом обмене)
Слайд 16

В 1952 г. датский биохимик К. Линдерштрем-Ланг предложил рассматривать четыре уровня
организации белковой молекулы: первичную, вторичную, третичную и четвертичную структуры.
Слайд 17

Слайд 18
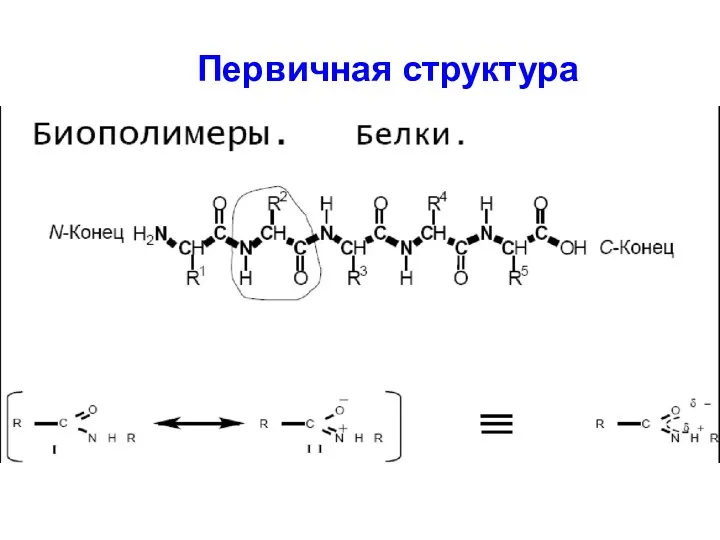
Слайд 19
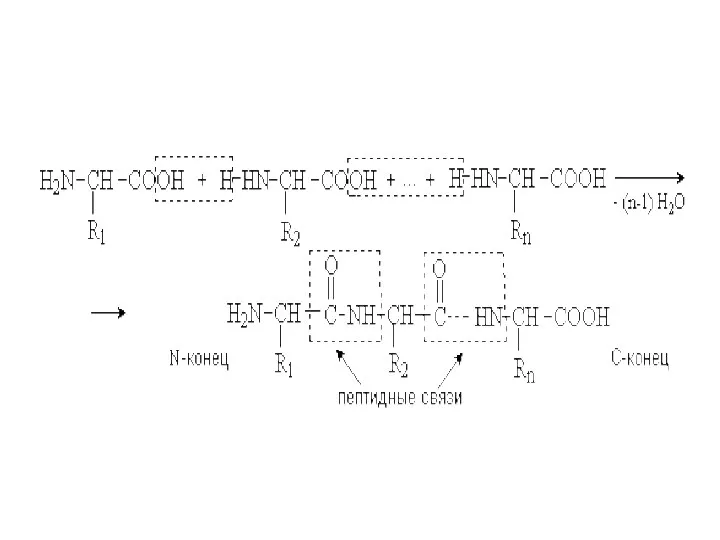
Слайд 20
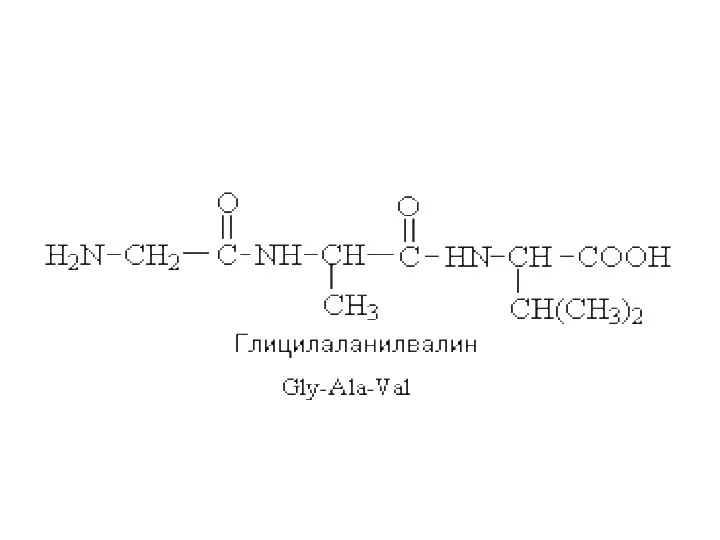
Слайд 21

Свойства пептидной связи:
на 10% короче одинарной связи (1,53 Å)
расположение С и
N в одной плоскости
постоянное перемещение электрона между O и N, что приводит к образованию частично двойной связи.
возможно образование цис-транс изомерии относительно пептидной связи
возможность образования водородной связи засчет Н пептидной группы
Слайд 22

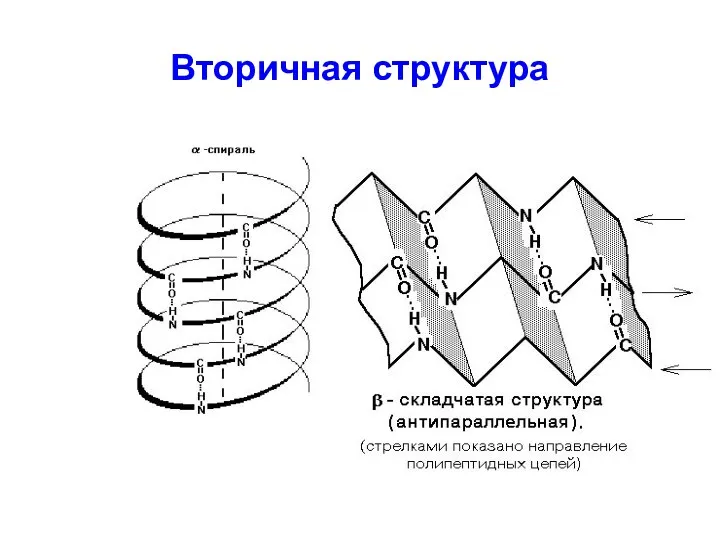
Вторичная структура -
пространственное расположение атомов главной цепи молекулы белка на отдельных
ее участках.
Надвторичные структуры - термодинамически или кинетически стабильные комплексы альфа-спиралей и бета-структур, формирующиеся за счет межрадикальных взаимодействий.
Слайд 23
Слайд 24

Слайд 25

Области с нерегулярной вторичной структурой – беспорядочный клубок
Слайд 26

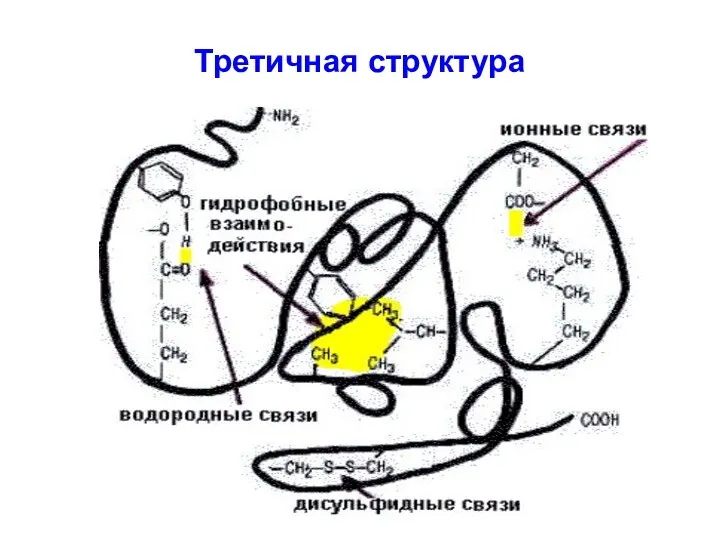
Пространственная структура каждого белка индивидуальна и определяется его первичной структурой.
Но
у разных белков есть похожие сочетания элементов вторичной структуры – это называют супервторичной структурой («структурные мотивы»: α/β бочонок, цинковый палец, лейциновая застежка-молния и т.д.)
Слайд 27
Слайд 28
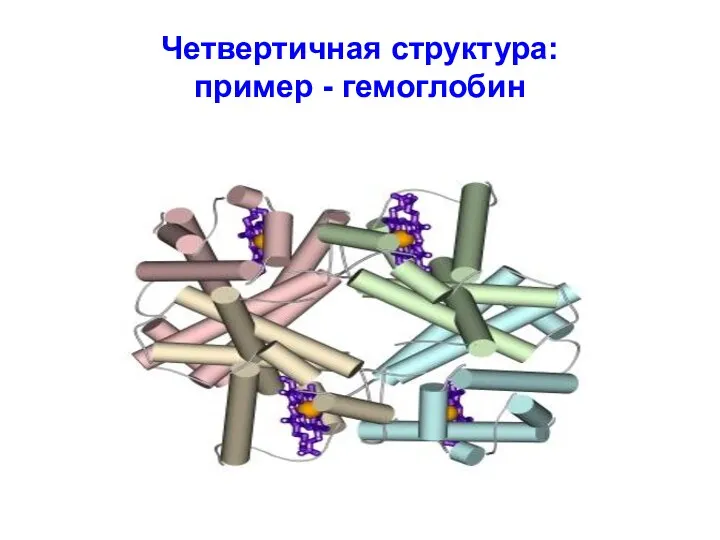
Четвертичная структура: пример - гемоглобин
Слайд 29

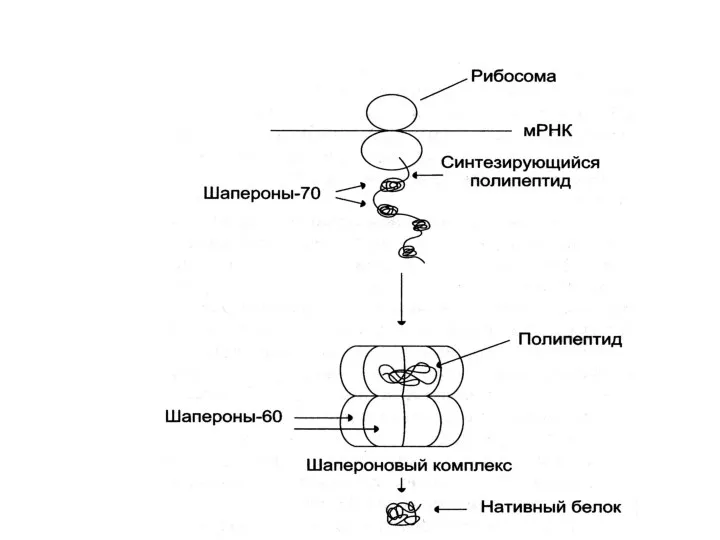
Фолдинг – укладка белка в пространстве (формирование вторичной, третичной структуры)
Слайд 30
Слайд 31

«Шапероны» - белки, помогающие синтезируемому белку быстро найти правильную пространственную ориентацию
Впервые
были обнаружены при перегреве организма → белки теплового шока
Слайд 32

ШП много в функционально активных тканях: эмбриональной, лимфатической, яичников и т.д.
Слайд 33

Физико-химические свойства белков
Белки – высокомолекулярные соединения, их Mr 6000 -1 000
000 Д и выше.
По форме молекул белки делят на глобулярные и фибриллярные.
Слайд 34

Коллоидные свойства:
высокая вязкость и способность к гелеобразованию,
способность к набуханию,
неспособность
проникать через полупроницаемые мембраны,
незначительная диффузия,
низкое осмотическое и высокое онкотическое давление,
оптические свойства
Слайд 35

Растворы белков обладают характерной опалесценцией.
Эффект Тиндаля: при боковом освещении лучи
света образуют светящийся конус
Слайд 36

Способность к ионизации
Определяется наличием в составе белка аминокислот: диаминомонокарбоновых - асп,
глу и моноаминодикарбоновых - лиз, арг, гис
Слайд 37

Суммарный заряд белка зависит
от рН среды:
в кислой среде
-СОО- +
Н+ → -СООН
в щелочной среде
-NH3+ +ОН- → -NH2 + H2O
Слайд 38

→ подвижность в электрическом поле
Значение рН, при котором белок электронейтрален, называется
изоэлектрической точкой
Слайд 39

Растворимость и осаждаемость белков
Растворимость белков в воде зависит от: формы,
молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка
Слайд 40

Осаждение белков:
1. Высаливание нейтральными солями, н-р, (NH4)SO4 - обратимый процесс,
белок теряет гидратную оболочку, нативные свойства сохраняются .
Слайд 41

2. Осаждение белков с потерей нативных свойств: с белка снимается гидратная
оболочка и заряд, нарушаются различные свойства в белке. Н-р, соли Cu, Hg, As, Fe, концентрированные неорганические кислоты - HNO3, H2SO4, HCl, органические кислоты, алкалоиды - танины, йодистая ртуть.
Слайд 42

Необратимое осаждение белка - денатурация
1. Физические факторы денатурации:
температура, давление, механическое воздействие,
ультразвуковое и ионизирующее излучение.
2. Химические факторы денатурации:
кислоты, щелочи, органические растворители, детергенты, тяжелые металлы, алкалоиды.
Слайд 43

Ренатурация (ренативация) – обратимый процесс денатурации
Процесс восстановления физико-химических и биологических свойств
денатурированного белка после удаления денатурирующих веществ.
Слайд 44

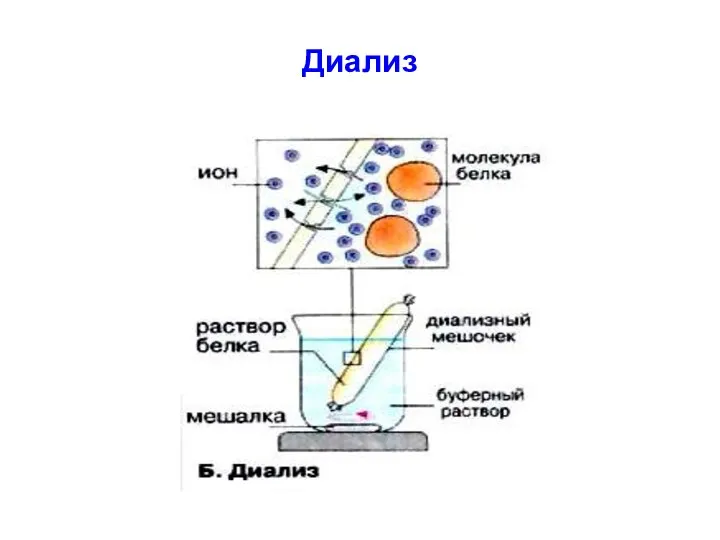
Методы выделения и очистки белков
гомогенизация - клетки растираются до однородной
массы;
экстракция белков водными или водно-солевыми растворами;
высаливание;
диализ / гель-фильтрация;
электрофорез;
хроматография;
ультрацентрифугирование.
Слайд 45

Для обнаружения белков в растворе применяются:
цветные реакции
реакции осаждения
Слайд 46
Слайд 47
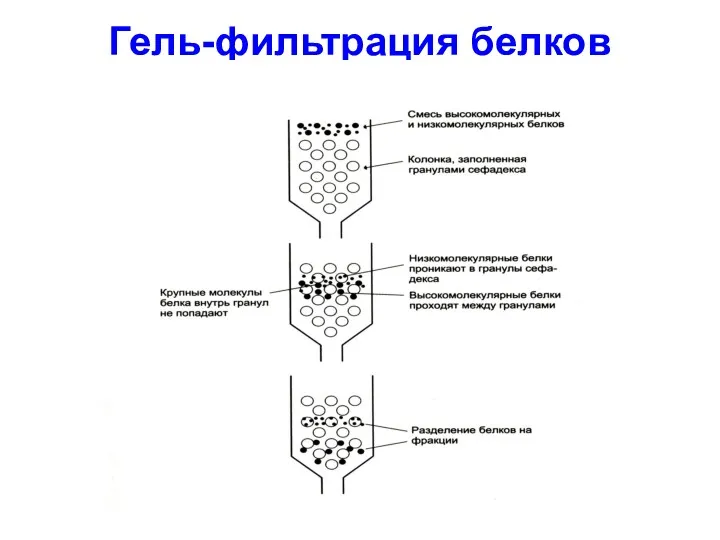
Слайд 48
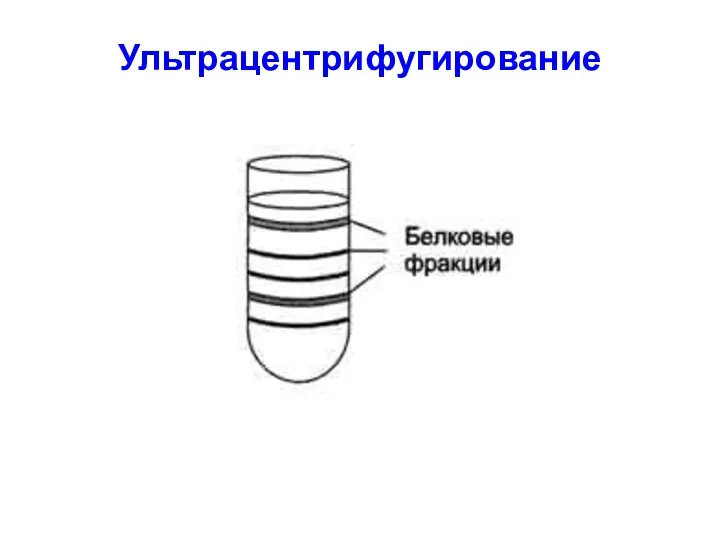
Слайд 49
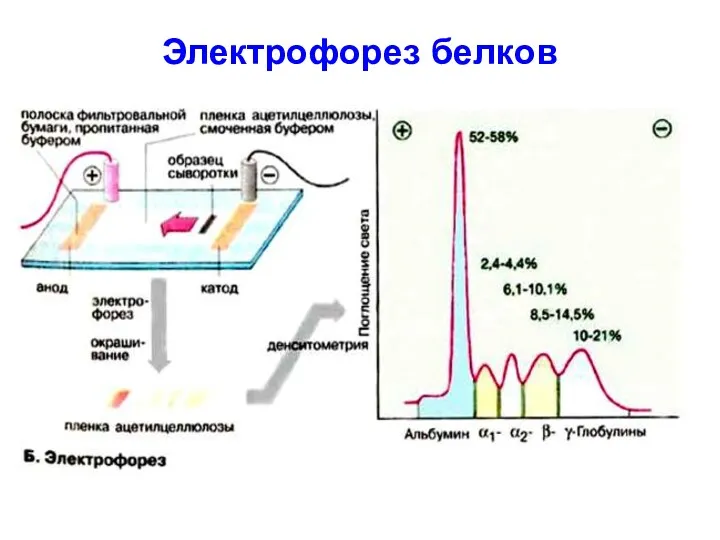
Слайд 50
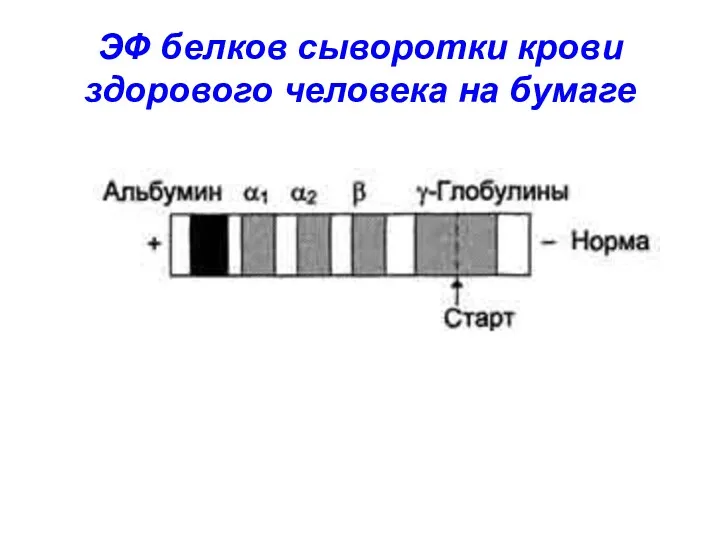
ЭФ белков сыворотки крови здорового человека на бумаге
Слайд 51
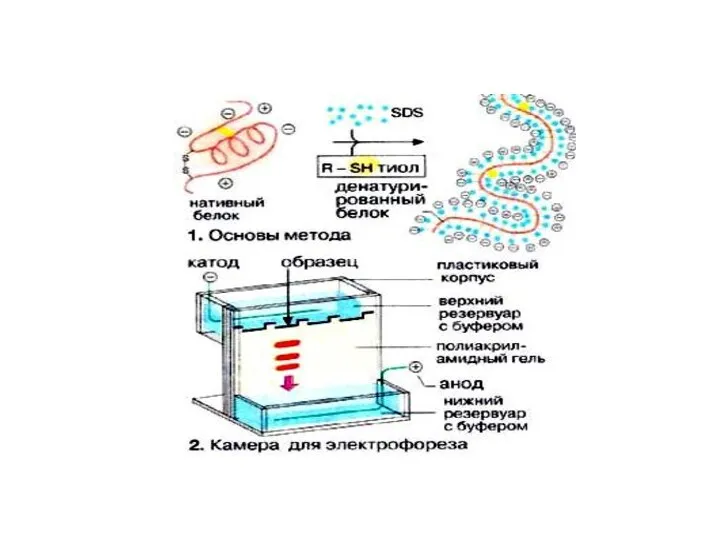
Слайд 52
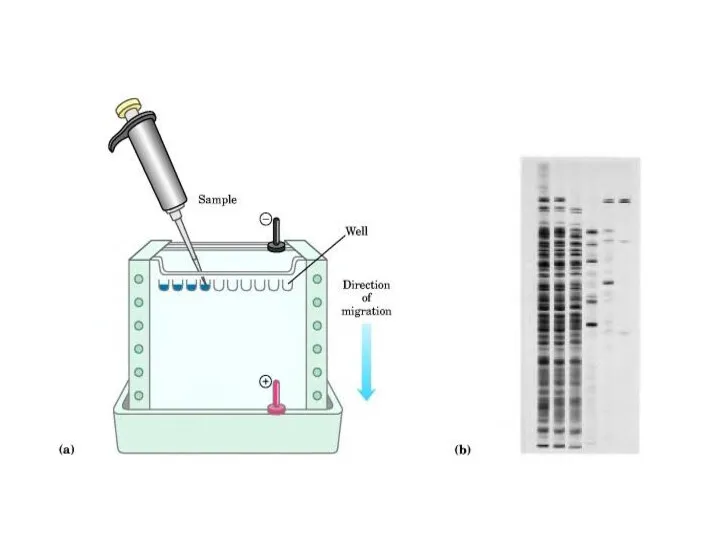
Слайд 53
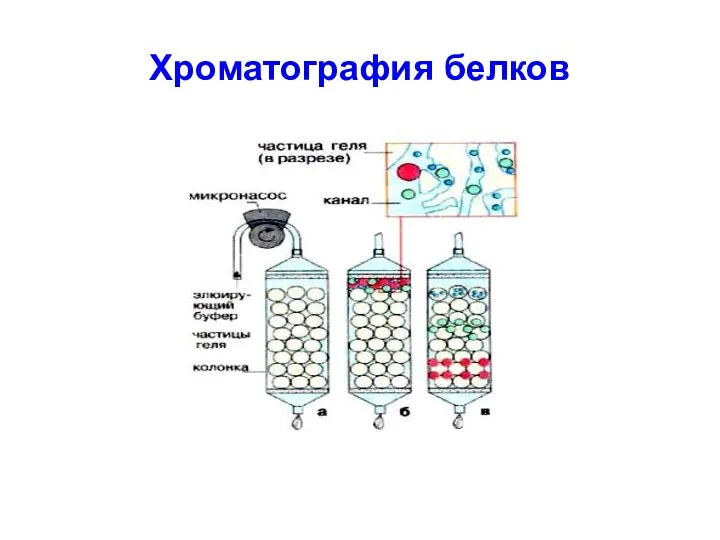
Слайд 54

Различают:
положительно заряженные анионообменники, н-р, диэтиламиноэтилцеллюлоза (ДЭАЭ-целлюлоза), содержащая катионные группы
отрицательно заряженные
катионообменники, н-р карбоксиметилцеллюлоза (КМ-целлюлоза), содержащая анионные группы.
Слайд 55

Слайд 56
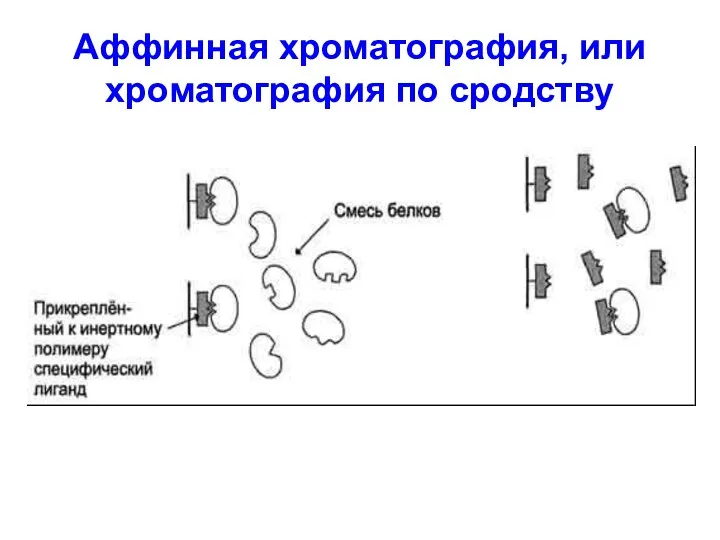
Аффинная хроматография, или хроматография по сродству
Слайд 57
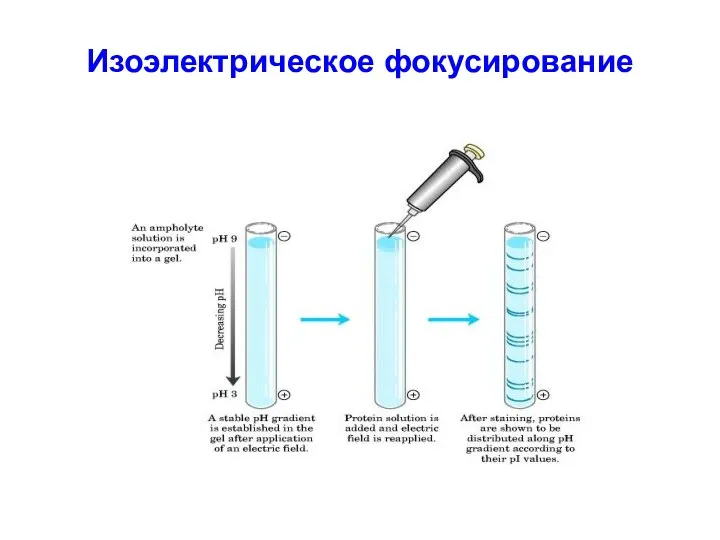
Изоэлектрическое фокусирование
Слайд 58

Определение мол.весов в SDS-ЭФ


















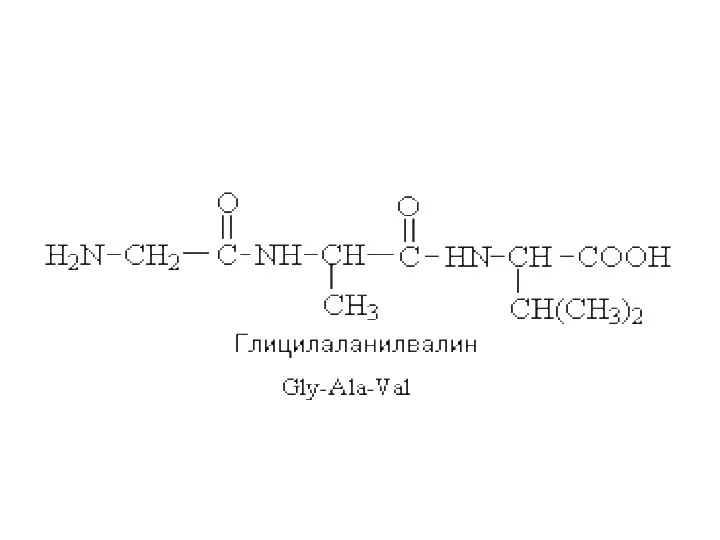






































 Побег и почки
Побег и почки Открытый урок на тему За здоровый образ жизни
Открытый урок на тему За здоровый образ жизни Красная книга
Красная книга урок - презентация по теме Эндокринная система
урок - презентация по теме Эндокринная система Митоз
Митоз Глаза - органы зрения
Глаза - органы зрения Полезные свойства мёда
Полезные свойства мёда презентация по краеведению город Владивосток
презентация по краеведению город Владивосток Обмін речовин та перетворення енергії в клітині
Обмін речовин та перетворення енергії в клітині Головоногие моллюски
Головоногие моллюски Презентация к уроку биологии Корень 6 класс
Презентация к уроку биологии Корень 6 класс Угадай микропрепарат
Угадай микропрепарат Естественный отбор. Формы естественного отбора. 9 класс
Естественный отбор. Формы естественного отбора. 9 класс Жылу реттелу физиологиясы
Жылу реттелу физиологиясы Разнообразие растительного мира
Разнообразие растительного мира Женская репродуктивная система
Женская репродуктивная система Моя кошка Муся. Фото
Моя кошка Муся. Фото Методы исследования микроорганизмов и использование бактерий в биоиндикации
Методы исследования микроорганизмов и использование бактерий в биоиндикации Алкалоиды природного происхождения
Алкалоиды природного происхождения Происхождение человека (теории происхождения человека)
Происхождение человека (теории происхождения человека) Биология и её роль в жизни человека
Биология и её роль в жизни человека Введение в анатомию человека. Опорно-двигательный аппарат
Введение в анатомию человека. Опорно-двигательный аппарат Молекулярный уровень
Молекулярный уровень Классификация гормонов
Классификация гормонов Неменделевская генетика. Условия действия законов Менделя
Неменделевская генетика. Условия действия законов Менделя 20230802_znatoki_prirody.ppt
20230802_znatoki_prirody.ppt Пищеварение в ротовой полости
Пищеварение в ротовой полости История развития биологических знаний. Предмет, задачи и методы биологии. Основные концепции современной биологии
История развития биологических знаний. Предмет, задачи и методы биологии. Основные концепции современной биологии