Содержание
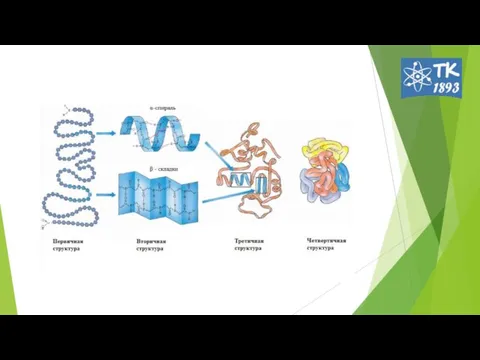
- 2. Первичная структура белков Первичная структура — последовательность аминокислот в полипептидной цепи.
- 3. Открытие первичной структуры инсулина Фредерик Сенгер (1918-2013) — английский биохимик, дважды лауреат Нобелевской премии по химии
- 4. Методы определения первичной структуры Метод Сэнджера Метод Эдмана реализован в секвенаторах
- 5. Открытие вторичной структуры Применяя шарнирные модели показал, что пептидная связь плоская, поэтому закручивается в спираль. Лайнус
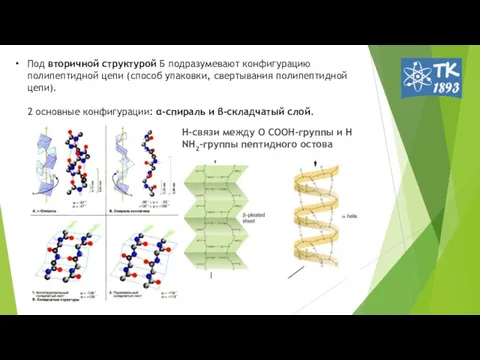
- 6. Под вторичной структурой Б подразумевают конфигурацию полипептидной цепи (способ упаковки, свертывания полипептидной цепи). 2 основные конфигурации:
- 7. Надвторичные структуры белков Это агрегаты полипептидных цепей, обладающих собственной вторичной структурой и образующихся в некоторых белках
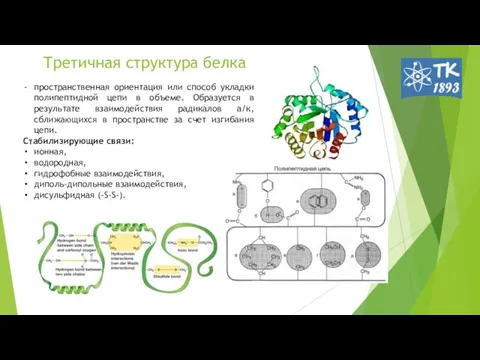
- 8. Третичная структура белка пространственная ориентация или способ укладки полипептидной цепи в объеме. Образуется в результате взаимодействия
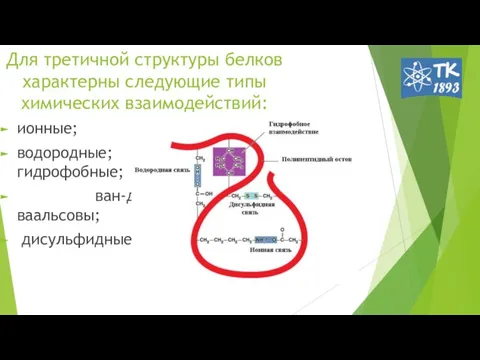
- 10. Для третичной структуры белков характерны следующие типы химических взаимодействий: ионные; водородные; гидрофобные; ван-дер-ваальсовы; дисульфидные.
- 11. Денатурация Нарушение третичной структуры белка под воздействием каких-либо факторов называется денатурацией. Существует целый ряд физико-химических воздействий,
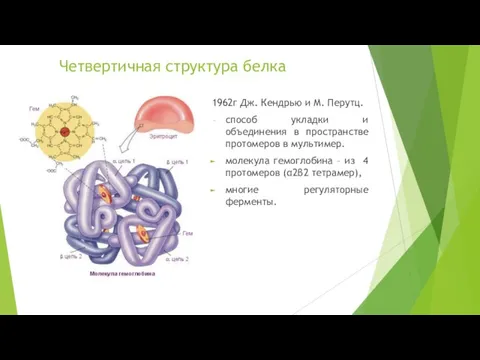
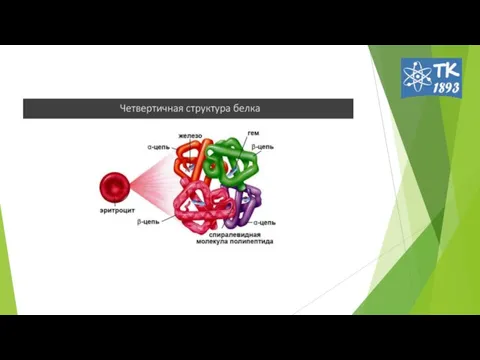
- 12. Четвертичная структура белка 1962г Дж. Кендрью и М. Перутц. способ укладки и объединения в пространстве протомеров
- 20. Скачать презентацию











 Зеленые водоросли Chlorophyta
Зеленые водоросли Chlorophyta ЕГЭ Биология. Новый формат заданий. 2022
ЕГЭ Биология. Новый формат заданий. 2022 Антиоксидант астаксантин
Антиоксидант астаксантин Кожа. Наружный покров
Кожа. Наружный покров Генетический материал клетки. Генный уровень
Генетический материал клетки. Генный уровень Нуклеїнові кислоти. Класифікація. Будова. Біологічне значення. Нуклеопротеїни
Нуклеїнові кислоти. Класифікація. Будова. Біологічне значення. Нуклеопротеїни Vitamins. Classes of Vitamins
Vitamins. Classes of Vitamins Нуклеиновые кислоты
Нуклеиновые кислоты Урок обобщение по главе Класс птицы
Урок обобщение по главе Класс птицы Кожно-двигательный, зрительный, слуховой,вестибулярный, обонятельный и вкусовой анализаторы
Кожно-двигательный, зрительный, слуховой,вестибулярный, обонятельный и вкусовой анализаторы Птичьи рекорды
Птичьи рекорды Столовые сорта винограда (районированные и перспективные)
Столовые сорта винограда (районированные и перспективные) Охраняемые растения Крыма
Охраняемые растения Крыма Презентация для урока-обобщения по биологии в 5 классе
Презентация для урока-обобщения по биологии в 5 классе Культурні рослини
Культурні рослини Нужны ли минеральные соли животным и человеку
Нужны ли минеральные соли животным и человеку История развития эволюционных идей
История развития эволюционных идей Тестовыя работа по теме: Вирусы
Тестовыя работа по теме: Вирусы Molecular genetic factors controlling plant resistance to diseases
Molecular genetic factors controlling plant resistance to diseases Эпиграф
Эпиграф Биология полорогих: дзерена, сайгака, горала
Биология полорогих: дзерена, сайгака, горала Предмет и задачи токсикологической химии. Взаимосвязь с другими дисциплинами. (Лекция 1)
Предмет и задачи токсикологической химии. Взаимосвязь с другими дисциплинами. (Лекция 1) Становление систематики. 9 класс
Становление систематики. 9 класс Ищите доктора в природе
Ищите доктора в природе Откуда берутся шоколад, изюм и мед
Откуда берутся шоколад, изюм и мед Экзаменационные микропрепараты
Экзаменационные микропрепараты Отряд Пчёлы
Отряд Пчёлы Пищеварение в полости рта: состав и свойства слюны
Пищеварение в полости рта: состав и свойства слюны