Содержание
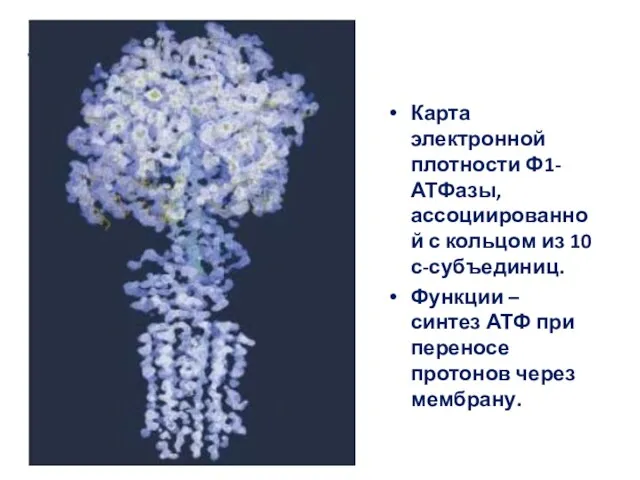
- 2. Карта электронной плотности Ф1-АТФазы, ассоциированной с кольцом из 10 с-субъединиц. Функции – синтез АТФ при переносе
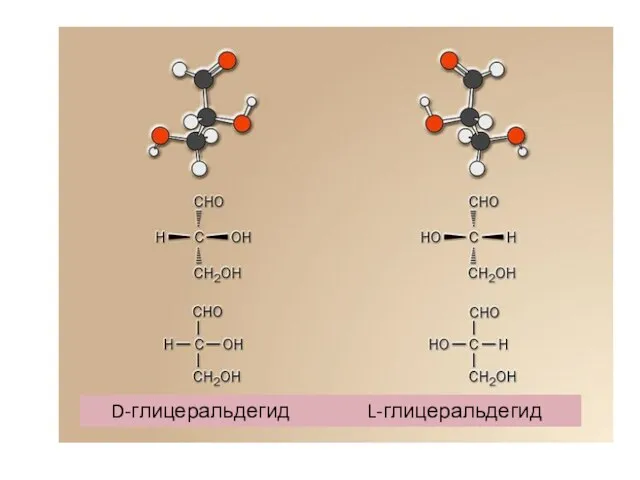
- 3. D-глицеральдегид L-глицеральдегид
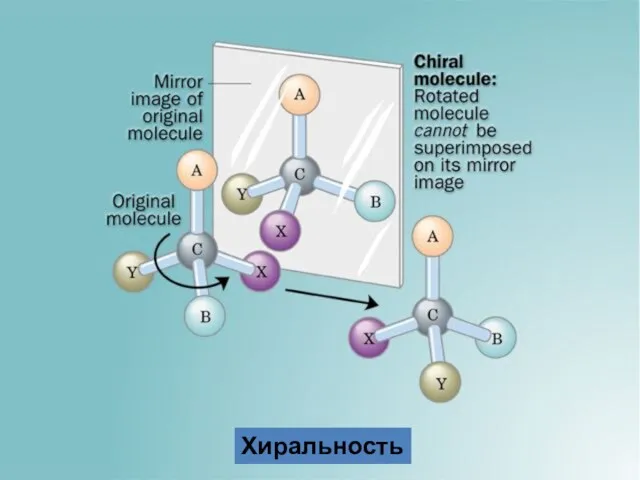
- 4. Хиральность
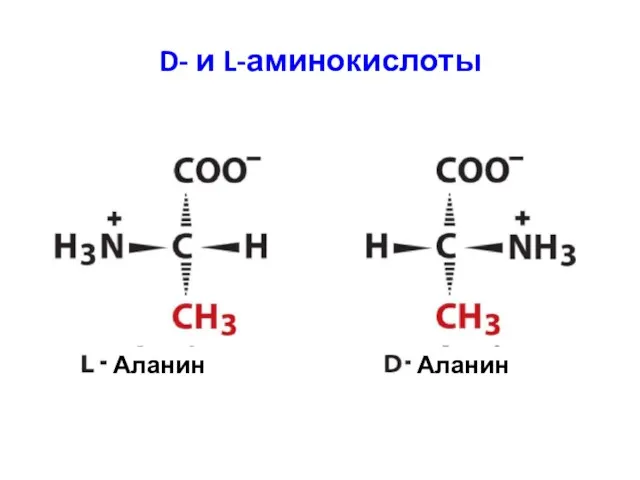
- 6. D- и L-аминокислоты Аланин Аланин
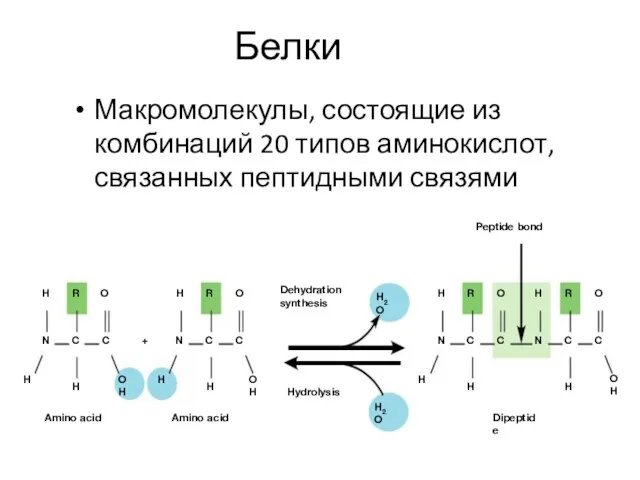
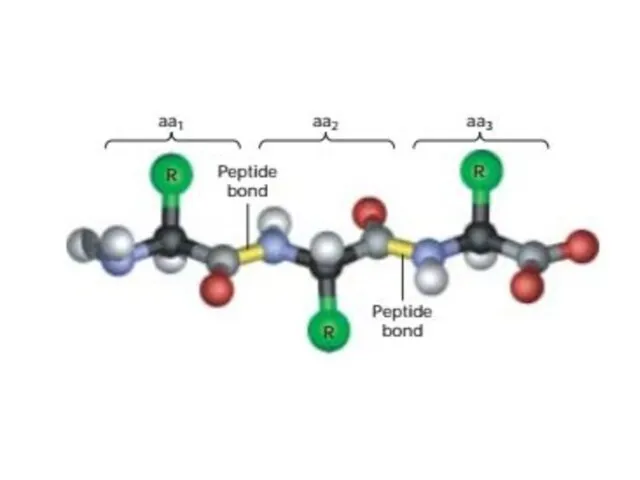
- 7. Белки Макромолекулы, состоящие из комбинаций 20 типов аминокислот, связанных пептидными связями
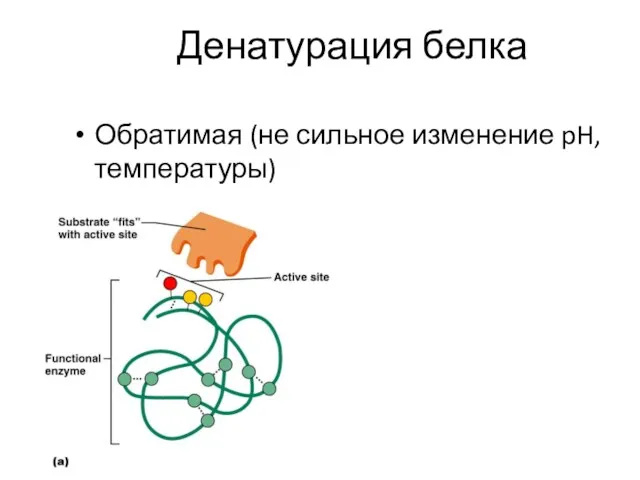
- 8. Денатурация белка Обратимая (не сильное изменение pH, температуры)
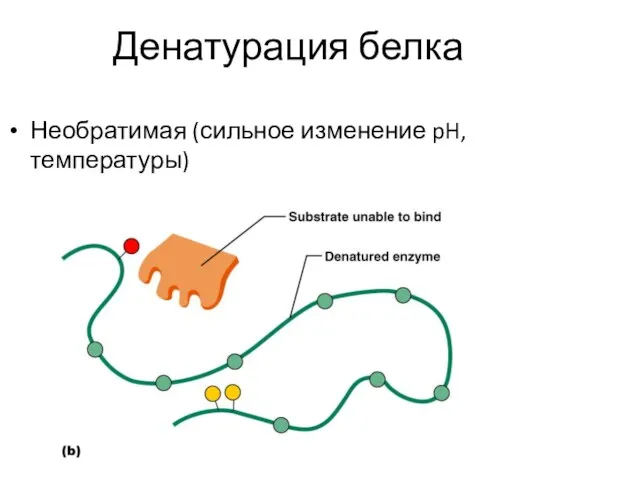
- 9. Денатурация белка Необратимая (сильное изменение pH, температуры)
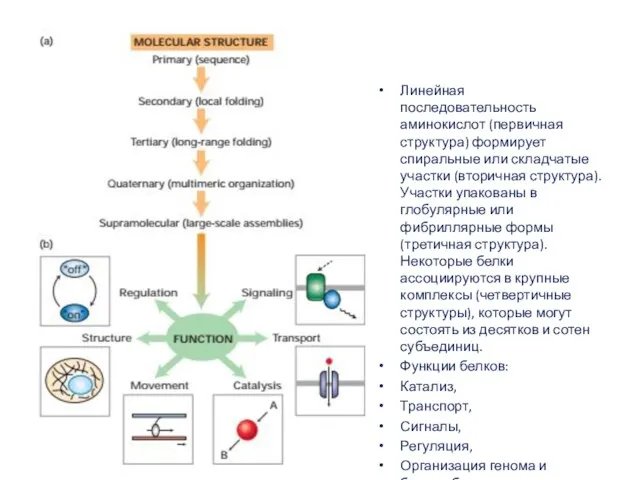
- 10. Линейная последовательность аминокислот (первичная структура) формирует спиральные или складчатые участки (вторичная структура). Участки упакованы в глобулярные
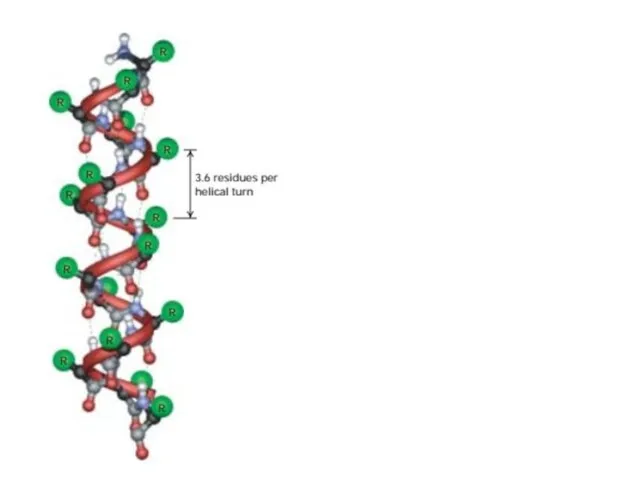
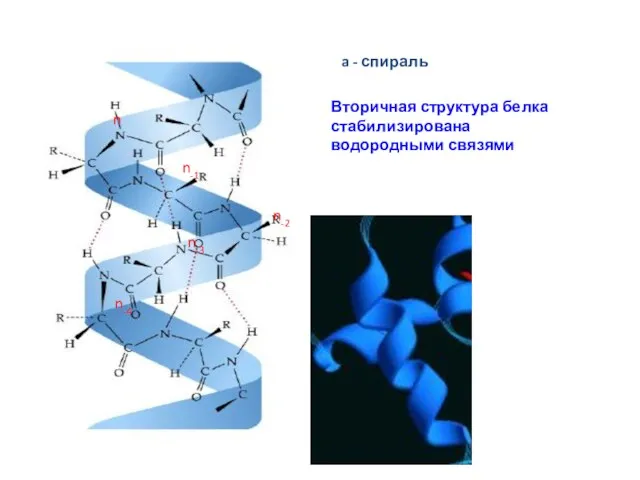
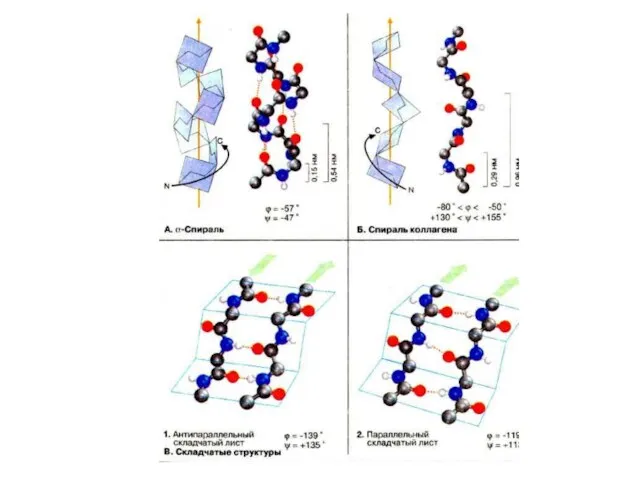
- 13. Спираль Наиболее распространенным элементом вторичной структуры является правая α-спираль (αR). Пептидная цепь здесь изгибается винтообразно. Ha
- 14. n n-4 n-3 n-2 n-1 Вторичная структура белка стабилизирована водородными связями a - спираль
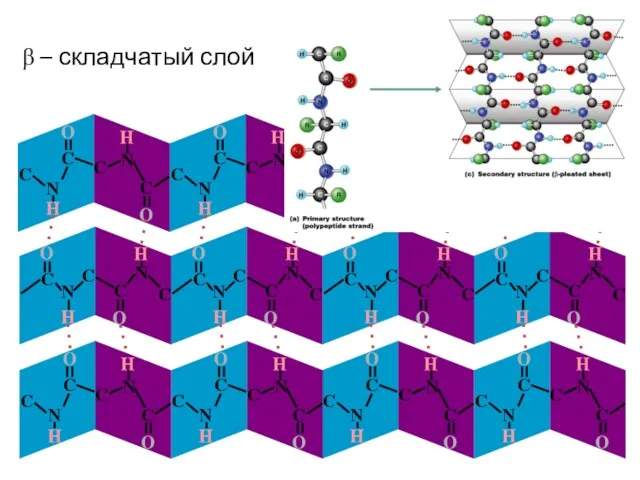
- 15. β – складчатый слой
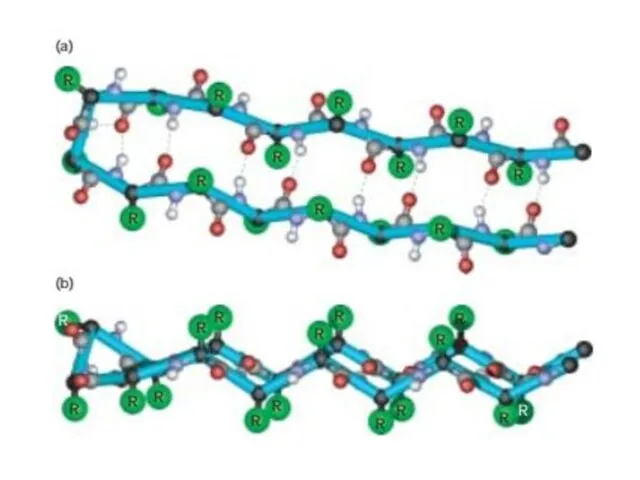
- 17. Складчатость Плоскости пептидных связей расположены в пространстве подобно равномерным складкам листа бумаги. B складчатых структурах также
- 19. Общие свойства белков Большое значение для поддержания структуры имеют водородные связи между полярными атомами (О-Н, N-Н,
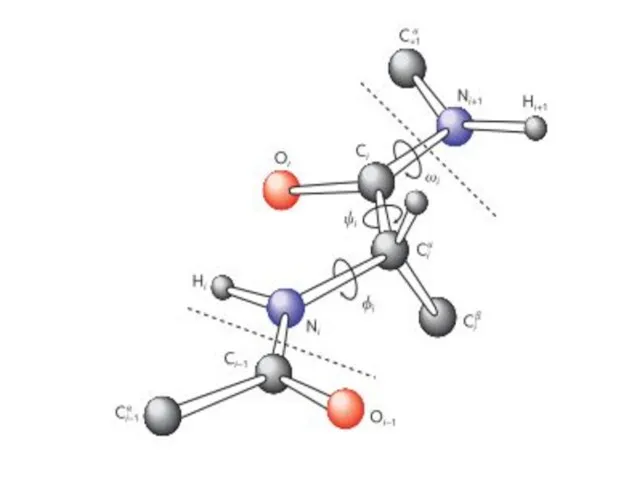
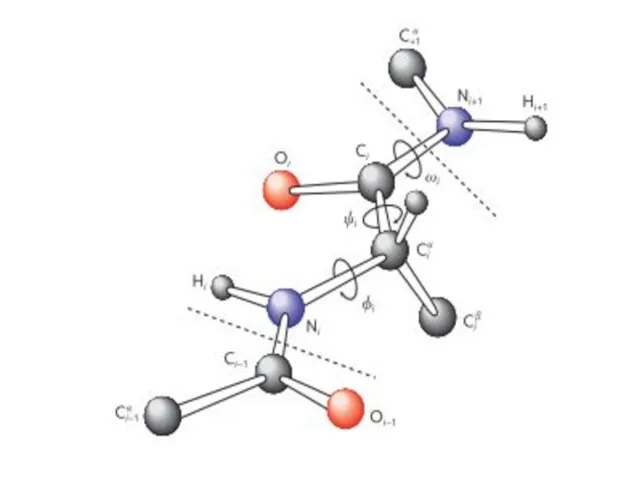
- 20. Конформация белковой цепи характеризуется тремя углами, внутреннего вращения вокруг связей основной цепи. Связи между N и
- 22. Пептидная связь Пептидная связь является частично двойной и угол вращения C-N связи может принимать 2 значения:
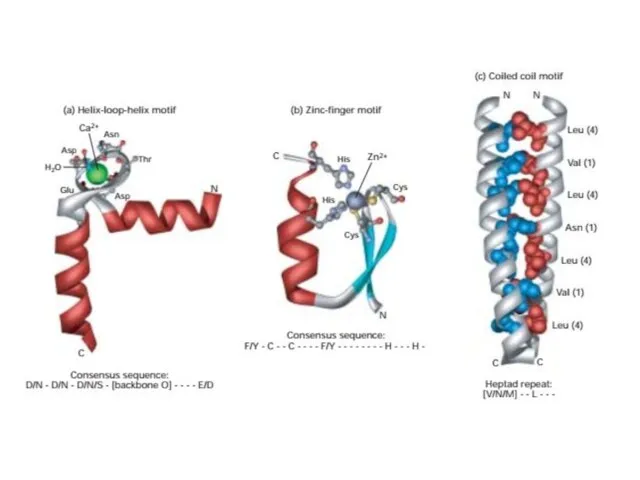
- 24. Повторяющиеся комбинации вторичных структур Называются «мотивами» или фолдами, они формируют третичную структуру белка. В некоторых случаях
- 26. Спиральную спираль Многие белки, особенно волокнистые белки, самоассоциируются в олигомеры, используя третий мотив - спиральную спираль.
- 27. Структурные и функциональные домены образуют третичную структуру Третичная структура белков размером более 15000 Да обычно подразделяется
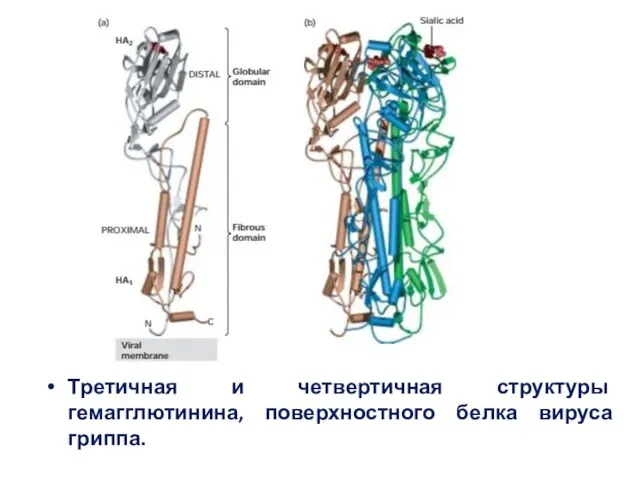
- 28. Третичная и четвертичная структуры гемагглютинина, поверхностного белка вируса гриппа.
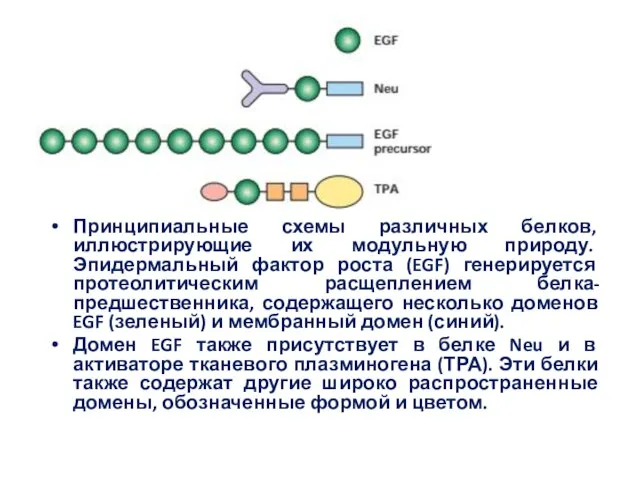
- 29. Принципиальные схемы различных белков, иллюстрирующие их модульную природу. Эпидермальный фактор роста (EGF) генерируется протеолитическим расщеплением белка-предшественника,
- 31. В некоторых случаях в ходе эволюции четвертичная структура может трансформироваться в третичную Например, 5 отдельных ферментов
- 32. База данных SCOP База данных SCOP организует структуры белков в иерархическую систему в соответствии с их
- 33. В некоторых случаях в ходе эволюции четвертичная структура может трансформироваться в третичную Например, 5 отдельных ферментов
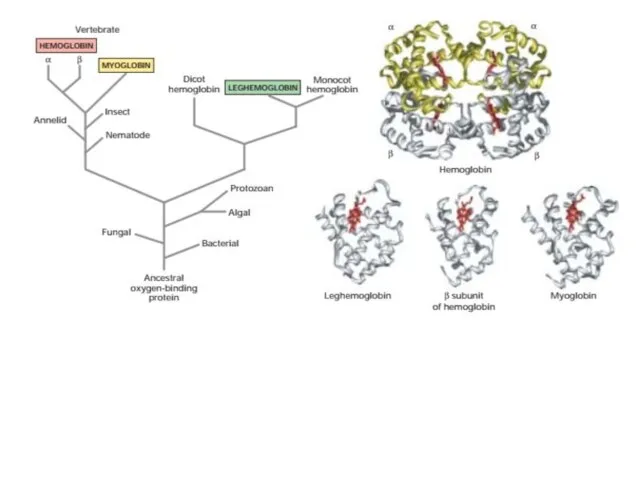
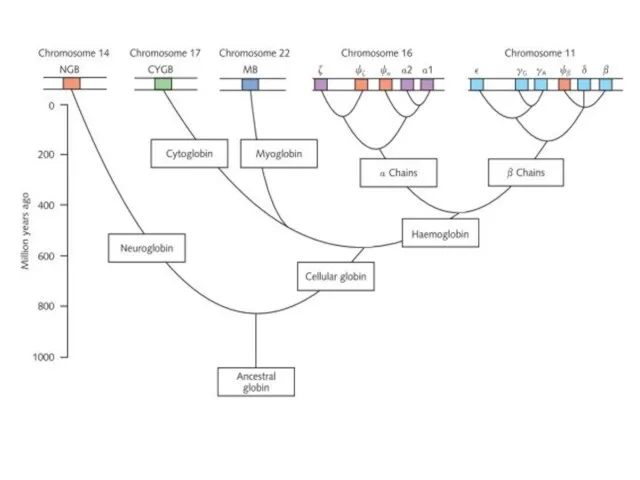
- 35. Глобины Считается, что примитивный мономерный связывающий кислород глобин является прародителем современных гемоглобинов крови, мышечных миоглобинов и
- 38. Информация – в первичной последовательности белка Любая полипептидная цепь, содержащая n АК может складываться в 8n
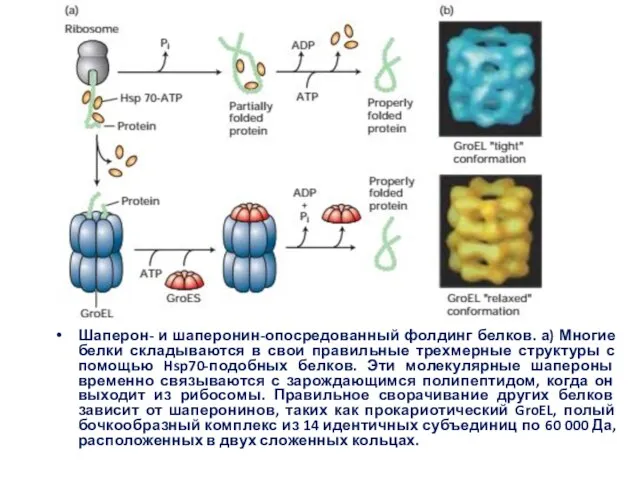
- 40. Шаперон- и шаперонин-опосредованный фолдинг белков. а) Многие белки складываются в свои правильные трехмерные структуры с помощью
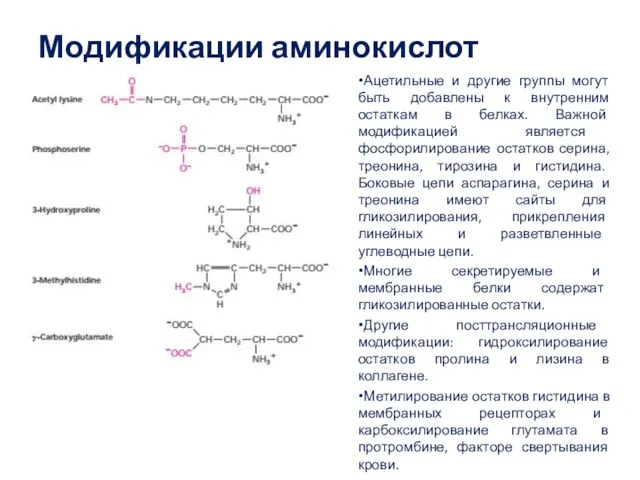
- 41. Модификации аминокислот Ацетильные и другие группы могут быть добавлены к внутренним остаткам в белках. Важной модификацией
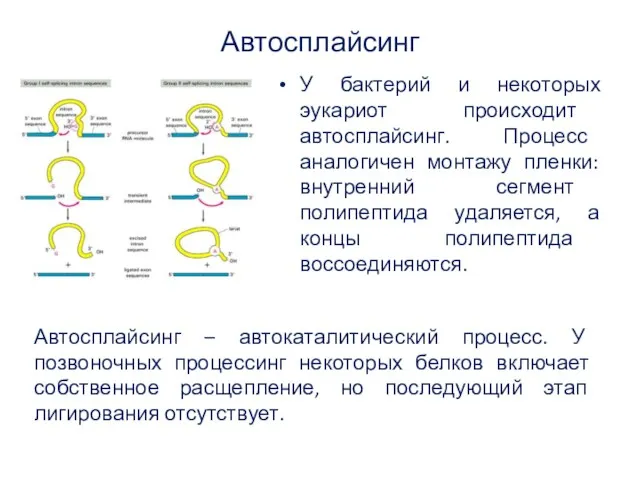
- 42. Автосплайсинг У бактерий и некоторых эукариот происходит автосплайсинг. Процесс аналогичен монтажу пленки: внутренний сегмент полипептида удаляется,
- 43. Убиквитирование Один из главных механизмов – деградация под действием ферментов в лизосомах, мембранно-ограниченных органеллах, чье кислотное
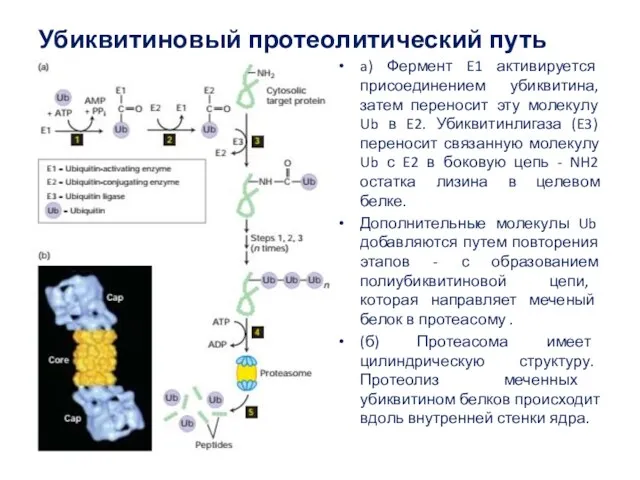
- 44. Убиквитиновый протеолитический путь a) Фермент E1 активируется присоединением убиквитина, затем переносит эту молекулу Ub в E2.
- 45. Альтернативный фолдинг как причина заболеваний Некоторые нейродегенеративные заболевания, в том числе болезнь Альцгеймера и болезнь Паркинсона
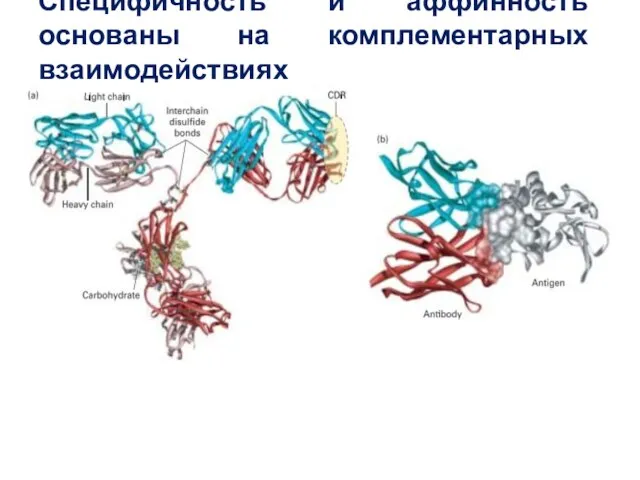
- 47. Специфичность и аффинность основаны на комплементарных взаимодействиях
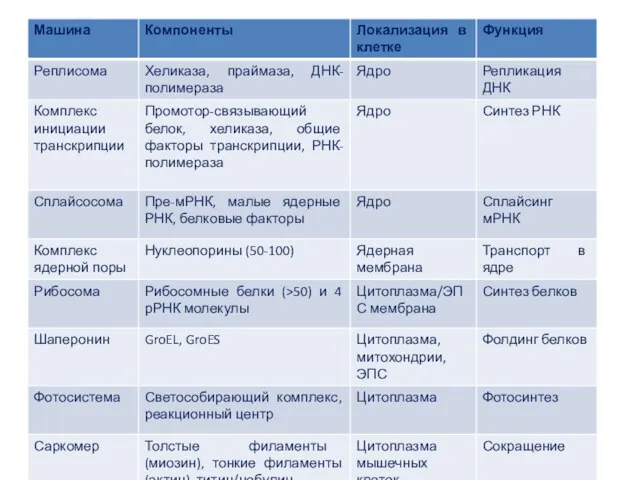
- 48. Молекулярные моторы и механическая работа в клетке Механохимические ферменты преобразуют энергию, выделяемую при гидролизе АТФ или
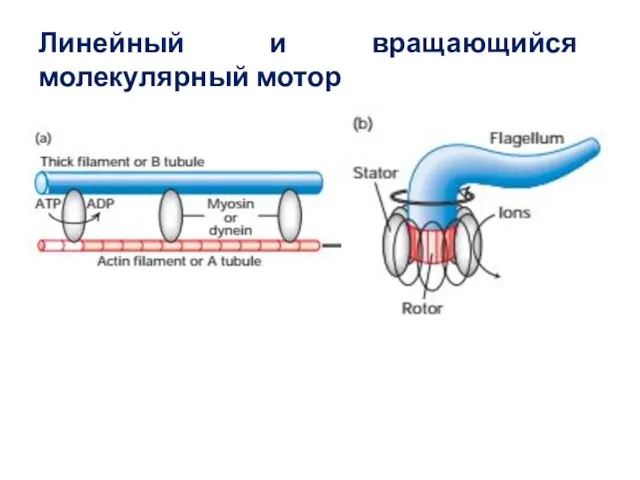
- 49. Линейный и вращающийся молекулярный мотор
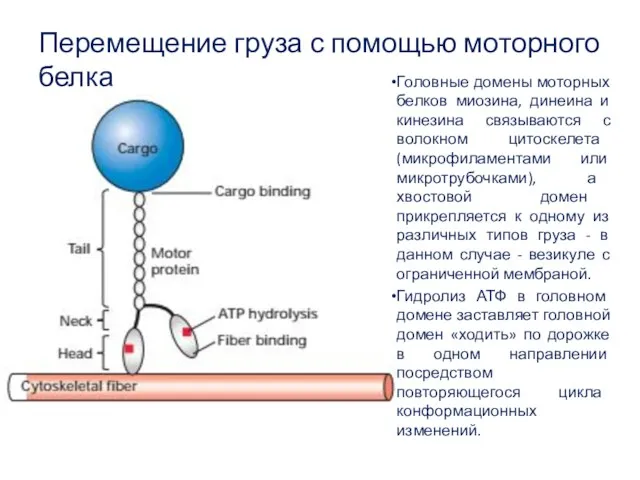
- 50. Перемещение груза с помощью моторного белка Головные домены моторных белков миозина, динеина и кинезина связываются с
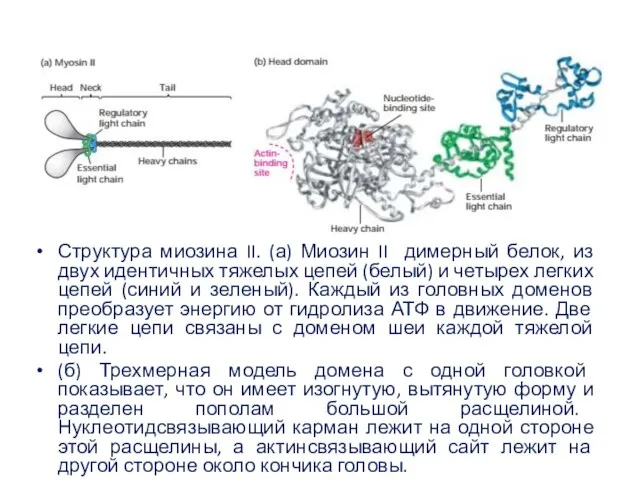
- 51. Структура миозина II. (а) Миозин II димерный белок, из двух идентичных тяжелых цепей (белый) и четырех
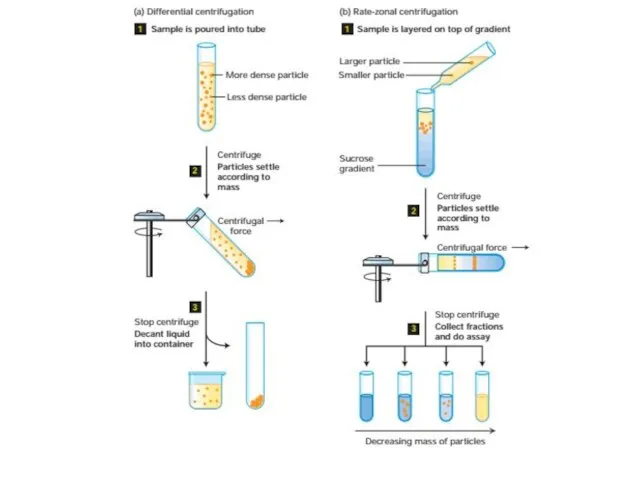
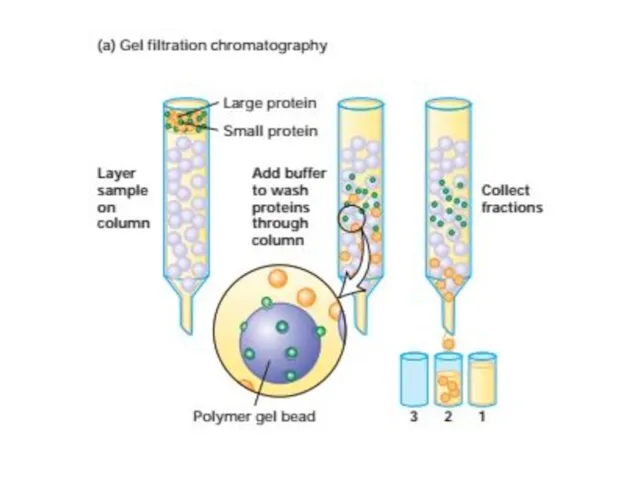
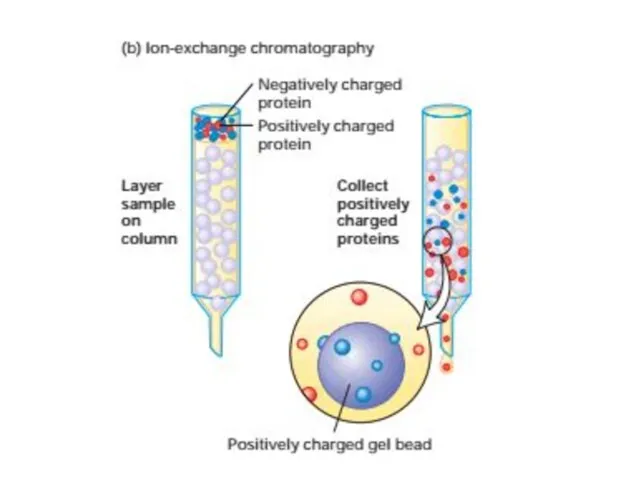
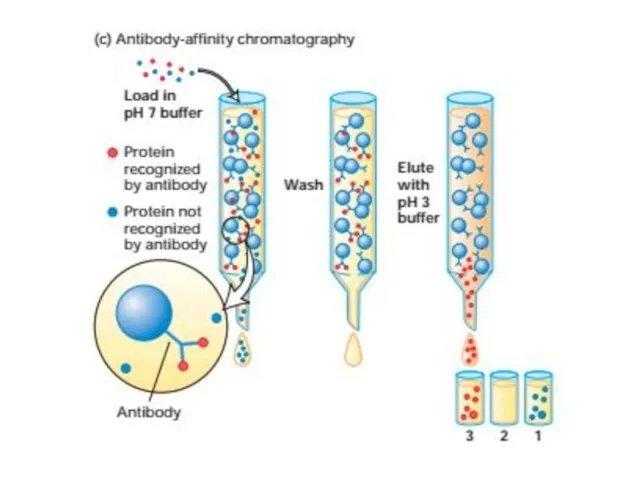
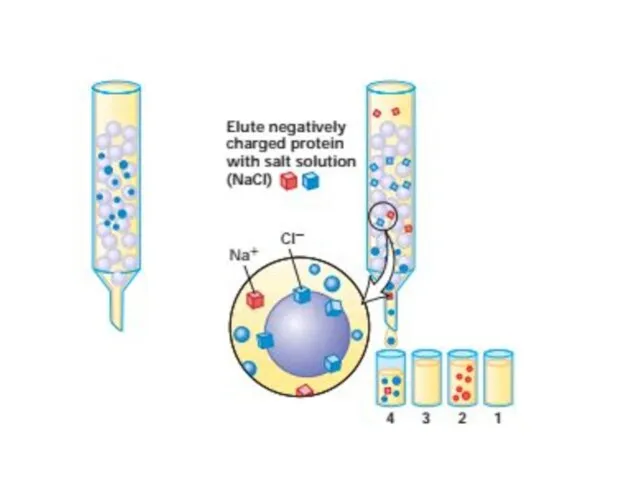
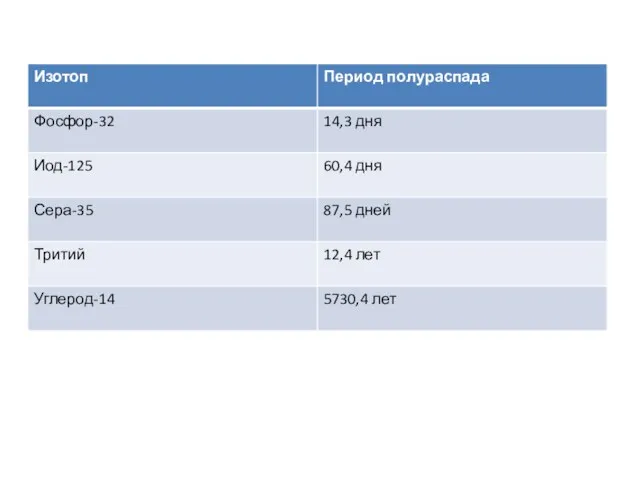
- 52. Очистка и анализ белков Центрифугировние подвергает частицы действию центробежных сил в 1000000 раз превышающим силу тяжести
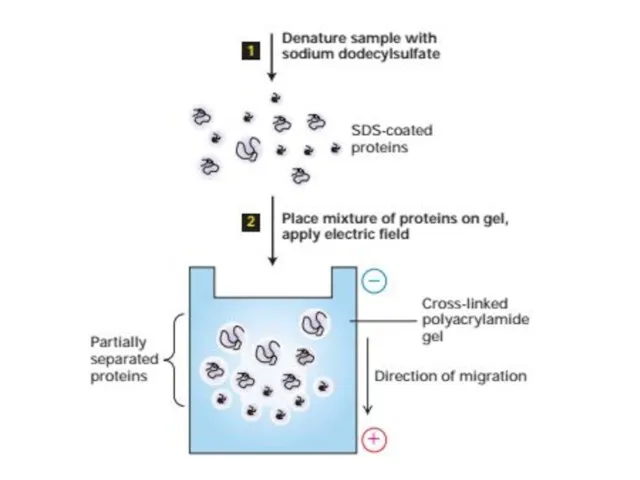
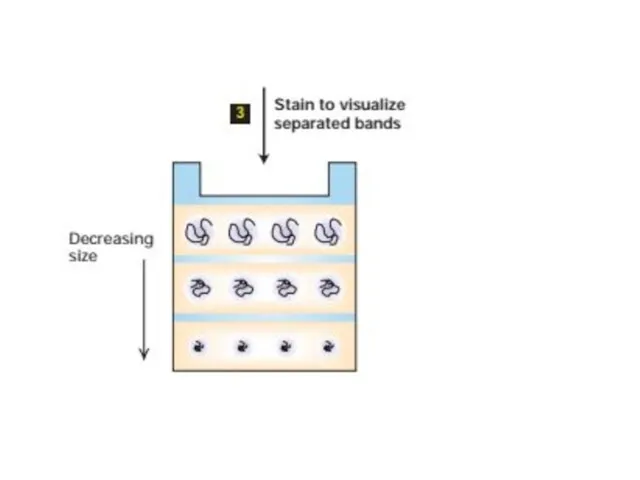
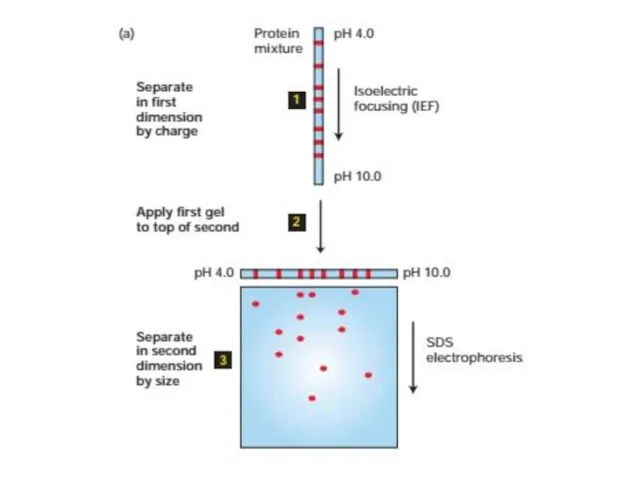
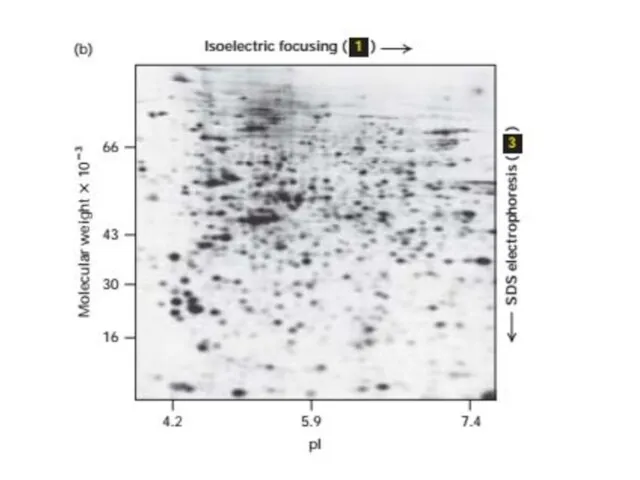
- 54. Электрофорез Электрофорез - это метод разделения молекул в смеси под воздействием приложенного электрического поля. Растворенные молекулы
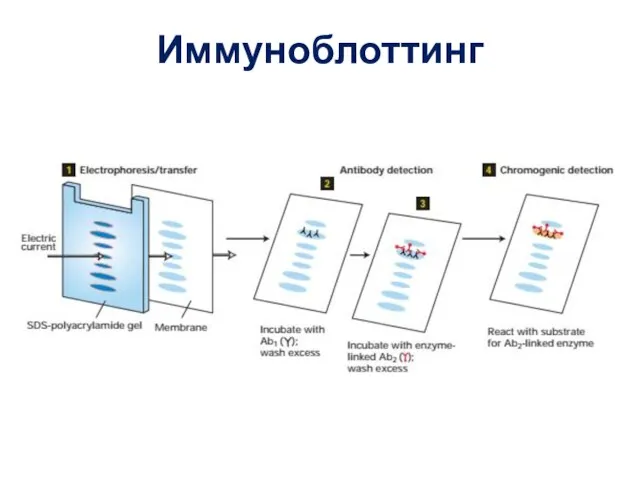
- 63. Иммуноблоттинг
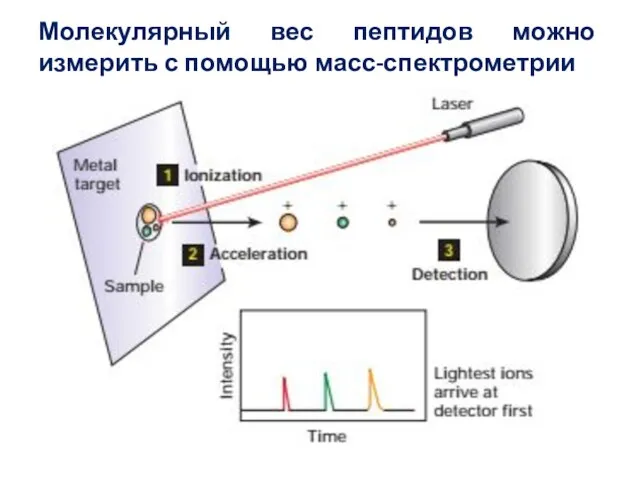
- 65. Молекулярный вес пептидов можно измерить с помощью масс-спектрометрии
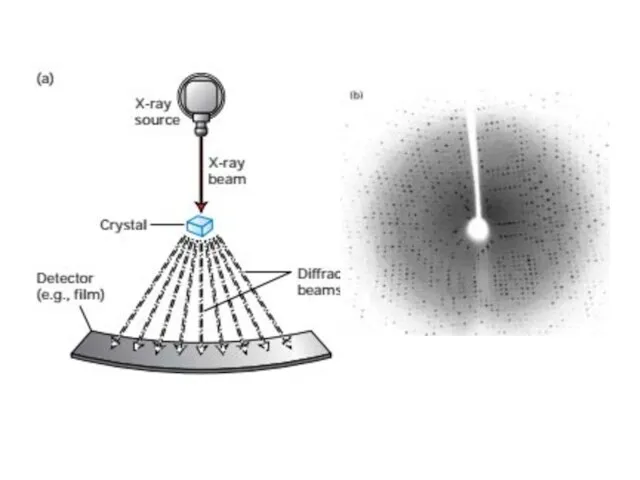
- 67. Рентгеновская кристаллография Рентгеновская кристаллография для определения трехмерных структур белков была впервые использована Максом Перуцем и Джоном
- 69. Скачать презентацию






















 Класс паукообразных
Класс паукообразных Кожа - наружный покровный орган человека
Кожа - наружный покровный орган человека Презентация О великом женском секрете
Презентация О великом женском секрете Бактериальная клеточная стенка
Бактериальная клеточная стенка Классификация животных. Основные систематические группы. Влияние человека на животных
Классификация животных. Основные систематические группы. Влияние человека на животных Поведение человека
Поведение человека Как животные готовятся к зиме
Как животные готовятся к зиме Разнообразие земноводных
Разнообразие земноводных Кожа и ее производные. Наружная оболочка тела животного
Кожа и ее производные. Наружная оболочка тела животного Экологические особенности акклиматизации копытных в Нижнекундрюченском хозяйстве
Экологические особенности акклиматизации копытных в Нижнекундрюченском хозяйстве Эволюция строения и функций органов и их систем
Эволюция строения и функций органов и их систем Экологиялық факторлар
Экологиялық факторлар Изучаем фрукты (для детей)
Изучаем фрукты (для детей) Класс Однодольные. Сравнительная характеристика семейств класса Однодольные
Класс Однодольные. Сравнительная характеристика семейств класса Однодольные Пути достижения биологического прогресса арогенез, аллогенез, катагенез
Пути достижения биологического прогресса арогенез, аллогенез, катагенез Бионика. Кибернетика,
Бионика. Кибернетика, Высшая нервная деятельность человека
Высшая нервная деятельность человека Корень. Внешнее и внутреннее строение корня
Корень. Внешнее и внутреннее строение корня Основы селекции растений, животных, микроорганизмов
Основы селекции растений, животных, микроорганизмов Құрамында сапониндері бар дәрілік өсімдік шикізаттарын талдау
Құрамында сапониндері бар дәрілік өсімдік шикізаттарын талдау Клетка. Клеточная теория. Строение и функции клетки, органоиды клетки
Клетка. Клеточная теория. Строение и функции клетки, органоиды клетки Презентация к уроку биологии на тему Витамины.
Презентация к уроку биологии на тему Витамины. Собаки: йоркширский терьер
Собаки: йоркширский терьер Строение и работа сердца. Круги кровообращения. Расположение сердца в теле человека
Строение и работа сердца. Круги кровообращения. Расположение сердца в теле человека Презентация по теме : Надземное видоизменение побегов
Презентация по теме : Надземное видоизменение побегов Аорта и ее отделы
Аорта и ее отделы Белки и пептиды. Ферменты
Белки и пептиды. Ферменты Учение Ч. Дарвина
Учение Ч. Дарвина