Содержание
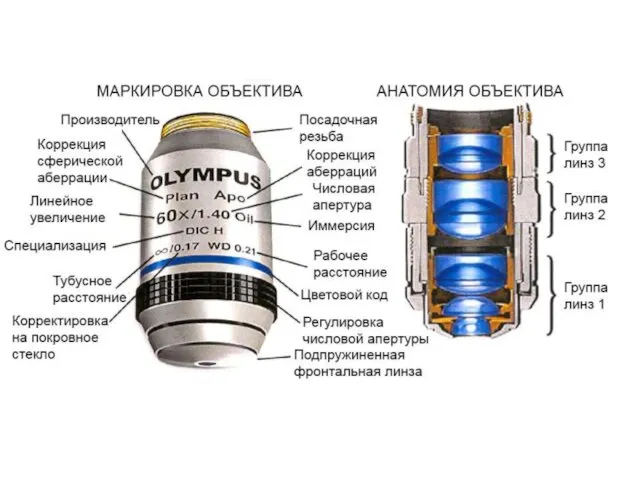
- 2. Строение светового микроскопа предметный столик узел смены объективов объективы окуляры конденсор тубусодержатель основание макро- и микровинты
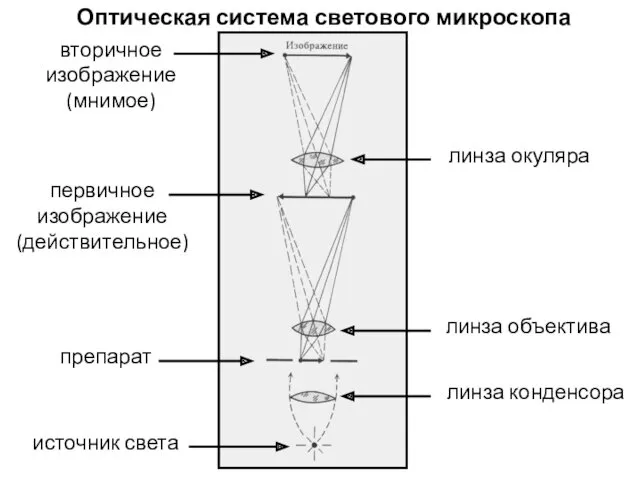
- 3. Оптическая система светового микроскопа источник света линза конденсора линза объектива препарат линза окуляра первичное изображение (действительное)
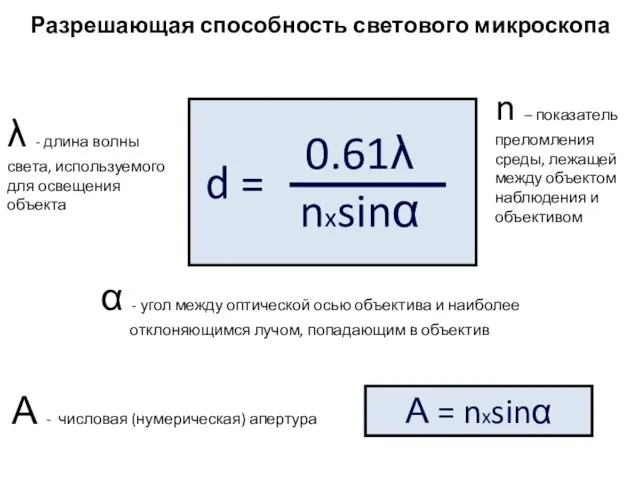
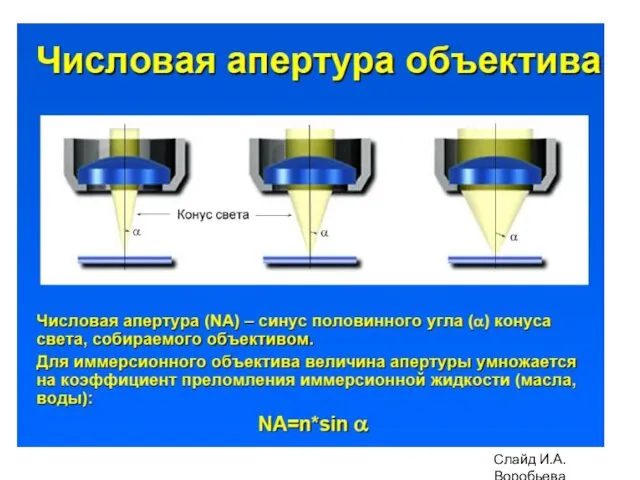
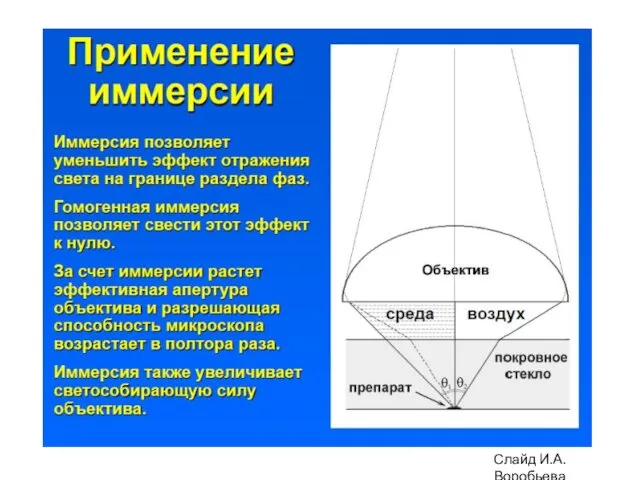
- 4. Разрешающая способность светового микроскопа 0.61λ nxsinα d = α - угол между оптической осью объектива и
- 5. Слайд И.А. Воробьева
- 6. Слайд И.А. Воробьева
- 9. Общие правила работы с микроскопом Нельзя переносить микроскоп за «горловину»: необходимо всегда второй рукой поддерживать его
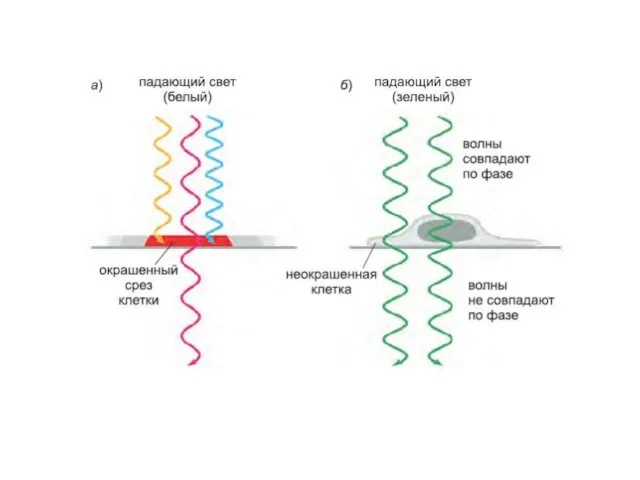
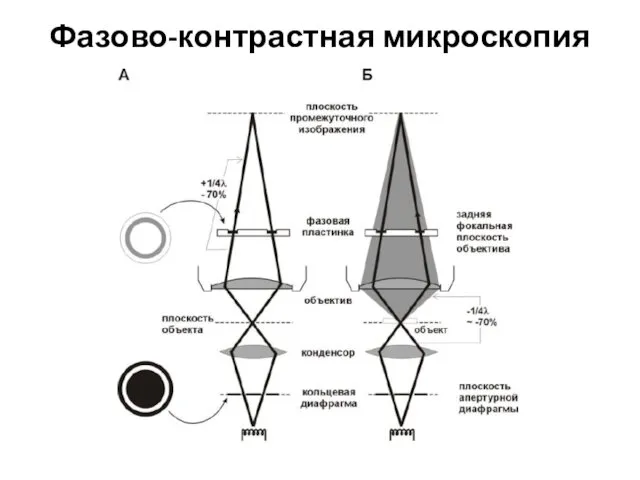
- 11. Фазово-контрастная микроскопия
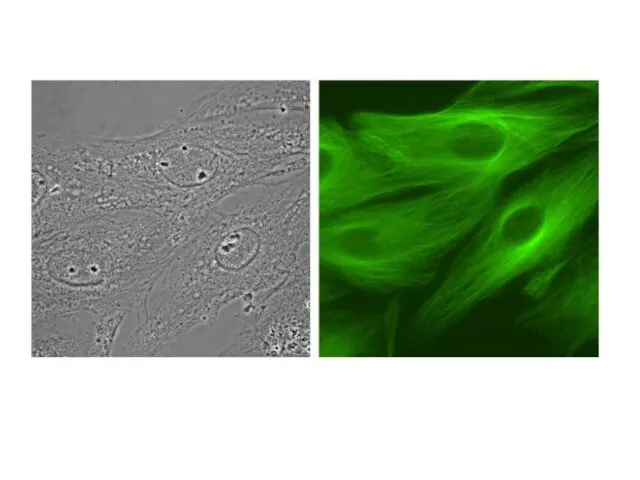
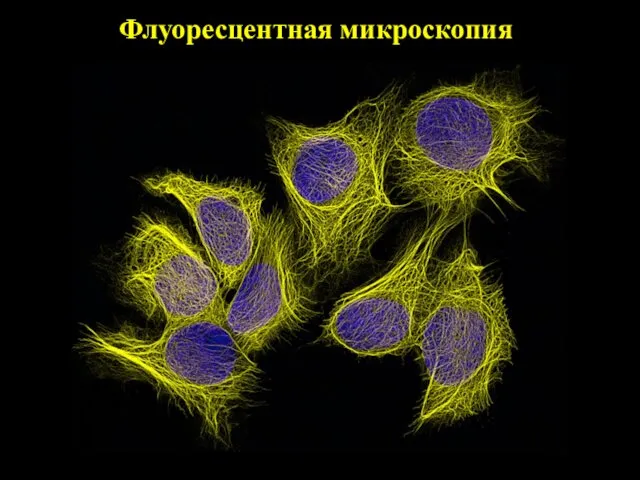
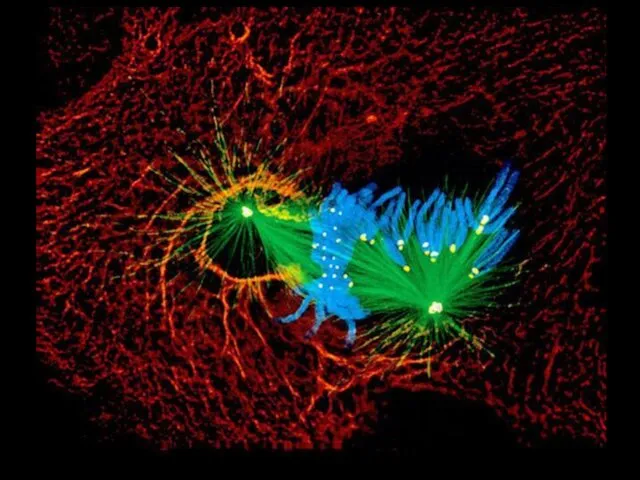
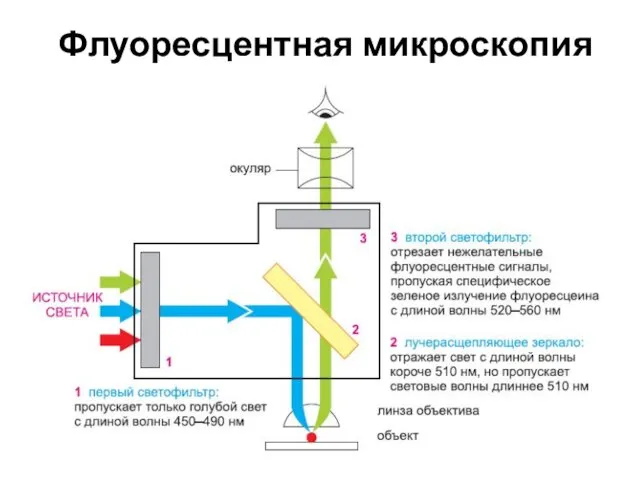
- 13. Флуоресцентная микроскопия
- 15. Флуоресцентная микроскопия
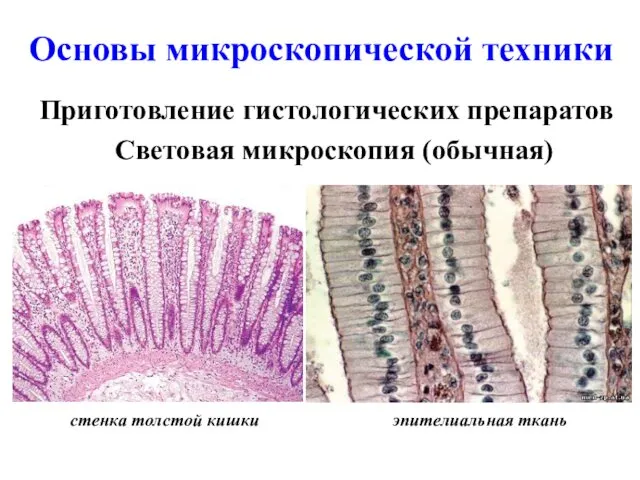
- 16. Основы микроскопической техники Приготовление гистологических препаратов Световая микроскопия (обычная) эпителиальная ткань стенка толстой кишки
- 17. Мазки (костный мозг, кровь, ликвор); Пленки (брыжейки, нервная ткань); Отпечатки (печень, селезенка); Клетки культур; Гистологические срезы;
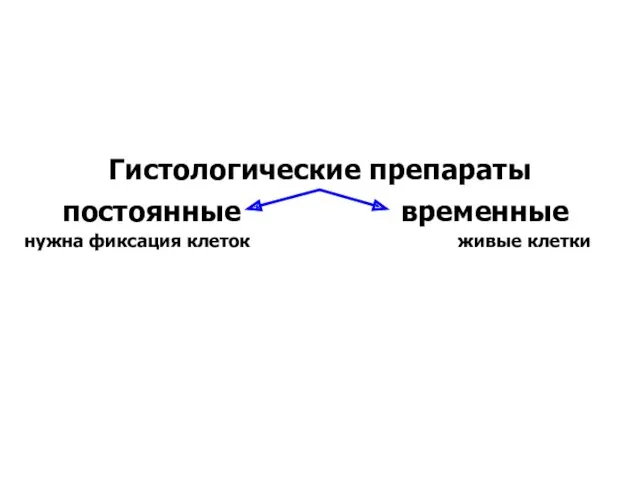
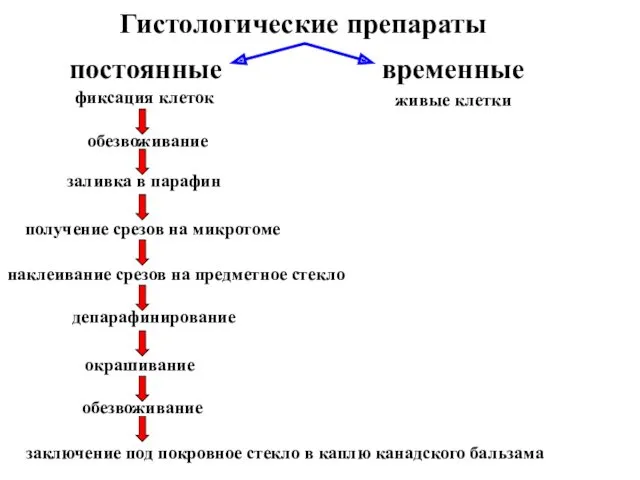
- 18. Гистологические препараты постоянные временные живые клетки нужна фиксация клеток
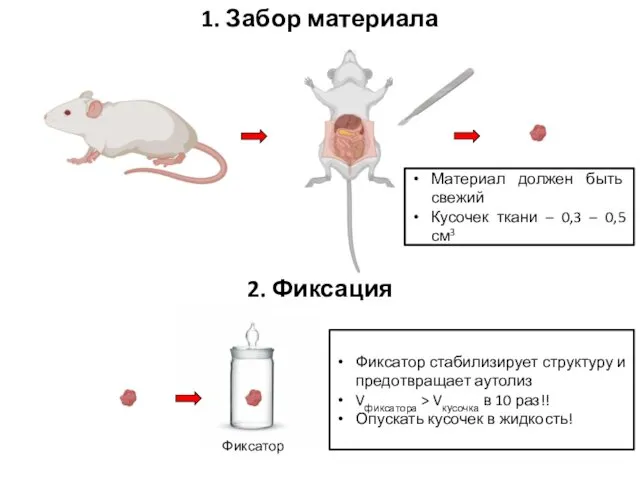
- 19. 1. Забор материала Фиксатор стабилизирует структуру и предотвращает аутолиз Vфиксатора > Vкусочка в 10 раз!! Опускать
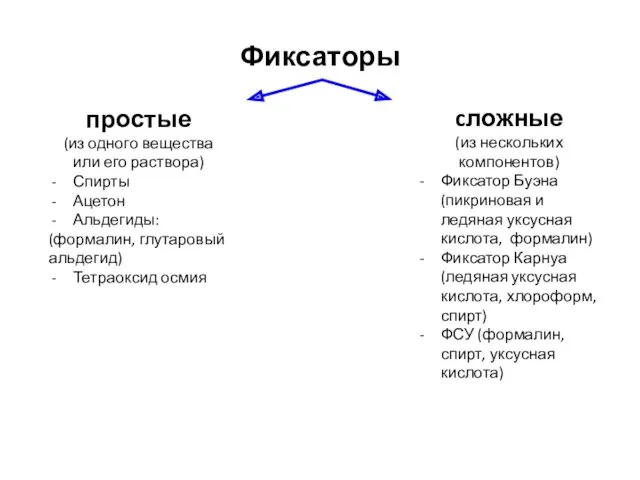
- 20. Фиксаторы простые (из одного вещества или его раствора) Спирты Ацетон Альдегиды: (формалин, глутаровый альдегид) Тетраоксид осмия
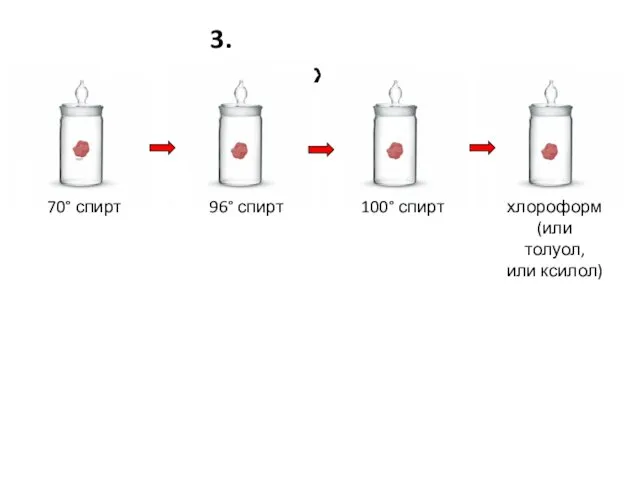
- 21. 3. Обезвоживание 70° спирт 96° спирт 100° спирт хлороформ (или толуол, или ксилол)
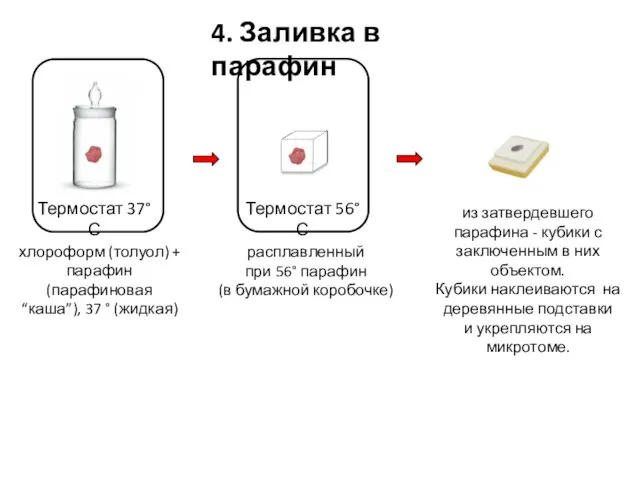
- 22. 4. Заливка в парафин хлороформ (толуол) + парафин (парафиновая “каша”), 37 ° (жидкая) расплавленный при 56°
- 23. 5. Получение срезов на микротоме 6. Наклеивание срезов на предметное стекло Получение срезов толщиной 2-4 мкм.
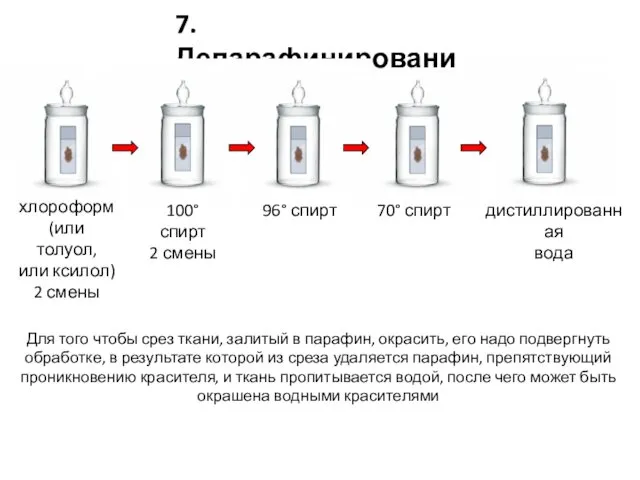
- 24. 7. Депарафинирование 70° спирт 96° спирт 100° спирт 2 смены хлороформ (или толуол, или ксилол) 2
- 25. 8. Окрашивание Ядерные красители Цитоплазматические красители “основные” “протравные” (образуют с нуклеиновыми кислотами и кислыми белками ядра
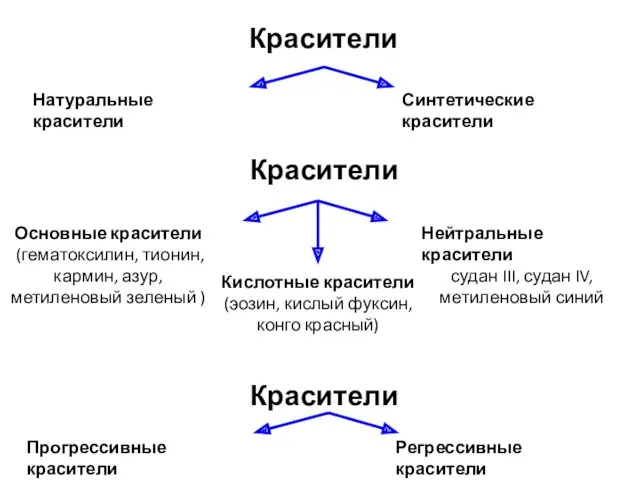
- 26. Красители Натуральные красители Синтетические красители Красители Основные красители (гематоксилин, тионин, кармин, азур, метиленовый зеленый ) Нейтральные
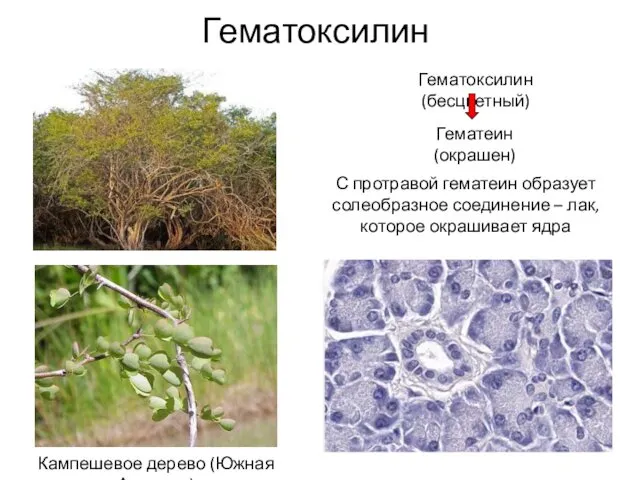
- 27. Гематоксилин Кампешевое дерево (Южная Америка) Гематоксилин (бесцветный) Гематеин (окрашен) С протравой гематеин образует солеобразное соединение –
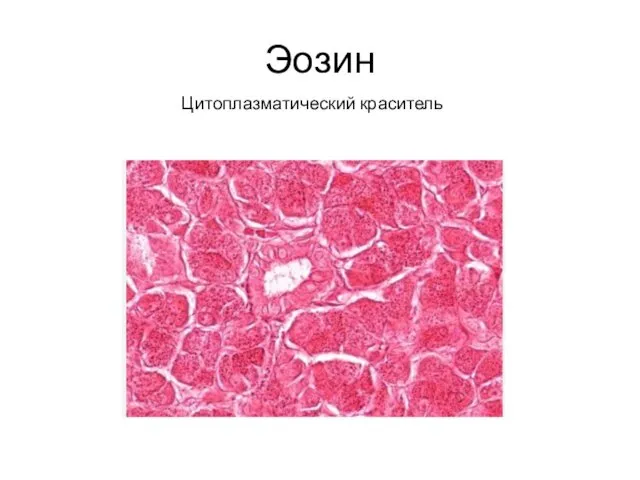
- 28. Эозин Цитоплазматический краситель
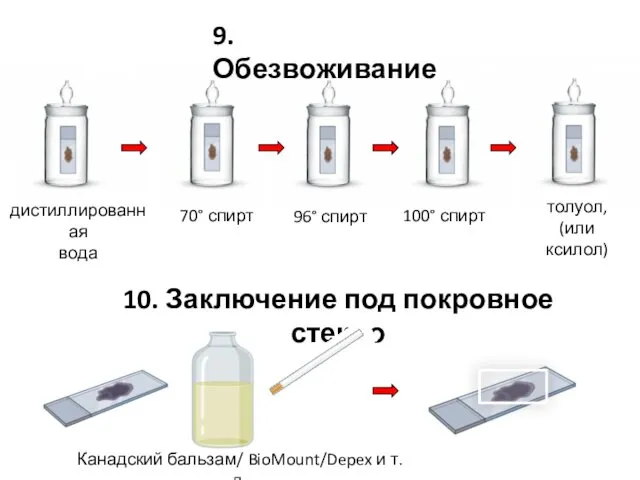
- 29. 70° спирт 96° спирт 100° спирт толуол, (или ксилол) дистиллированная вода 9. Обезвоживание 10. Заключение под
- 30. Гистологические препараты постоянные временные живые клетки фиксация клеток обезвоживание заливка в парафин получение срезов на микротоме
- 31. Культура клеток и тканей Клетки могут расти в культуре в течение длительного времени, если: снабжать клетки
- 32. Культуры клеточные растут в виде монослоя, не формируют трехмерных комплексов тканевые трехмерная структура Первичная культура –
- 33. HeLa Линия была получена 8 февраля 1951 года из раковой опухоли шейки матки пациентки Генриетты Лакс
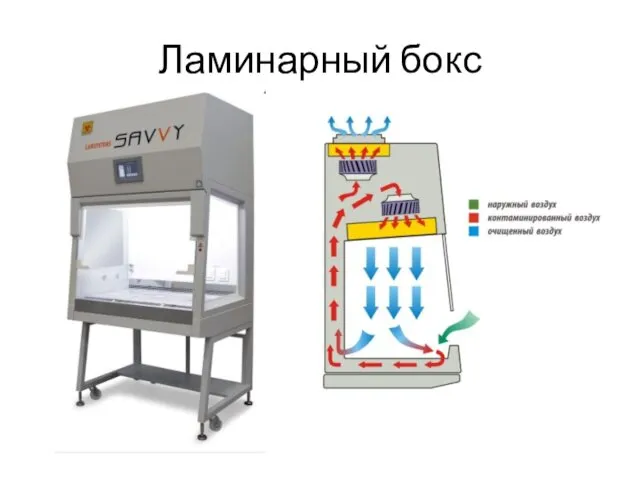
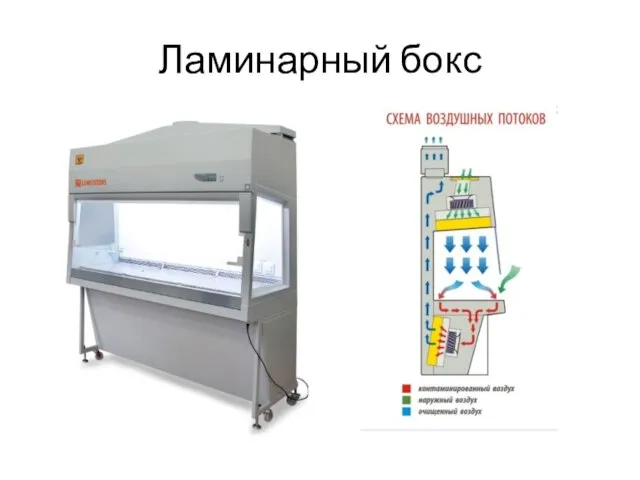
- 34. Ламинарный бокс
- 35. Ламинарный бокс
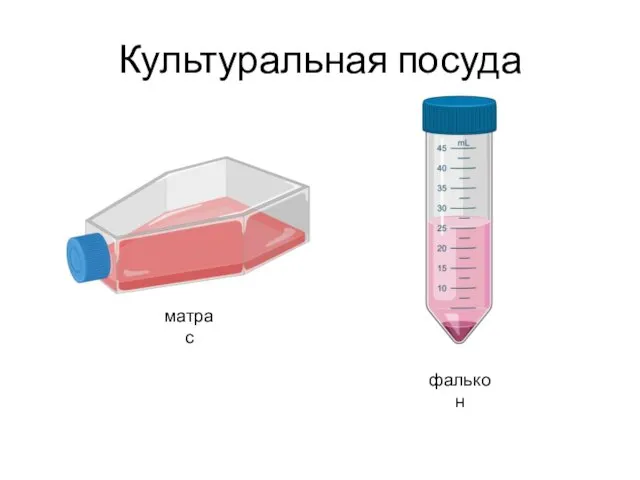
- 36. Культуральная посуда матрас фалькон
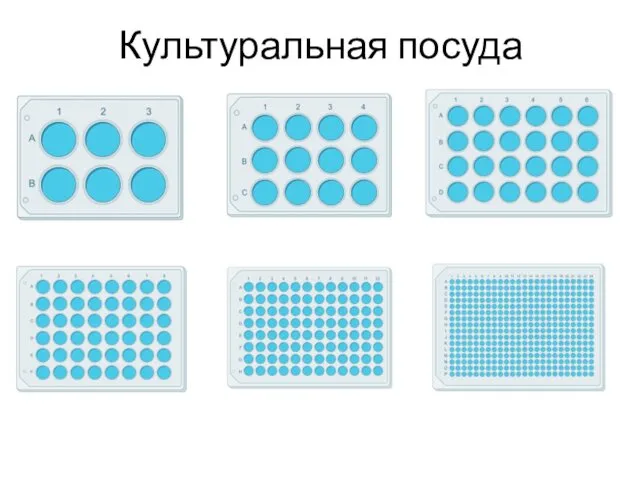
- 37. Культуральная посуда
- 38. Культуральная среда раствор аминокислот, витаминов, глюкозы и т.д. на основе сбалансированного буферного раствора (обеспечивает осмотическое давление
- 39. Для нормального роста клеток нужны: Культуральная среда Сыворотка L-глутамин (добавлять перед началом работы со средой, т.к.
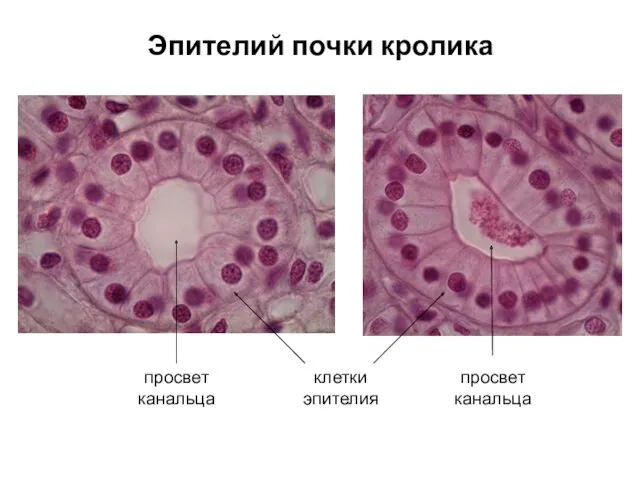
- 40. Эпителий почки кролика просвет канальца просвет канальца клетки эпителия
- 42. Скачать презентацию











 Складання характеристики виду за видовими критеріями. Кульбака. Вероніка
Складання характеристики виду за видовими критеріями. Кульбака. Вероніка Врожденные и приобретенные формы поведения. 8 класс
Врожденные и приобретенные формы поведения. 8 класс Презентация Селекция растений.
Презентация Селекция растений. Строение и функции стебля
Строение и функции стебля Тестирование на животных
Тестирование на животных Дигибридное скрещивание. Третий закон Г. Менделя
Дигибридное скрещивание. Третий закон Г. Менделя Открытый урок на тему За здоровый образ жизни
Открытый урок на тему За здоровый образ жизни Цветы. Уход за цветами
Цветы. Уход за цветами Биологияны оқыту әдістемесі пәнінің қалыптасу тарихы
Биологияны оқыту әдістемесі пәнінің қалыптасу тарихы Листя-шкода і користь
Листя-шкода і користь презентация межпредметного проекта Основы гармонии человека
презентация межпредметного проекта Основы гармонии человека Жасушалардың қартаюы және сомалық жасушалардың жасушалық өлу түрлер
Жасушалардың қартаюы және сомалық жасушалардың жасушалық өлу түрлер Значение коры больших полушарий головного мозга
Значение коры больших полушарий головного мозга Закономерности изменчивости: модификационная и мутационная изменчивость
Закономерности изменчивости: модификационная и мутационная изменчивость Эндемик өсімдіктер: Кауфман қызғалдағы
Эндемик өсімдіктер: Кауфман қызғалдағы Круглые черви (нематоды)
Круглые черви (нематоды) Актуальные проблемы теории и методики преподавания биологии: избранные задачи и основные трудности при подготовке к ОГЭ
Актуальные проблемы теории и методики преподавания биологии: избранные задачи и основные трудности при подготовке к ОГЭ Биогенные элементы. Классификация. Топография биогенных элементов в организме человека
Биогенные элементы. Классификация. Топография биогенных элементов в организме человека Предмет молекулярной биологии
Предмет молекулярной биологии Органы и системы органов
Органы и системы органов Первоцветы. Биологические особенности раннецветущих растений
Первоцветы. Биологические особенности раннецветущих растений Сердечно-сосудистая система. Сердце. Кровеносные сосуды. Лимфатическая система
Сердечно-сосудистая система. Сердце. Кровеносные сосуды. Лимфатическая система Функциональная анатомия вегетативной нервной системы (ВНС)
Функциональная анатомия вегетативной нервной системы (ВНС) Важнейшие методы молекулярной биологии и генной инженерии
Важнейшие методы молекулярной биологии и генной инженерии Учебно - исследовательский проект Я и Земля им. В. И. Вернадского
Учебно - исследовательский проект Я и Земля им. В. И. Вернадского Пластическая анатомия человека
Пластическая анатомия человека Методы исследования в биологии
Методы исследования в биологии Динамическая биохимия. Биологическое окисление
Динамическая биохимия. Биологическое окисление