Слайд 2

мРНҚ тізбегі үш нуклеотид бойынша оқылады
Ақпараттың РНҚ формасынан белок формасына
қайта өзгеруі дегеніміз «тасымал» немесе трансляция болып табылады,ол кезде ақпарат басқа тілге өзгеріп, мүлдем басқа белгілер қолданылады.
Сонымен қатар мРНҚ-да 4 әртүрлі нуклеотид бар, ал белокта 20 түрлі амин қышқылы бар, бұндай тасымалдың РНҚ-дағы нуклеотидтер мен белоктағы амин қышқылы арасындағы тікелей сәйкестікке байланысты деп есептеуге болмайды.
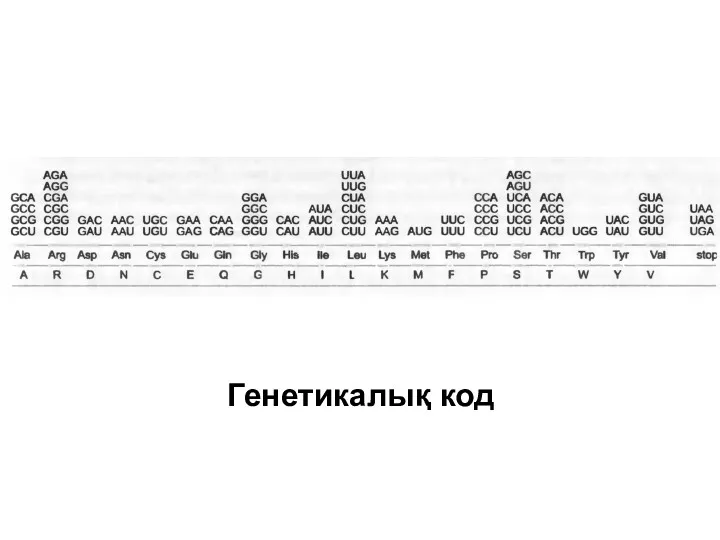
мРНҚ-ның делдалдылығы арылы геннің нуклеотидтік тізбегі белоктың амин қышқылдық тізбегіне генетикалық кодтың көмегімен трансляцияланады. Бұл код 1960 жылдардың басында оқылған болатын.
Слайд 3

мРНҚ молекуласындағы қатар біртіндеп үш нуклеотидтен тұратын топ арқылы оқылады. РНҚ
төрт нуклеотидтен тұратын сызықты полимер болып табылады, сондықтан үш нуклеотидтен:ААА, AUA, AUG және т.б. триплеттерден тұратын 4 • 4 • 4 = 64 мүмкін болатын тіркесу сәйкес келеді.
Алайда белоктарда тек 20 түрлі амин қышқылы табылады. Сәйкесінше, код артық және кейбір амин қышқылдары бір емес, бірнеше триплеттермен сәйкестенеді.
РНҚ-да үш тіркескен нуклеотидтен тұратын әр топ кодон деп аталады (codon),
Слайд 4
Слайд 5

Бұл генетикалық код барлық заманауи ағзаларда бірегей қолданылады.
Алайда кодтан бірнеше
аздаған айырмашылықтар табылған, олар митохондрияның ДНҚ-сына жатады.
Митохондрияның өзінің транскрипция жүйесі мен белок синтезі бар, олар жасушаның басқа бөлігінде басқаша жұмыс жасайды және олар өзінің кішкентай геномына лайықты әмбебап код жасап шығарған.
Слайд 6
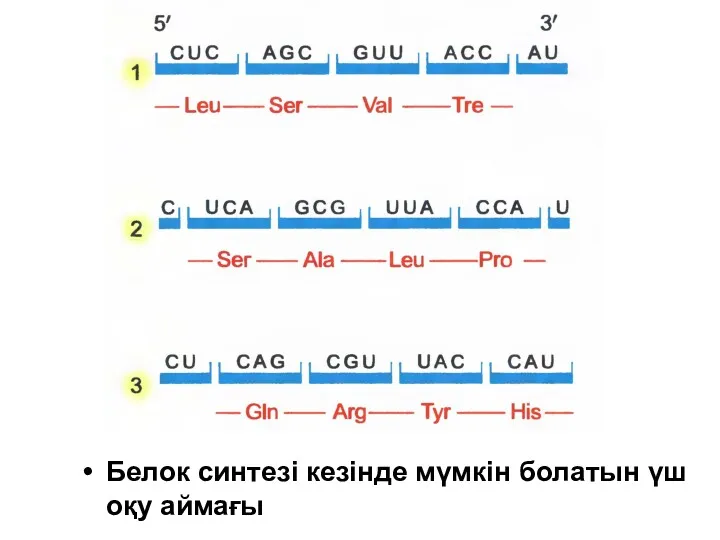
Белок синтезі кезінде мүмкін болатын үш оқу аймағы
Слайд 7

Жасушада белок синтезінің кезеңіне басты шек қоятын трансляция инициациясы – бұл
фазада старттық кодонды іздестіру және полипептидті тізбектің синтезінің басталуымен қатар, рибосомалардың матрицалық РНК қосылуы іске асады.
Эукариоттық мРНК – ның көпшілігін басатын трансляция инициациясы кэп-тәуелді тетік бойынша жүреді (~97%).
Слайд 8
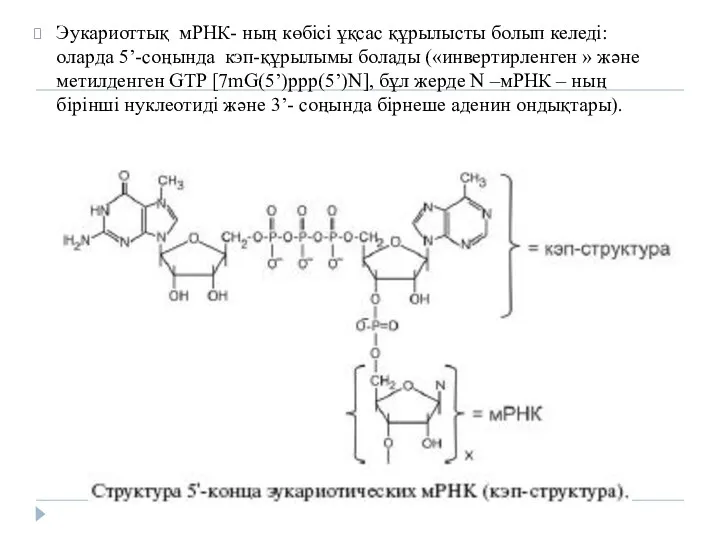
Эукариоттық мРНК- ның көбісі ұқсас құрылысты болып келеді: оларда 5’-соңында кэп-құрылымы
болады («инвертирленген » және метилденген GTP [7mG(5’)ppp(5’)N], бұл жерде N –мРНК – ның бірінші нуклеотиді және 3’- соңында бірнеше аденин ондықтары).
Слайд 9

Трансляция инициациясы процесс ін сипаттау үшін өткен ғасырдың 80-жж аяғында «
сканирлейтін модель» ұсынған болатын.
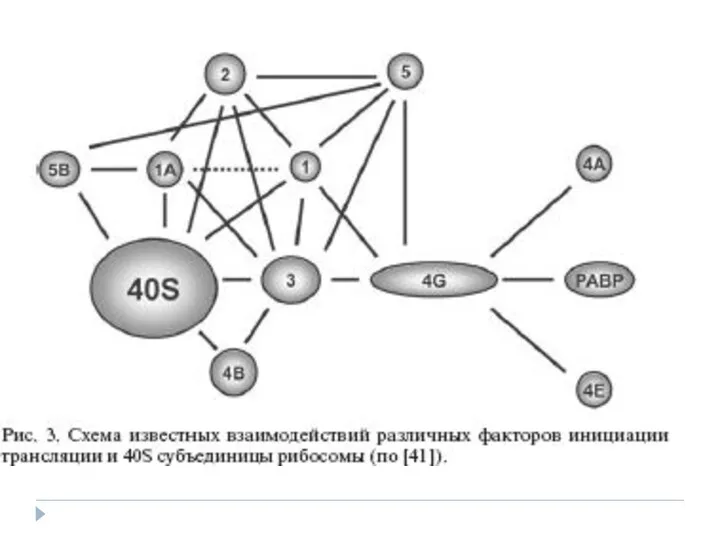
Сол модель бойынша рибосоманың кіші 40S суббірлігі трансляция инициациясының факторлары (eIF, eucaryotic initiation factor) – белоктар жиынтығы көмегімен мРНК– ның 5’-соңындағы кэп-құрылымына қосылады.
Әр түрлі факторлар кешенімен бірге 40S суббірлік комплекс түзе отырып, мРНК бойымен 3’-бағытына қарай қозғалып , AUG старттық кодонды іздестіру мақсатында трансляцияға тәуелді емес 5’ аймақтарды тексереді .
Сол кодонды тапқаннан кейін, кіші суббірлікке үлкен 60S суббірлік қосылады, яғни бүтін 80S рибосома пайда болады және полипептидті тізбектің синтезі басталады.
Слайд 10

40S суббірлікке инициаторлы мРНК қосылуы. Рибосомальді прединициаторлы кешеннің түзілуі.
Трансляция инициациясында маңызды
рөл инициаторлы тРНК (тРНКiМет) атқарады. Тап соның көмегімен, кодон-антикодон өзара әрекеттесу арқылы, сканирлейтін кешен старттық AUG-кодонын табады.
Бірақ AUG триплет сонымен бірге– метионин – амин қышқылын кодтайды және элонгация сатысында лайықты тРНК таниды.
Жасушада метионинді тРНК – ның екі түрі бар: тРНКіМет және тРНКmМет. Біріншісі тек қана инициация кезеңінде , екінші – элонгация кезінде қолданылады.
Трансляция инициациясында тРНКiМет қатысуы үш әртүрлі суббірліктен тұратын ( альфа, бета және гамма) eIF2 инициация факторының болуын қамтамасыз етеді.
Гамма-суббірлік арқылы аминоацилирленген инициаторлы тРНК мен GTF молекуласының байланысы іске асады, бета-суббірлік арқылы eIF2B және eIF5 факторларыныцң өзара әрекеттесуі болады,альфа суббірлік eIF2 белсенділігін реттеуге қатысады (оның құрамындағы серин 51 фосфорлау арқылы).
ТРНКiМет және eIF2 үш жақтылық кешен - тРНКiМет – eIF2-GTP құрамында трансляция инициясына қатысады. Осы кешеннің рибосоманың 40S суббірлікгі және eIF1, eIF3, eIF1A факторлардың өзара байланысы,рабосомальді прединициаторлы кешеннің қалыптасуына алып келеді.
Слайд 11
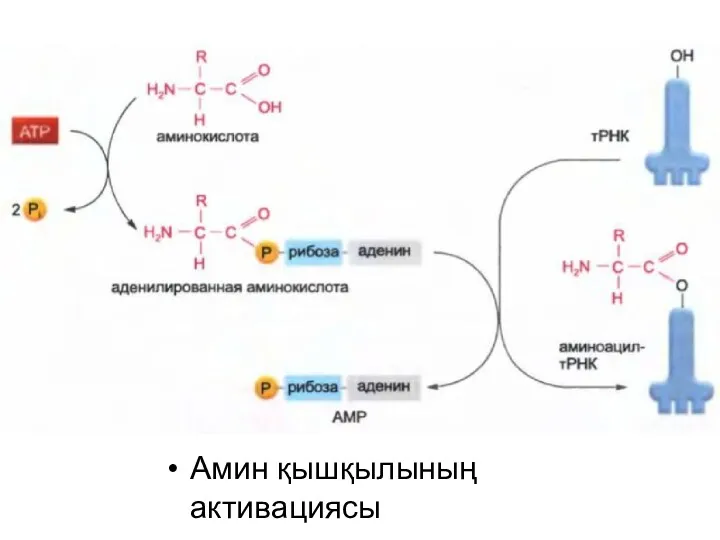
Амин қышқылының активациясы
Слайд 12
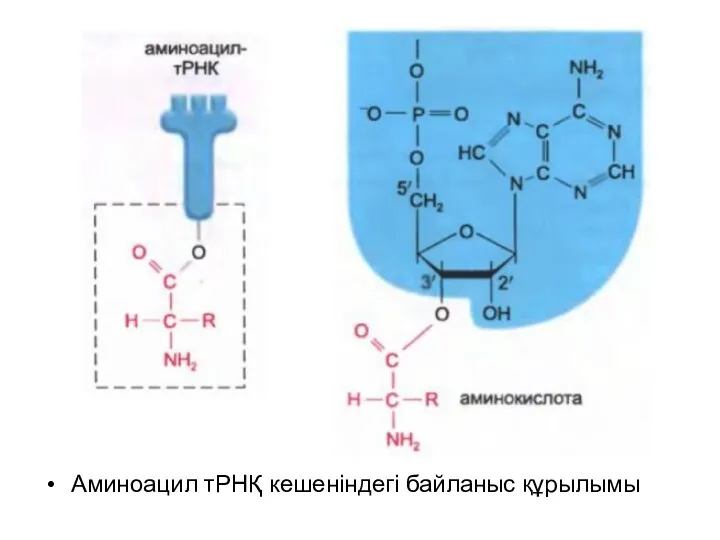
Аминоацил тРНҚ кешеніндегі байланыс құрылымы
Слайд 13

Слайд 14

мРНК –ң трансляция инициациясына дайындалуы
Эукариот жасушасында бос мРНК, әдетте РНК
байланыстыратын белоктармен бірге болып, рибонуклеопротеид (РНП) түзеді.
Трансляция инициациясы үшін РНП 5’-соңын белок молекуласынан тазалау керек, сонымен қатар оның құрамындағы екіншілік құрылымдарды ширату керек. Бұл функция үш әр түрлі белок суббірлігінен тұратын (eIF4E, eIF4G және eIF4A) еIF4 факторы арқылы жүзеге асады.
мРНК 5’-соңында eIF4E кэп-құрылымға жақын болып келеді және сол арқылы мРНК-ға eIF4F қосылады.
Осы процесске қатысатын әр түрлі белоктар арасында байланысты қамтамасыз ете отыра eIF4G факторы трансляция инициациясында маңызды рөл ойнайды.
eIF4A АТР энергиясын қолдана отырып мРНК- ның 5’-соңында екіншілік элементтерді ширата алатын РНК-ға тәуелді хеликаза болып табылады. Бұл процесті eIF4B және eIF4H факторы стимулдайды.
Слайд 15

Прединициаторлы кешеннің мРНК-ға қосылуы
4-ші топ факторлары көмегімен «Активтенген» мРНК өзіне рибосомальді
прединициаторлы кешенді қоса алады.
Ол қосылысты мүмкін прединициаторлы кешен құрамындағы eIF4G –мен eIF3 жүзеге асырады, сол арқылы 40S суббірлік және тРНКiМет мРНК-ның 5’-соңында болады.
Слайд 16

мРНК инициаторлы AUG кодонын іздеу барысында сканирлеу
Келесі кэп-тәуелді трансляция инициациясы ның
маңызы мРНК құрамындағы AUG кодонын іздеу болып табылады.
Әр триплетті антикодон тРНКiМет комплементарлын тексере отыра, 40S суббірлік инициация факторлар мен бірге кешенде м РНК бойымен 3’-бағытында қозғалады деп саналады.
Контекст AUG-кодонының қасында қандай нуклетидтер орналасу байланысына инициаторлы кодоның тану мүмкіншілігі тәуелді.
Жануарларға оптимальды нуклеотидті контекст келесі түрде екені анықталды: GCC(A/G)CCAUGG.
Ашытқлармен өсімдңктер үшін ол басқа (AAAAAUGUCU және AA(A/C)A-AUGGC) .
eIF1 AUG-кодонды дұрыс тану үшін қажет және онысыз сканирлейтін комплекс стартты триплет контексін “танымайды”.
Слайд 17

80S рибосомның AUG-кодонында жаналуы
Инициаторлы тРНК антикодоны рибосоманың AUG 40S суббірлігіне
дұрыс қосылғаннан кейін инициация факторларынан босайды. Бұл процессті eIF5 және eIF5B факторлары жүзеге асырады.
Кодон-антикодон байланысы eIF2 конформациясының өзгеруіне алып келеді,ол өз кезігінде үш жақтылық кешен құрамындағы GTP алып келеді.
GTP гидролизі eIF5 көмегімен жүзеге асады, ол GAP-белок (GTPase activating protein)болып табылады және eIF2 бета-суббірлігімен байланысады.
60S суббірліктің қосылуы және AUG-кодонында 80S рибосоманың жиналуы үшін eIF5B факторымен байланыстағы тағы бір GTP молекуласының гидролизі керек.
40S және 60S қосылуын eIF5B және GTP комплексі қамтамасыз етеді, ал гидролиз eIF5B диссоциациясы үшін керек.
Слайд 18

eIF2-GDP-тің eIF2-GTP-ге айналуы
Үш жақты кешеннің құрамында GTP гидролизі eIF2-GDP босалуына алып
келеді.
Көптеген G-белоктар сияқты, eIF2 GDP –мен 100 есе берік байланысады, GTP-ға қарағанда. Бірақ трансляция инициациясы бастапқы кезеңінің GTP кешеніне eIF2 керек.
Ол үшін GDP мен орын алмасуын қамтамасыз ететін eIF2 кешенінде арнайы белок eIF2B болады.
Слайд 19

мРНК-ның 3’-соңы трансляция инициациясына қатысуы
3’-НТО-ғы поли - А- тізбегі мРНКны
3’-5’ деградациясынан тек қорғап қана қоймай, сонымен қатар кэп тәуелді трансляция инициациясына белсенді қатысады.
поли-А-ң трансляция инициациясына қатысуын қамтамасыз ететін идентифицирленген белок - поли-А-байланыстырушы белок немесе РАВР (poly-Abinding protein).
Осы белоктың бірнеше молекулалары поли-А-ға кооперативті қосылу арқылы мРНК 3’-соңын жабады.
РАВР және eIF4G келесі тізбектерді байланыстырушы:
5’-соңы мРНК-кэп-eIF4E-eIF4G-PABP-3’-соңы мРНК.
РНК белокты және белок-белокты өзара әрекеттесулердің арқасында трансляция инициациясы процессінде мРНК тұйықталған сақинада болады.
Слайд 20
Слайд 21

Бактерияларда тек үш инициация факторы белгілі - IF1, IF2 және IF3,
эукариоттарда - 9 канондық және қосалқы мРНК қатары -өзара байланыстырушы белок трансляцәия инициациясын іске асырады.
Прокариоттық мРНК көпшілігі полицистрондар және өз полинуклеотидтік тізбектердің ішкі бөлімшелерінде кіші рибосома суббірліктерін байланыстыра алады, ал эукариоттар мРНКсы моноцистронды және басым көпшілігінде біріншілік рибосомалық 40S суббірлік бөлшектері байланысуы тек қана мРНК 5‘-соңында болады.
Бұл ережегеден ерекше РНКлы вирустарда және эукариоттардың мРНКсында табылған, рибосомалардың ішкі бөліктерін байланыстыратын немесе IRES-элементтері (Internal Ribosome Entry Site).
Бірақ Шайна-Далгарно сигналынан және A, U - бай тізбектерінен айырмашылығы, бактериялардың S1 белогы арқылы танитын,осы уақытқа орай зерттелген IRES - элементтері - олар ұзын (300-400н.) және трансляция эукариоттық трансляция аппаратын жоғары арнаулы бөлімшелерін жеке компоненттерімен байланыстыратын күрделі құрылымдар.
Слайд 22

Белок синтезінің инициациясынан кейін әр жаңа амин қышқылы төрт шагтан тұратын
(тРНҚ-ның байланысуы, пептидтік байланыстың түзілуі, үлкен суббөлшектің транслокациясы және кіші суббөлшектің транслокациясы) реакция циклындағы өсіп жатқан тізбекке қосылады.
Транслокацияның екі шагының нәтижесінде барлық рибосома мРНҚ бойымен үш нуклеотидке жылжиды және басқа циклды бастауға дайын болады.
Бірінші шагта тізбекке арналған келесі амин қышқылын алып жүрген тРНҚ рибосоманың А-участогымен баййланысады, нәтижесінде мРНҚ кодоны орналастырылған негіз жұбын түзеді, сол себепті Р және А сайты бір бірімен байланысқан тРНҚ-дан тұрады.
Екінші шагта полипептидтік тізбектің карбоксилдік ұшы Р сайтындағы тРНқ-дан шығып А сайтындағы тРНҚ-мен байланысқан амин қышқылының бос амин тобымен байланысады, нәтижесінде жаңа пептидтік байланыс түзіледі.
Үшінші шагта үлкен суббірлік кіші суббірлікпен ұсталып тұрған мРНҚ-ға жылжып, нәтижесінде тРНҚ-ның екі молекуласының акцепторлық сабақшаны үлкен суббірліктің Е және Р сайттарына тасымалдайды.
Төртінші шагта , конформациялық өзгерістің кезекті тізбегінің нәтижесінде кіші суббірлік және онымен байланысқан мРНҚ нақты үш нуклеотидке жылжып, соның салдарынан рибосома бастапқы қалпына келеді және келесі аминоацил-тРНҚ-ны қабылдай алады.
Слайд 23
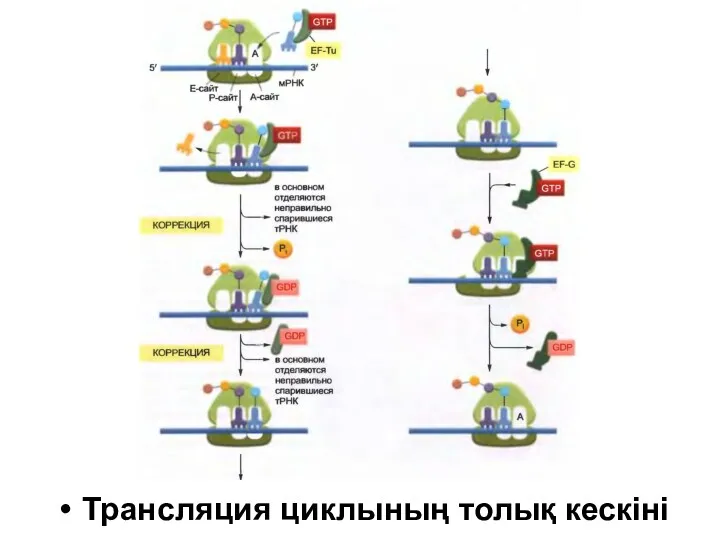
Трансляция циклының толық кескіні
Слайд 24

Элонгация факторы трансляцияны алға жүргізеді және оның нақтылығын арттырады
Элонгацияның екі факторы
рибосомаға кіреді және әр циклдың басында одан босап шығады: олардың әрқайсысы конформациялық өзгеріске ұшырай отырып, GTP-ны GDP-ға дейін гидролиздейді.
Бактерияларда бұл факторлар EF-Tu және EF-G деп аталған, ал эукариоттарда — EF1 және EF2 деп аталған.
Слайд 25

EF-Tu бір уақытта GTP мен аминоацил-тРНҚ молекуласын байланыстырады.
Трансляцияны алға жылжытуға
көмектескеннен бөлек, EF-Tu (эукариоттардағы EF1 ) бірнеше әдістер арқылы трансляцияның нақтылығын арттырады.
Біріншіден, EF-Tu рибосомаға берілген аминоацил тРНҚ-ны жөнелтер кезде ол тРНҚ-амин қышқылы сәйкестігі дұрыс па екендігін тексереді.
Екіншіден, EF-Tu А участоктағы мРНҚ кодоны мен сәйкес келетін аминоацил-тРНҚ антикодоны арасындағы біріншілік әрекеттесуді қадағалайды.
Слайд 26

Кодон-антикодон сәйкестігінің дұрыстығы РНҚ механизмі негізінде қалыптасқан рибосома арқылы бағаланады.
Рибосоманың
кіші суббірлігінің рРНҚ-сы кодон-антикодон жұбымен бірге сутегі байланысын түзеді, ол оның дұрыстығын анықтауға мүмкіндік береді.
Негізінде рРНҚ кодон-антикодон жұбының айналасында оралады, оның нақты тұйықталуы тек онда дұрыс антикодон орналасқан кезде ғана жүреді, сосын оның тұйықталуы GTP гидролизін іске қосады.
«Еріксіз сәйкес келу» механизмі кодон-антикодон типінің дұрыс немесе қате әрекеттесуін анықтауға қабілетті болып табылады
Слайд 27
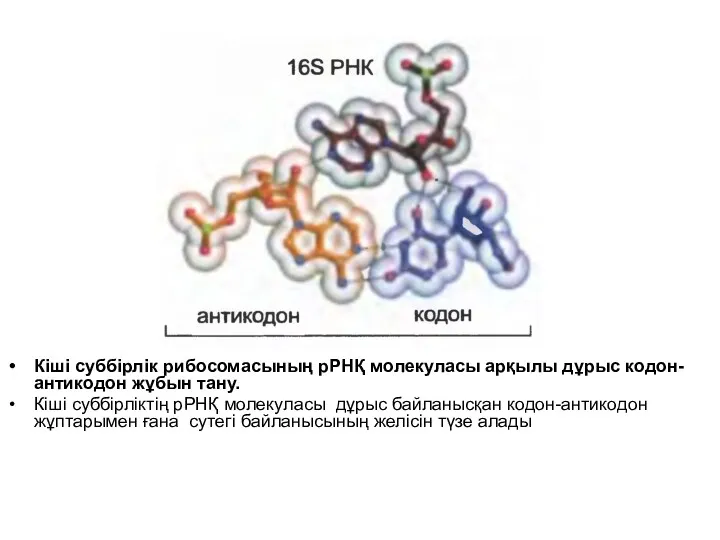
Кіші суббірлік рибосомасының рРНҚ молекуласы арқылы дұрыс кодон-антикодон жұбын тану.
Кіші
суббірліктің рРНҚ молекуласы дұрыс байланысқан кодон-антикодон жұптарымен ғана сутегі байланысының желісін түзе алады
Слайд 28
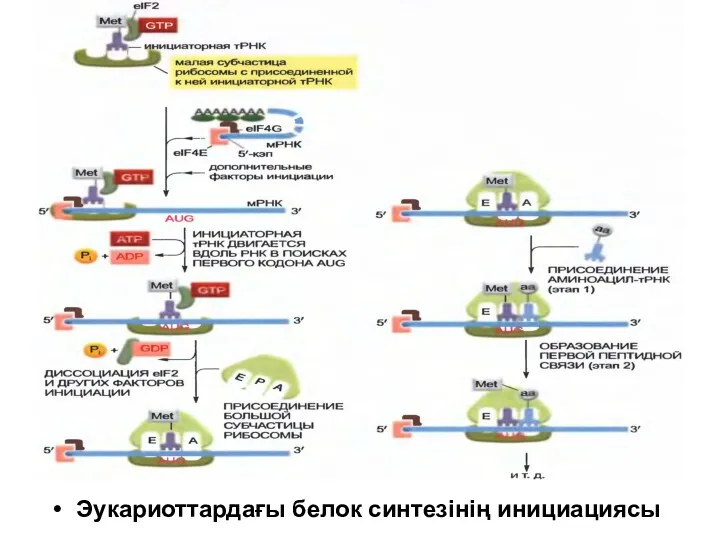
Эукариоттардағы белок синтезінің инициациясы
Слайд 29

Стоп-кодон трансляцияның аяқталуын белгілейді
Стопкодондардың біреуінің болуы кодтаушы белок хабарламасының аяқталғандығын айтады
(UAA, UAG немесе UGA).
Олар тРНҚ арқылы танылмайды және ешқандай амин қышқылын кодтамайды, бірақ оның орнына трансляцияның аяқталғандығын білдіретін сигнал ретінде табылады.
А - участогында стоп кодон кездесетін кез келген рибосомамен белоктар байланыса алады, олар трансляцияның терминация факторлары деп аталады, олар амин қышқылының орнына су молекуласының пептидил-тРНҚ-ға байланысуын катализдеуді рибосомалық пептидилтрансферазаға мәжбүрлейді.
Бұл реакция өсіп жатқан полипептидтік тізбектің карбоксилдік ұшын тРНҚ молекуласымен байланысудан босатып жібереді. Осы байланыс рибосомада өсіп жатқан полипептидті ұстап тұрған кезде аяқталған белоктық тізбек жылдам цитоплазмаға босап кетеді.
Слайд 30

Трансляцияның инициация машинасы бастамас бұрын 5´-кэп және полиА-ұшты таниды.
Трансляцияның басталуына
дейін экзондардың байланысу кешені (EJC) мРНҚ молекуласының қажетті түрде сплайсингтелгенін нақтылауға көмектеседі: сплайсингтелген мРНҚ-ға орналаса отырып, ол оның белокқа трансляциялануын стимулдайды.
мРНҚ-ның нонсенс жанама ыдырауы олардың белокқа трансляцияланбауына дейін мРНҚ молекуласының ақауларын жөндейді.
Бұл механизм керек емес жерде мРНҚ молекуласында стоп-кодон (UAA, UAG или UGA) бар болған деп жасуша анықтаған кезде ғана іске қосылады.
Слайд 31
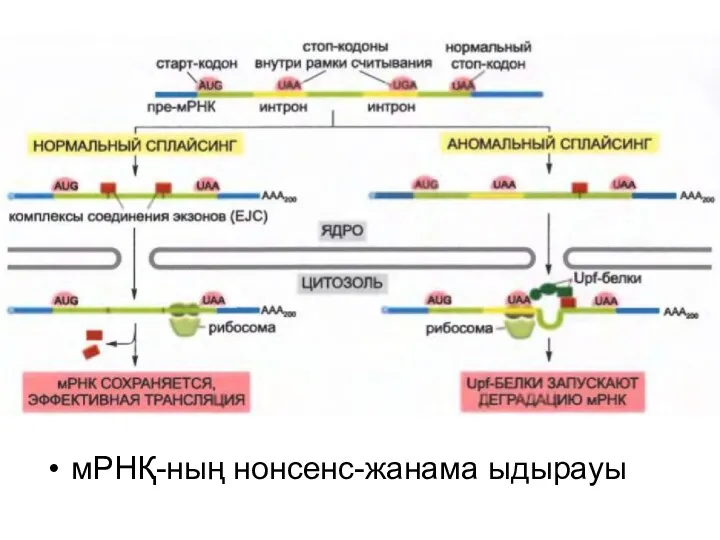
мРНҚ-ның нонсенс-жанама ыдырауы
Слайд 32

Белок құрамына кіретін амин қышқылы тізбегін құру үшін генетикалық код қолданылған
кезде ген экспрессиясы процесі аяқталмайды.
Жасушаға пайдалы болу үшін жаңа полипептидтік тізбек өзінің бірегей үшөлшемді конформациясына айналып, конфактор ретіндегі кіші молекуламен байланысып, протеинкиназамен немесе басқа модификациялааушы белок ферменттермен модификацияланып, басқа белоктық суббірліктермен дұрыс жиналуы керек.
Жоғарыда айтылған барлық шагтар үшін қажетті ақпарат мРНҚ молекуласын полипептидтік тізбекке тасымалдаған кезде рибосома жасап шығаратын бір бірімен байланысқан амин қышқылы тізбегінде жинақталған.
Слайд 33
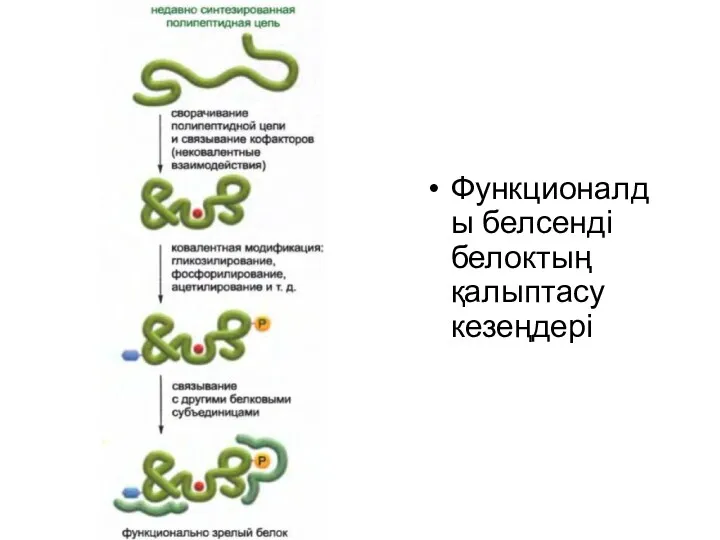
Функционалды белсенді белоктың қалыптасу кезеңдері
Слайд 34

Полипептидтік тізбектің жинақталған құрылымға айналуы кезінде көптеген гидрофобты қалдықтар оның ішінде
қалып қояды. Сонымен қатар молекуланың әртүрлі бөлшектерінің арасында көптеген коваленттік емес байланыс түзіледі.
Осы барлық қолайлы байланыстардың ортақ жиынтығы оралған полипептидтік тізбектің соңғы моделін анықтайды.
Слайд 35
Слайд 36

Барлық белоктар өзінің синтезі кезінде жұмыршақталмайды. Рибосомадан шығар кезде оларды арнайы
тағайындалған белоктар-молекулалық шаперондар күтіп алады.
Көптеген молекулалық шаперондар ыстық ұру белоктары деп аталған (heat shock protein), өйткені жасушаға жоғары температурамен әсер еткен кезден кейін олардың синтезі бірден артады. Бұл дұрыс емес оралған белоктардың артуына әкеліп соғады, нәтижесінде шаперон синтезі ұлғайады және ол осы белоктардың қайтадан басында қалай болу керек болса, солай оралуына көмектеседі.
Эукариоттардың молекулалық шаперондарының бірнеше басты түрлері бар. Олар Hsp60 және Hsp70 белоктары. Әртүрлі түрдегі мүшелер әртүрлі органеллаларда әрекет етеді.
Слайд 37

Барлық Hsp белоктары толықтай емес оралған белоктардың беткейіндегі гидрофобтық учасоктарға ұқсас
болып келеді және АТФ гидролазасының әр циклынан белок-субстратын босата және байланыстыра отырып ,АТФ-ті гидролиздейді.
Hsp 70 белогынан тұратын машинасы белок рибосоманы тастап кеткенге дейін жеті гидрофобты амин қышқылнан тұратын тізбекпен байланыса отырып, көптеген белоктардың түзілуінің ерте сатысында әсер етеді.
Керісінше, Hsp60-сияқты белоктар үлкен бөшке тәріздес құрылым түзеді, ол белок толықтай синтезделгеннен кейін ғана әсер етеді. Ол ажыратушы камераны қалыптастырады, оған қате оралған белоктар жеткізіліп отырады. Бұнда олардың жөнделуіне және қажетті формаға айналуына мүмкіндік бар.
Слайд 38
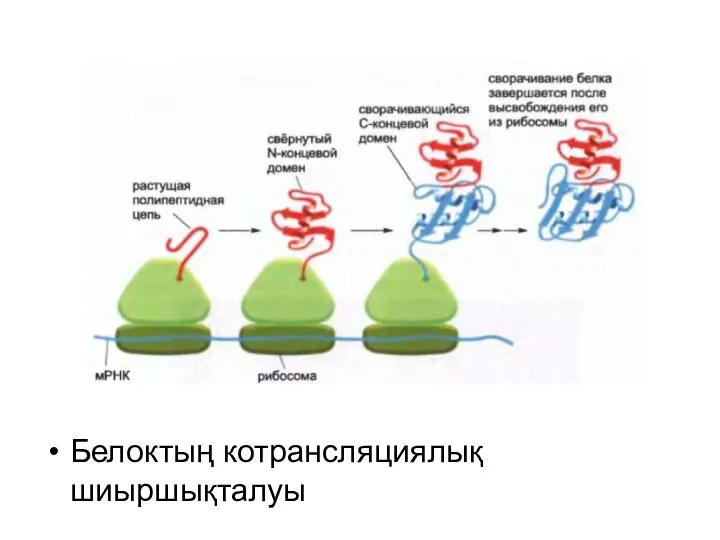
Белоктың котрансляциялық шиыршықталуы
Слайд 39

Шамадан тыс экспонирленген гидрофобты аймағы бар көптеген белоктар жасушада үлкен агрегаттарды
түзе алады.
Егер рефолдинг әрекеті сәтсіз болса, протеолиз әдісімен белок толықтай жойылады.
Аберранттық белоктарды жоятын қондырғы протеосома түрінде болады, олар АТФ-тәуелді протеазаның көп мөлшерімен жасушада кездеседі, ал АТФ тәуелді протеаза жасуша белогының 1% -ын құрайды.
Слайд 40
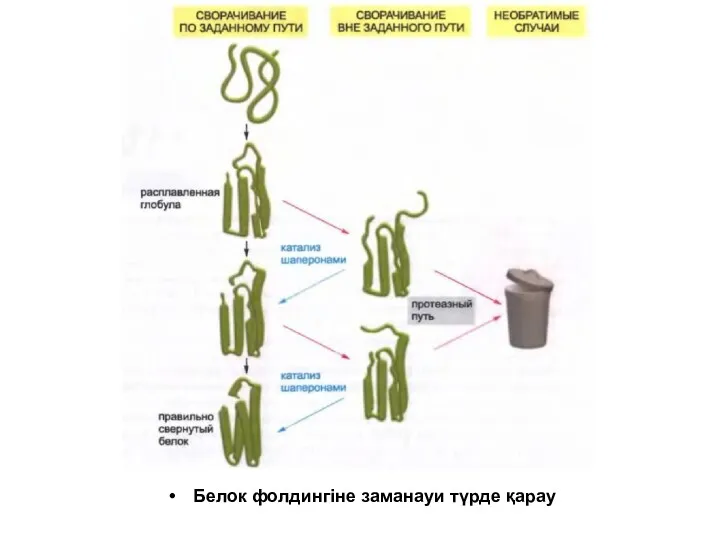
Белок фолдингіне заманауи түрде қарау
Слайд 41

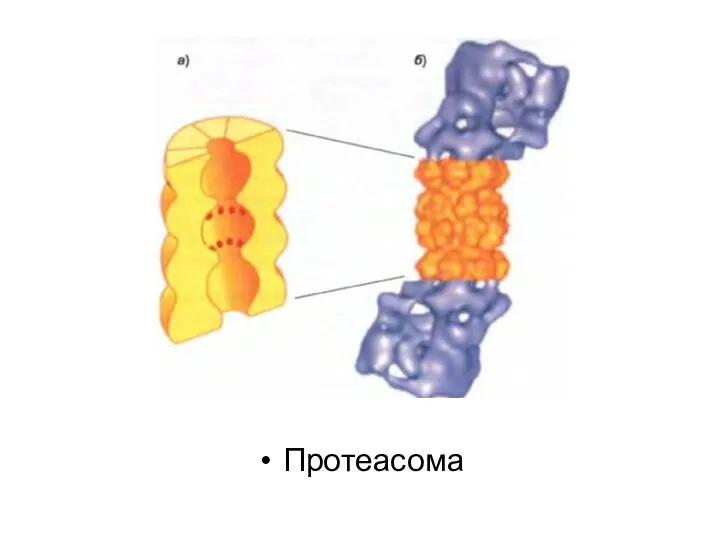
Протеасома көптеген белоктық суббірліктерден түзілген және төрт гептамерлік сақинадан тұратын квазицилиндрлік
түтік түрінде жиналған орталық қуыс цилиндрден тұрады.
Бұл суббірліктердің кейбіреулері әртүрлі протеаза болып табылады, олардың белсенді участоктары цилиндрдің ішкі камерасына айналған.
Цилиндрдің әр ұшы ірі белоктық кешенмен байланысқан (19S-қақпақша, немесе кэп), олар алты суббірліктен тұратын белоктық сақина болып табылады. Олар арқылы нысана белоктар протеасоманың ядросына келіп түседі, сол жерде деградацияға ұшырайды.
«Жіпшенің сабақталу» реакциясы қақпақша арқылы мақсатты белоктардың жылжуына қарай, протеасоманың ядросын төсейтін протеаза алдында оларды жалаңаштап бұзады.
Слайд 42
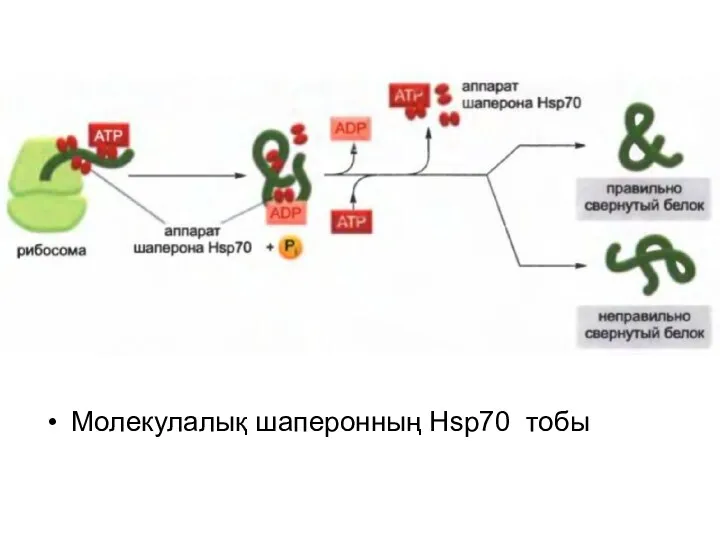
Молекулалық шаперонның Hsp70 тобы
Слайд 43

Протеасоманың қалпақшасында сақиналы құрылымы бар белоктар ААА белоктары ретінде танымал белоктық
«анфолдаздың» үлкен класына жатады.
19S-қалпақшалар реттеуші «бекіткіштер» ретінде протеолиздік камераға кіру кезінде әрекет етеді және мақсатты белок-субстраттың протеасомамен байланысуына жауап береді.
Протеасомалар арнайы түрде бұзуға арналған белоктарға әсер етеді: олармен ковалентті түрде кішкентай белоктармен түзілген убиквитин деп аталатын «танушы таңба» байланысқан.
Слайд 44
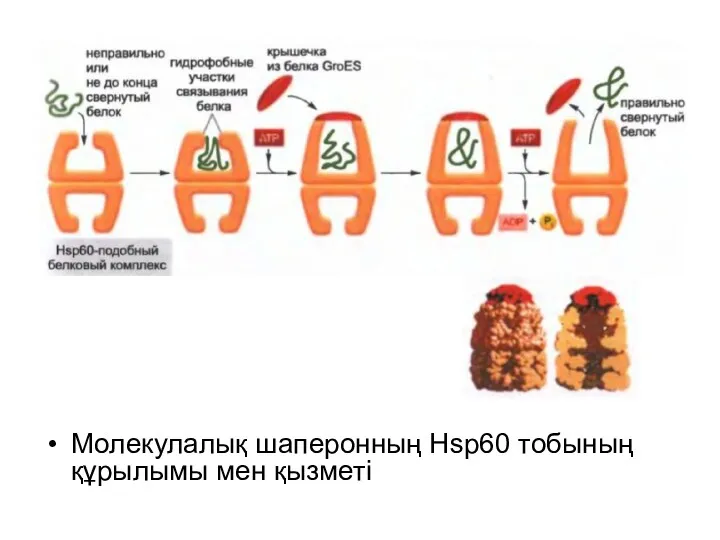
Молекулалық шаперонның Hsp60 тобының құрылымы мен қызметі
Слайд 45
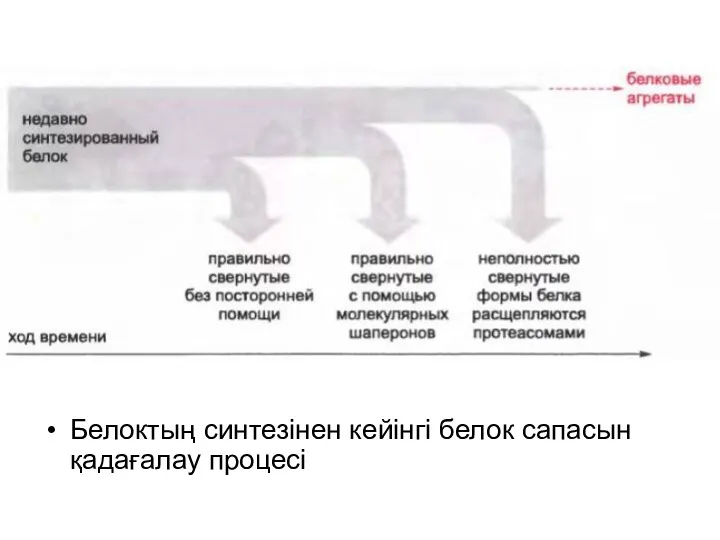
Белоктың синтезінен кейінгі белок сапасын қадағалау процесі
Слайд 46
Слайд 47

Убиквитиннің басқа белоктармен конъюгациясы үшін дайындығын АТФ тәуелді убиквитин-белсендіруші фермент (Е1)
жүргізеді- ол белсендірілген Е1-байланысқан убиквитинді қалыптастырады, соның салдарынан убиквитин-конъюгациялаушы (Е2) фермент жинағының біреуіне беріледі.
Е2 ферменті бір тізбекте қосымша белоктармен (Е3) бірге әсер етеді. Убиквитинлигаза деп аталатын Е2-Е3 кешенінде Е3 компоненті дегрон деп аталатын деградацияға арналған спецификалық сигналдар арқылы байланысып, Е2 ферментіне белок субстратының лизинмен байланысқан полиубиквитин тізбегін қалыптастыруға көмектеседі.
Бұндай тізбекте әр убиквитиннің С-ұшының қалдығы алдыңғы убиквитин молекуласымен белгілі бір лизин арқылы байланысқан, нәтижесінде убиквитин-убиквитиндік конъюгат тізбегі түзіледі. Арнайы белоктағы дәл осындай полиубиквитин тізбегі протеасомадағы спецификалық рецепторлармен танылады.
Слайд 48
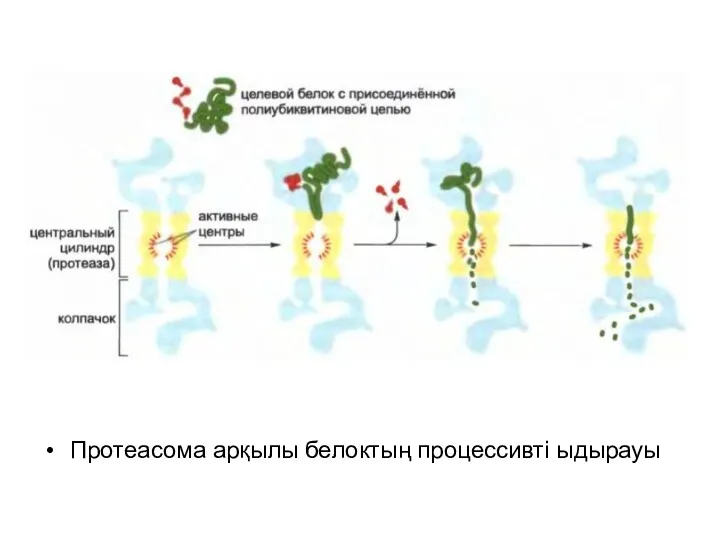
Протеасома арқылы белоктың процессивті ыдырауы
Слайд 49
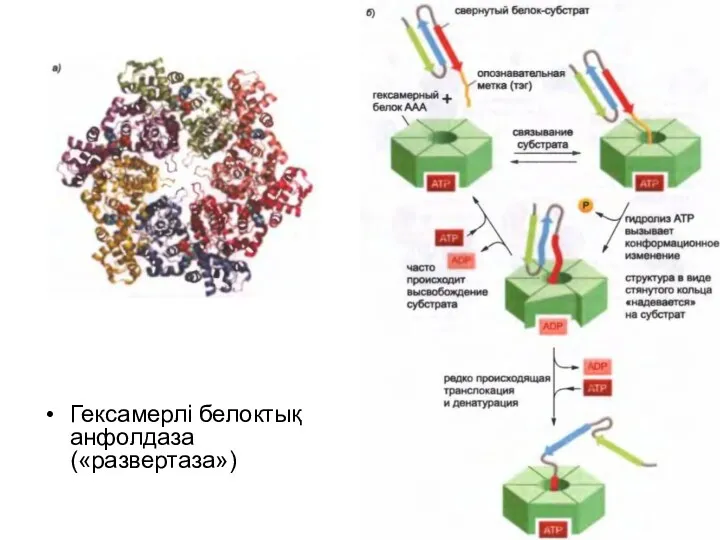
Гексамерлі белоктық анфолдаза («развертаза»)
Слайд 50
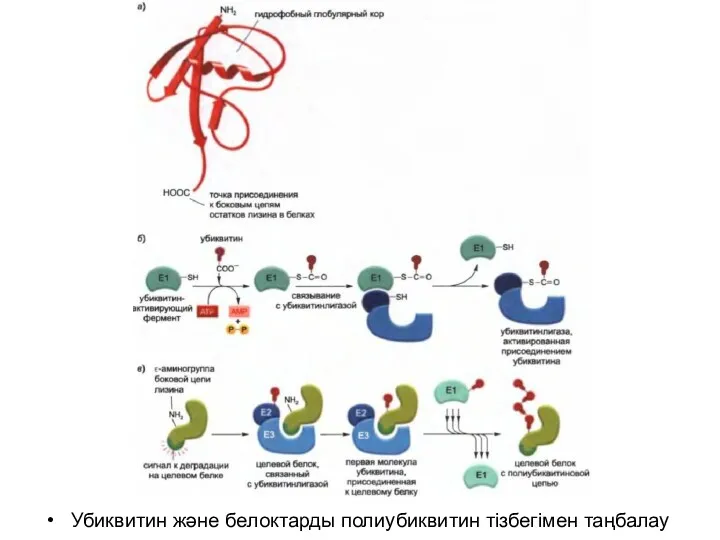
Убиквитин және белоктарды полиубиквитин тізбегімен таңбалау
Слайд 51
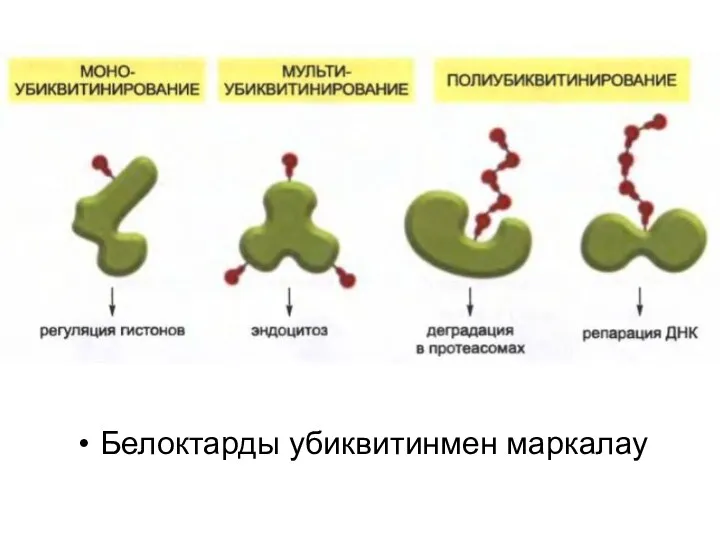
Белоктарды убиквитинмен маркалау
Слайд 52
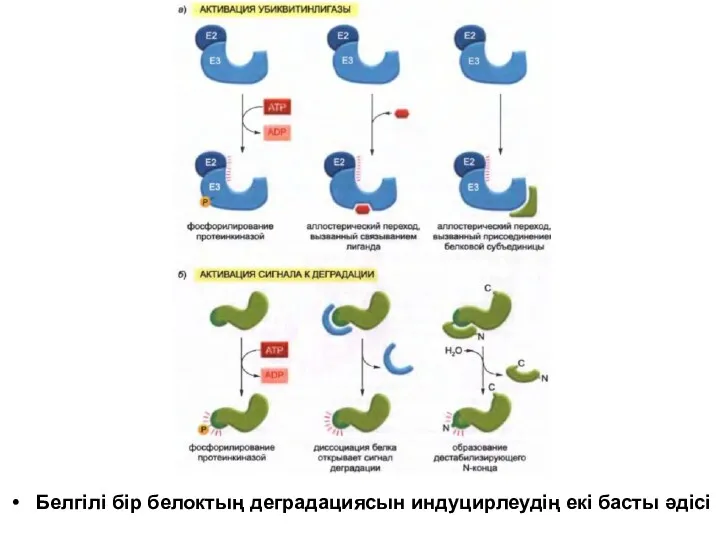
Белгілі бір белоктың деградациясын индуцирлеудің екі басты әдісі
Слайд 53

Сау дарақтардағы жасушада кездесетін белок сапасын тексеретін жүйенің біртіндеп әлсіреуі салдарынан
қалыпты белоктар арқылы агрегат түзіліп, нәтижесінде ауруға әкеліп соғуы мүмкін.
Кейбір жағыдайда белоктық агрегаттар өлі жасушадан шығып, ұлпаның барлық жасушасын қоршап жатқан жасушадан тыс матриксте жиналуы мүмкін және ең құрығанда олар ұлпаны зақымдауы мүмкін.
Себебі ми жүйке жасушасының жоғары ұйымдасқан жүйесінен тұрады, ол әсіресе осал. Белоктық агрегаттар бәрінен бұрын нейродегенеративті ауруларды тудырады. Мысалы, Хантингтон және Альцгеймер аурулары.
Слайд 54
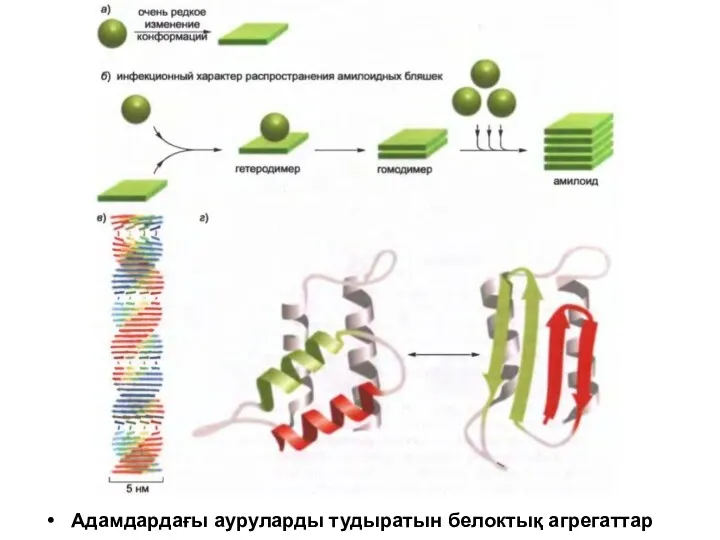
Адамдардағы ауруларды тудыратын белоктық агрегаттар
Слайд 55

Адамдардағы аурудың туындауына әкеп соғатын белоктық шоғырланудың көбісі полипептидтік тізбектен тұратын,
бір біріне β-жапырақшаларының үйіндісі түрінде орналасқан фибриллалар түзеді.
Бұл «кросс-бета» деп аталатын құрылым немесе «кросс-бета» филамент құрылымы, ол протеолизге төзімді, белоктық агрегаттар арқылы туындаған көптеген жүйке жүйесінің бұзылуларында кездеседі,амилоид ретінде танымал анық көрінетін түйіншелерді түзеді.
Слайд 56

Приондық аурулар
Хантингтон және Альцгеймер ауруларымен салыстырғанда приондық аурулар бір ағзадан екінші
ағзаға берілуі мүмкін, егер сол екінші ағза белоктық агрегаттан тұратын ұлпа болып табылатын болса.
Қойларда қышыма қотыр ауруы, адамдарда Крейфельд-Якоб ауруы және ірі қара малдарда-тесік-тесік энцефалопатия ауруы деп аталатын ауру топтары PrP (прионный белок) деп аталатын белоктың агрегатталған , қате оралған формасының болуына байланысты қалыптасады.
PrP негізінен плазмалық мембрананың сыртқы бетінде орналасқан, әсіресе оның нейрондарында. Оның қалыпты қызметі белгісіз.
Слайд 57

PrP тіптен спецификалық аномальды конформацияға өту тенденциясына ие.
Бұл конформация протеазаға
төзімді «кросс-бета» құрылымдарды ғана қалыптастырып қоймайды, сонымен қатар ол «жұқпалы», себебі қалыпты оралған PrP молекуласын сондай патологиялық формаға айналдыра алады.
Бұл қасиет оң кері байланысқа ие ілмектің қалыптасуына әкеледі, онда PrP-дың аномальды формасы (PrP* деп аталады) мида, жасушадан жасушаға патологиялық конформацияның тез таралуына әкеп соғады,соңында адамдар мен жануарлардың өліміне әкеледі.
Слайд 58
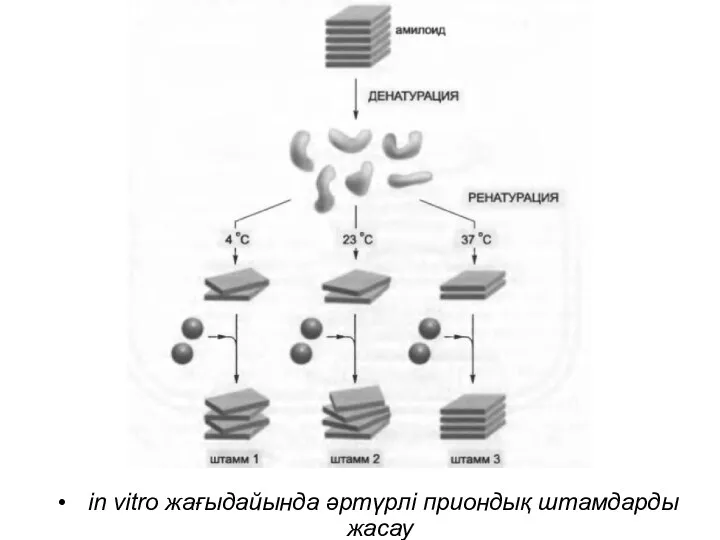
in vitro жағыдайында әртүрлі приондық штамдарды жасау
Слайд 59
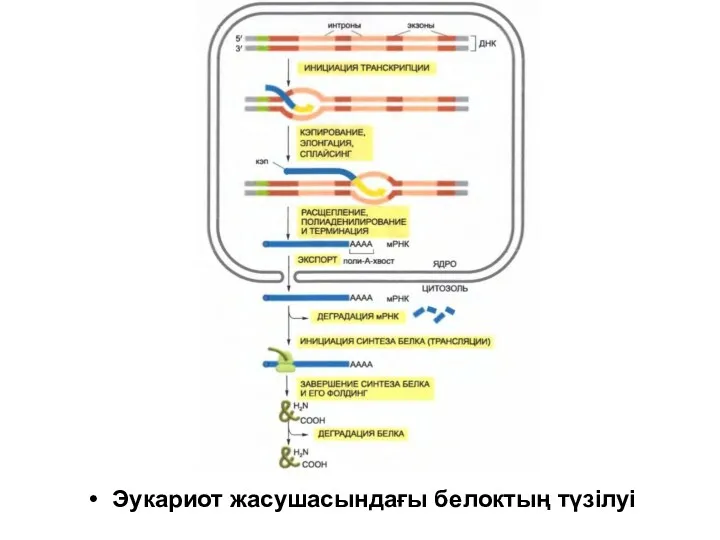
Эукариот жасушасындағы белоктың түзілуі


























































 Nucleic acids
Nucleic acids Развитие органического мира на Земле
Развитие органического мира на Земле Эволюция опорно- двигательной системы у животных
Эволюция опорно- двигательной системы у животных Апаптоз кезіндегі молекулалық оқиғалардың жалпы сипаттамасы
Апаптоз кезіндегі молекулалық оқиғалардың жалпы сипаттамасы Минирующие насекомые. (Лекция 8)
Минирующие насекомые. (Лекция 8) Фотосинтез
Фотосинтез Уголок живой природы как средство формирования исследовательских способностей обучающихся по биологии
Уголок живой природы как средство формирования исследовательских способностей обучающихся по биологии Индивидуальное развитие организмов
Индивидуальное развитие организмов Информация и ее роль в обществе
Информация и ее роль в обществе Структура и содержание курса общей биологии. 10 класс
Структура и содержание курса общей биологии. 10 класс Бактериалық жасушаның химиялық құрамы
Бактериалық жасушаның химиялық құрамы Class ear
Class ear Среда обитания
Среда обитания Цветы. Уход за цветами
Цветы. Уход за цветами Цветочная карусель
Цветочная карусель Стадии онтогенеза почв
Стадии онтогенеза почв Дыхательная система
Дыхательная система Wild and domestic animals
Wild and domestic animals Лимфатическая система
Лимфатическая система Учебный проект Экспериментальное определение качества молочной продукции
Учебный проект Экспериментальное определение качества молочной продукции Животные Севера
Животные Севера Cад (окружающий мир, 1 класс)
Cад (окружающий мир, 1 класс) Эндокринная система человека
Эндокринная система человека Первоцветы. Биологические особенности раннецветущих растений
Первоцветы. Биологические особенности раннецветущих растений Дикая природа России
Дикая природа России Водоросли. Общая характеристика
Водоросли. Общая характеристика Сторінками Червоної книги України
Сторінками Червоної книги України Основные загрязнители почвы
Основные загрязнители почвы