Содержание
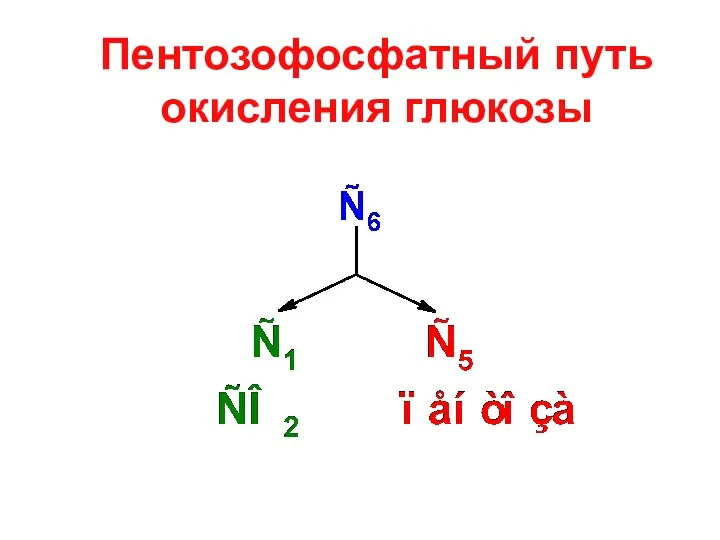
- 2. Пентозофосфатный путь окисления глюкозы
- 3. Стадии пентозофосфатного пути окисления глюкозы 1. окислительная стадия 2. неокислительная стадия
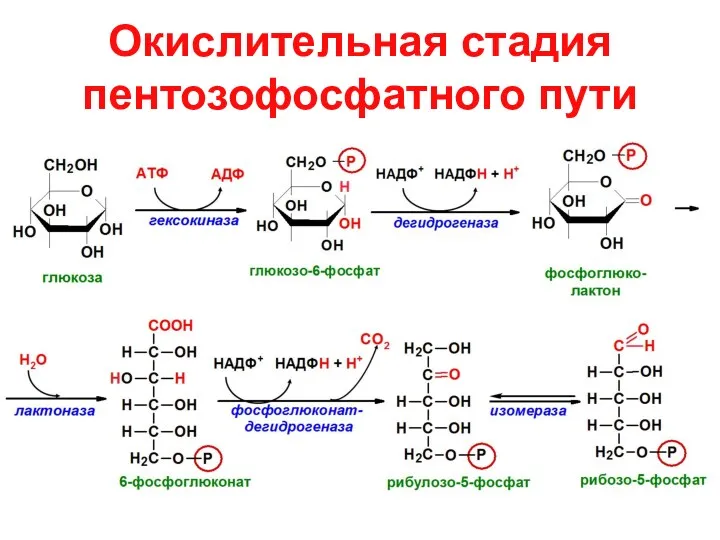
- 4. Окислительная стадия пентозофосфатного пути
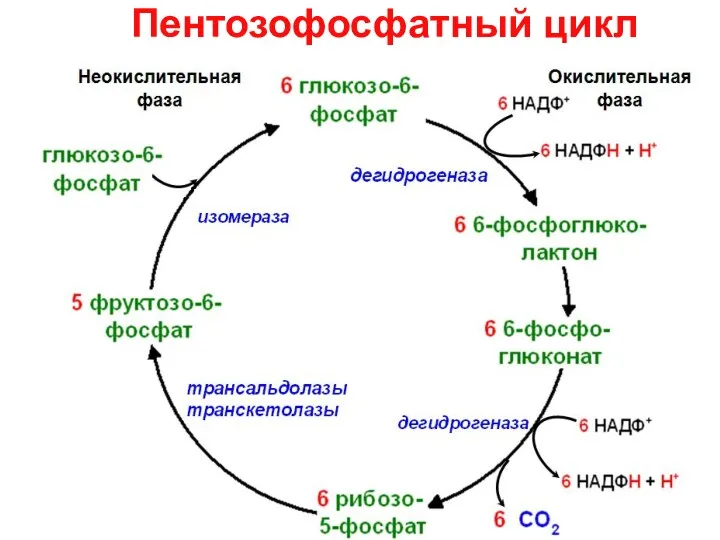
- 5. Пентозофосфатный цикл
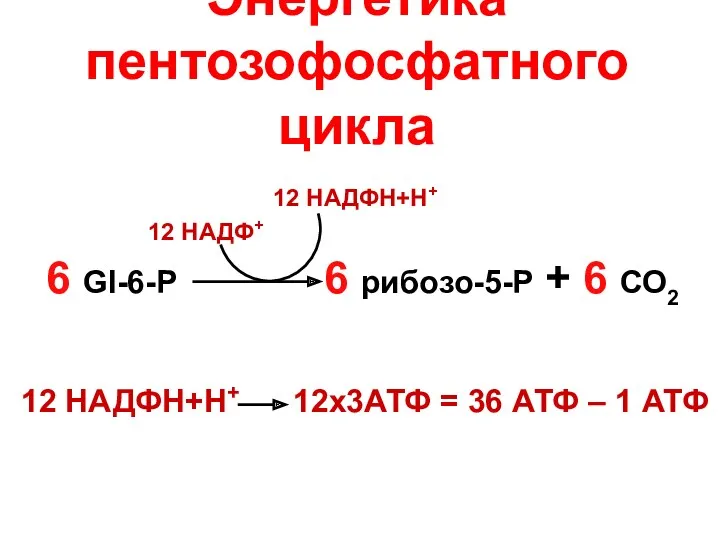
- 6. Энергетика пентозофосфатного цикла 6 Gl-6-P 6 рибозо-5-P + 6 СО2 12 НАДФ+ 12 НАДФН+Н+ 12 НАДФН+Н+
- 7. Регуляция пентозофосфатного пути Состояние депо энергии Состояние коферментов Гормональная регуляция: инсулин – активатор НАДФ+ активатор НАДФН+Н+
- 8. Биологическая роль пентозофосфатного пути Единственный способ получения пентоз (для синтеза нуклеотидов); Путь получения восстановленного НАДФН+Н+ для:
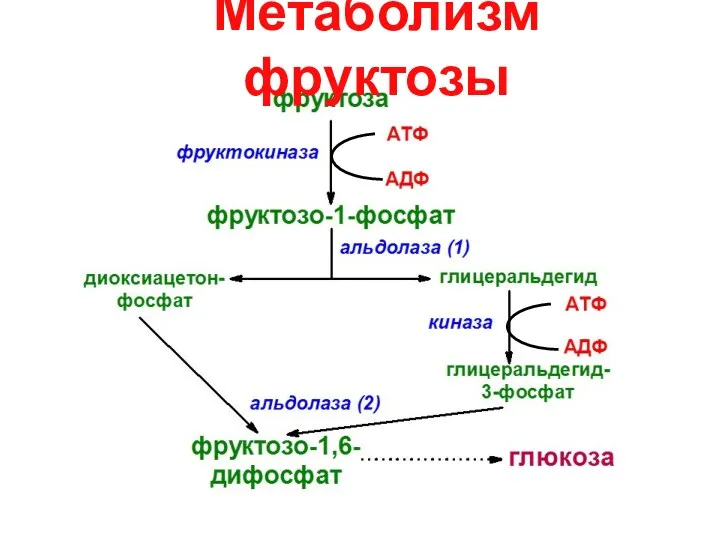
- 9. Метаболизм фруктозы
- 10. Нарушение обмена фруктозы 1. эссенциальная фруктозурия – недостаточность фруктокиназы 2. наследственная непереносимость фруктозы – недостаточность фруктозо-1-фосфатальдолазы
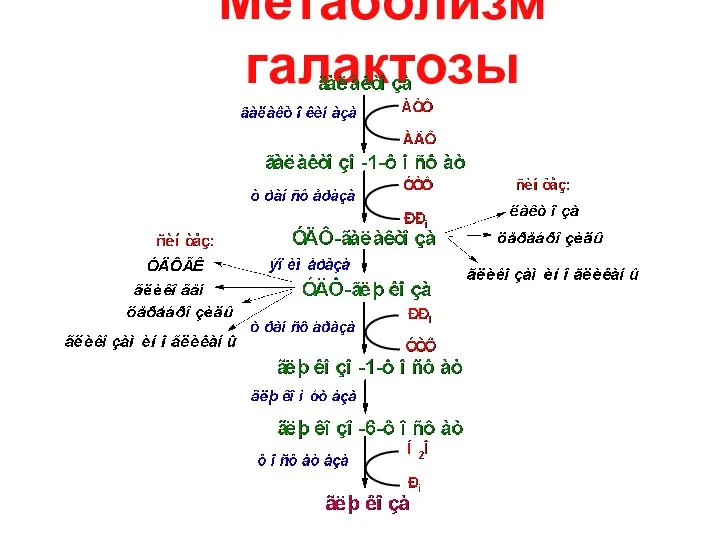
- 11. Метаболизм галактозы
- 12. Нарушение обмена галактозы галактоземия – недостаточность ферментов метаболизма галактозы: галактокиназа галактозо-1-фосфатуридилтрансфераза уридилфосфат-4-эпимераза
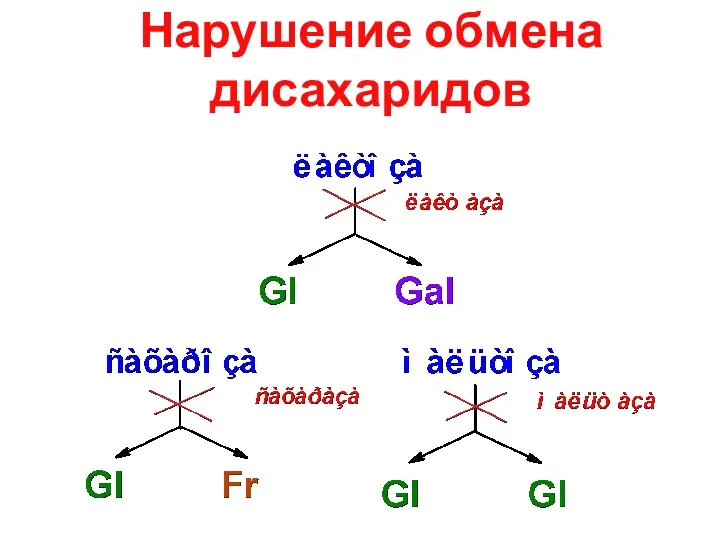
- 13. Нарушение обмена дисахаридов
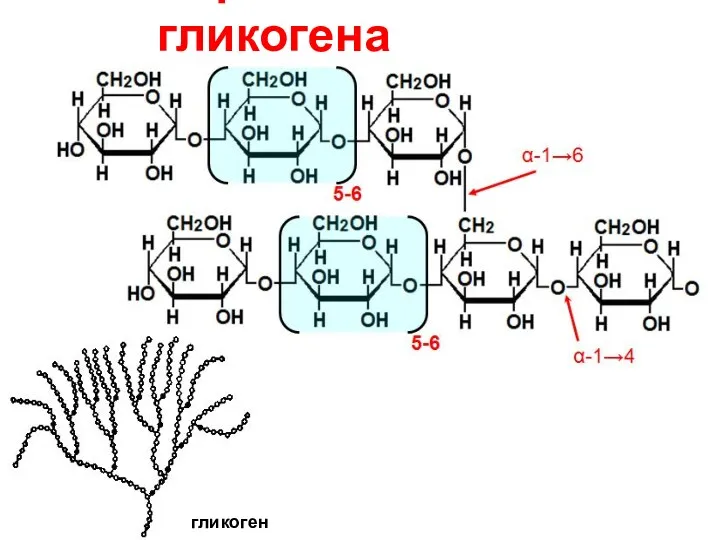
- 14. Строение гликогена гликоген
- 15. Биологическая роль гликогена Гликоген – резервный гомополисахарид, состоящий из остатков α-D-глюкозы гликоген мышц – резерв энергии
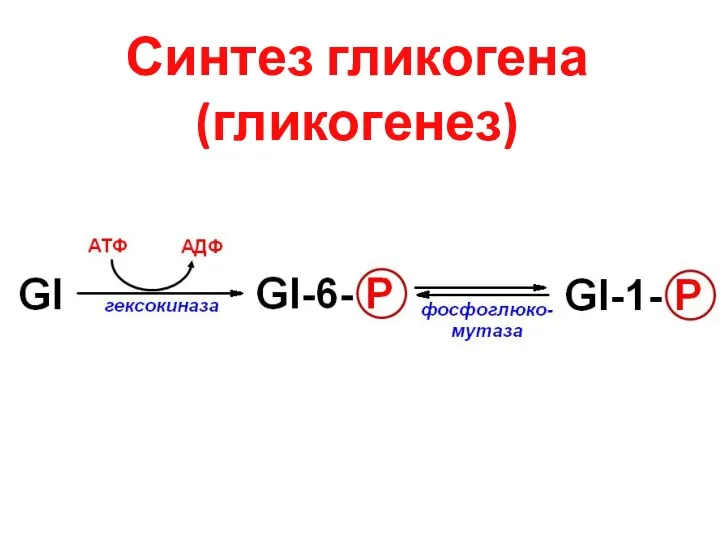
- 16. Синтез гликогена (гликогенез)
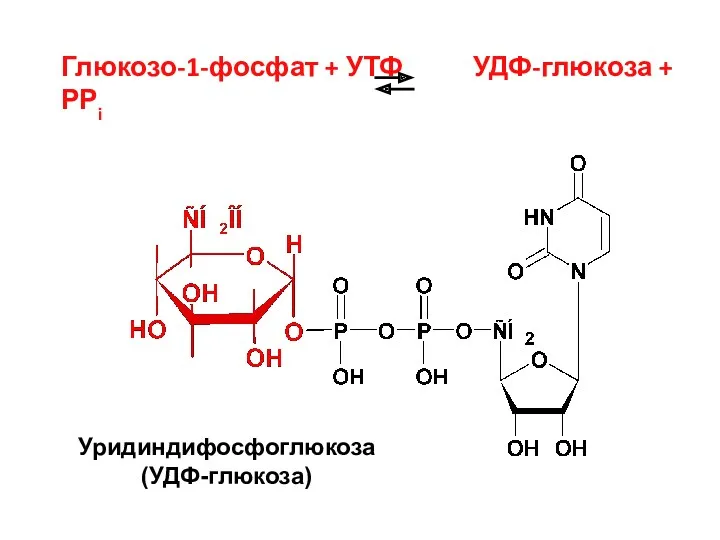
- 17. Глюкозо-1-фосфат + УТФ УДФ-глюкоза + РРi Уридиндифосфоглюкоза (УДФ-глюкоза)
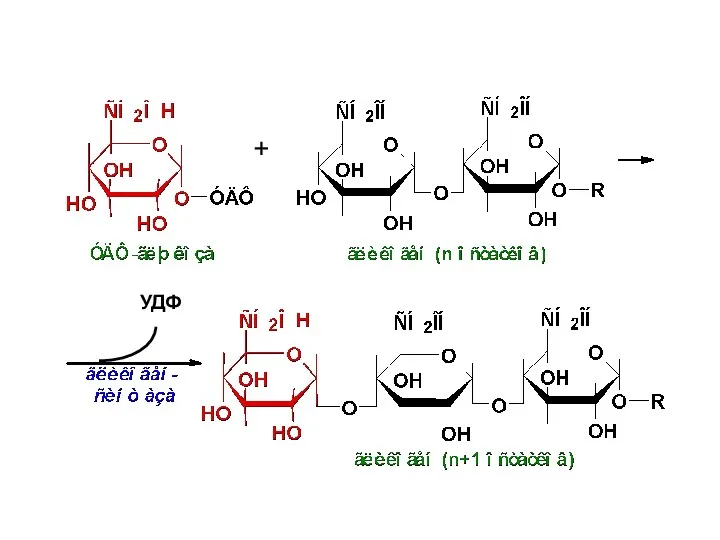
- 18. УДФ +
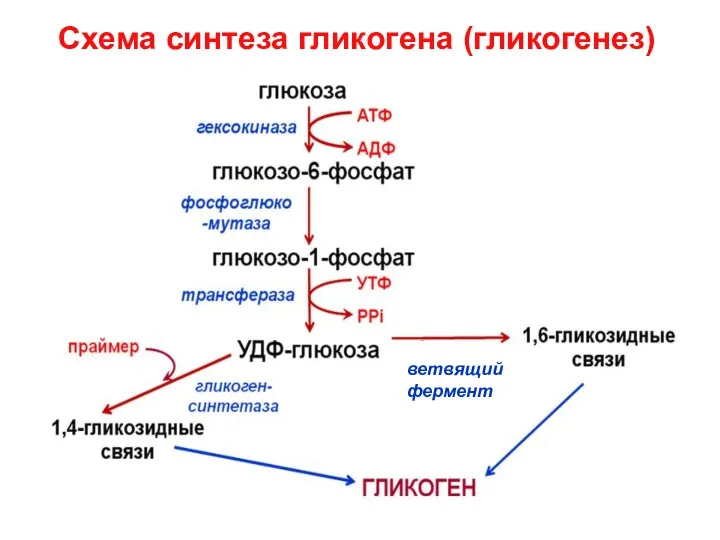
- 19. Схема синтеза гликогена (гликогенез) ветвящий фермент
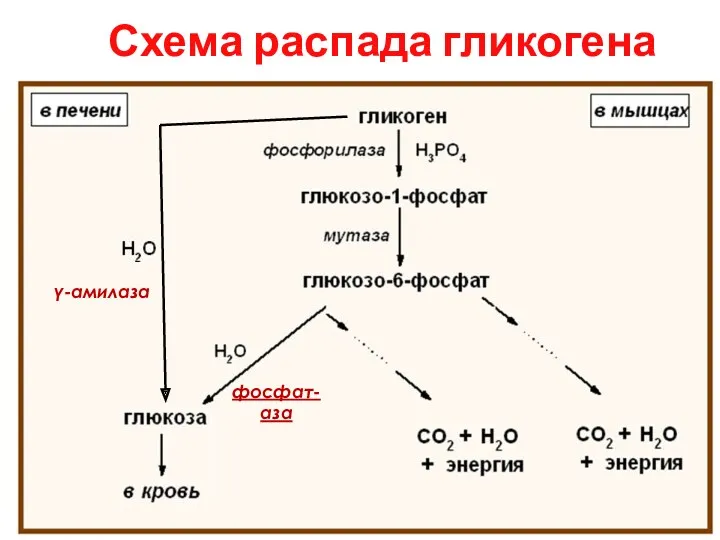
- 20. Схема распада гликогена фосфат-аза γ-амилаза
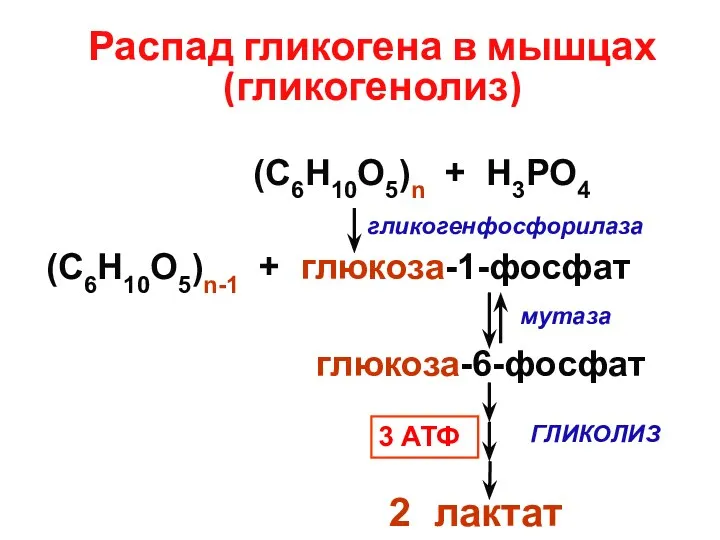
- 21. Распад гликогена в мышцах (гликогенолиз) (С6Н10О5)n + Н3РО4 (С6Н10О5)n-1 + глюкоза-1-фосфат глюкоза-6-фосфат 2 лактат гликогенфосфорилаза мутаза
- 22. Регуляция метаболизма гликогена Глюкагон и адреналин стимулируют распад гликогена активируют фосфорилазу ингибируют синтетазу Инсулин стимулирует синтез
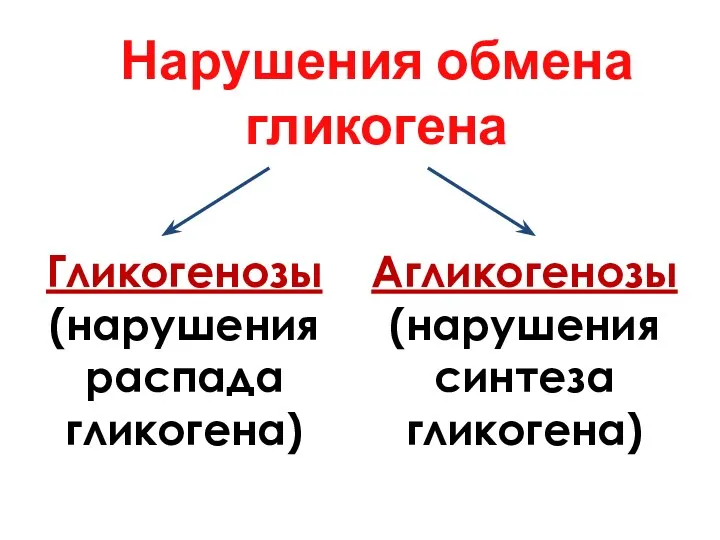
- 23. Нарушения обмена гликогена Гликогенозы (нарушения распада гликогена) Агликогенозы (нарушения синтеза гликогена)
- 24. Нарушения обмена гликогена
- 25. Регуляция углеводного обмена Инсулин снижает уровень глюкозы в крови: увеличивает проницаемость мембран клеток для глюкозы, активирует
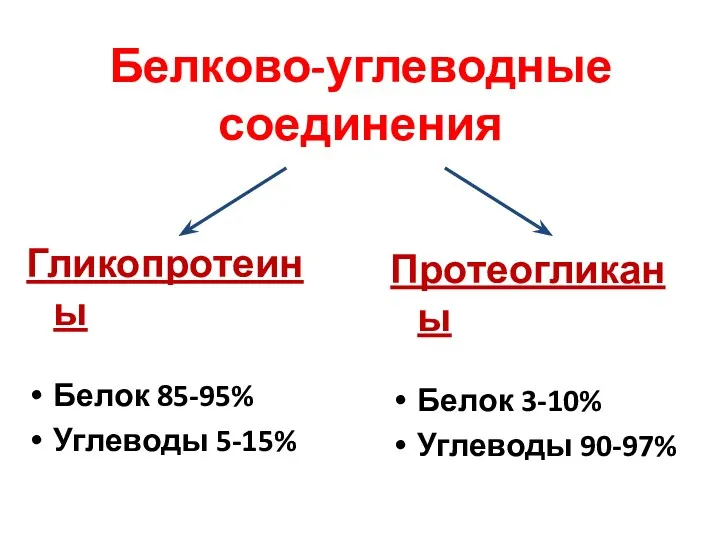
- 26. Белково-углеводные соединения Гликопротеины Белок 85-95% Углеводы 5-15% Протеогликаны Белок 3-10% Углеводы 90-97%
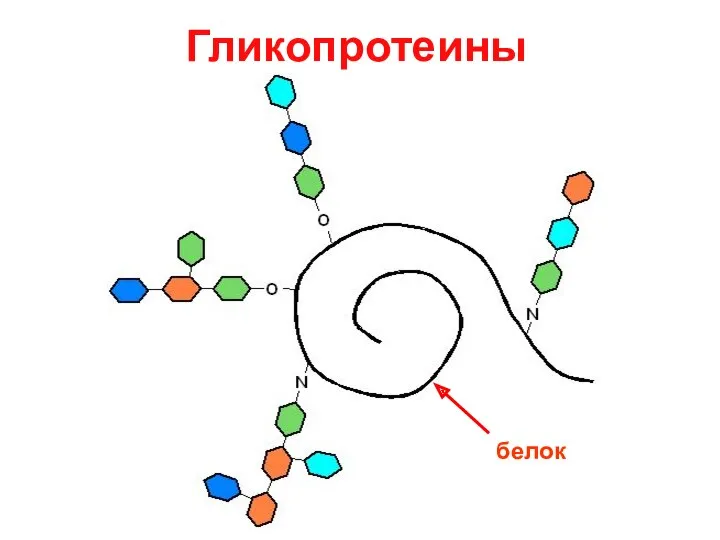
- 27. Гликопротеины белок
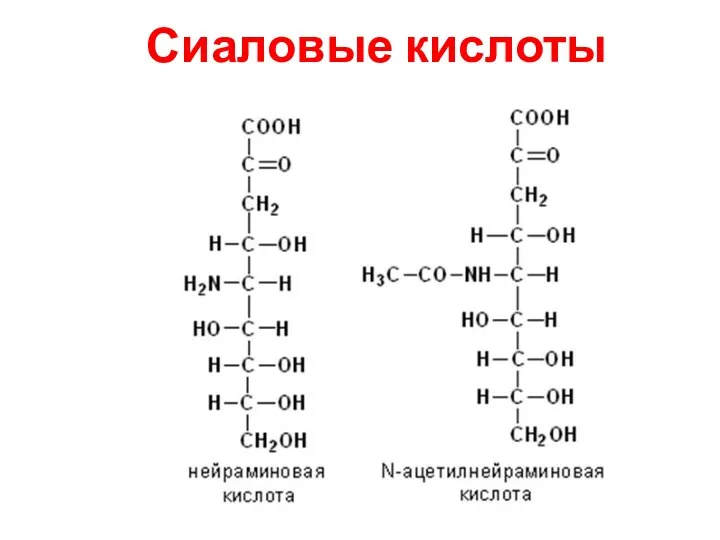
- 28. Сиаловые кислоты
- 29. Биологические функции гликопротеинов Структурная (коллаген, мембранные белки) Защитная (иммуноглобулины, факторы свёртывания крови, муцин) Регуляторная (тиреотропин, гонадотропины)
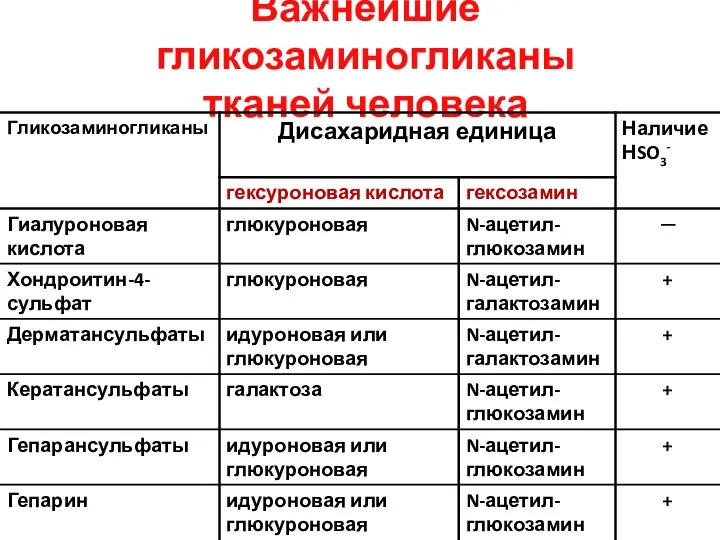
- 30. Важнейшие гликозаминогликаны тканей человека
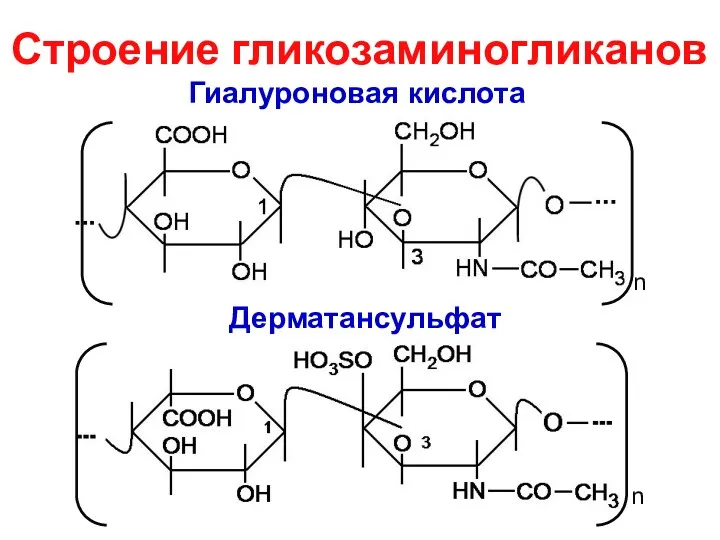
- 31. Строение гликозаминогликанов Гиалуроновая кислота Дерматансульфат n n
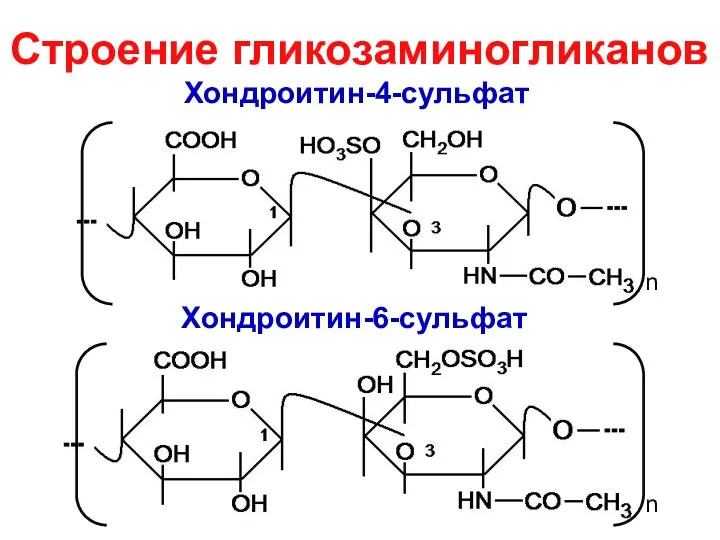
- 32. Хондроитин-4-сульфат n n Хондроитин-6-сульфат Строение гликозаминогликанов
- 33. Строение протеогликана Гиалуроновая кислота Коровый белок
- 34. Биологические функции гликозаминогликанов и протеогликанов являются структурными компонентами межклеточного матрикса; связывают воду, большие количества катионов (Na+,
- 35. Лекция по теме: Обмен белков – 1 Краснодар 2016 КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И
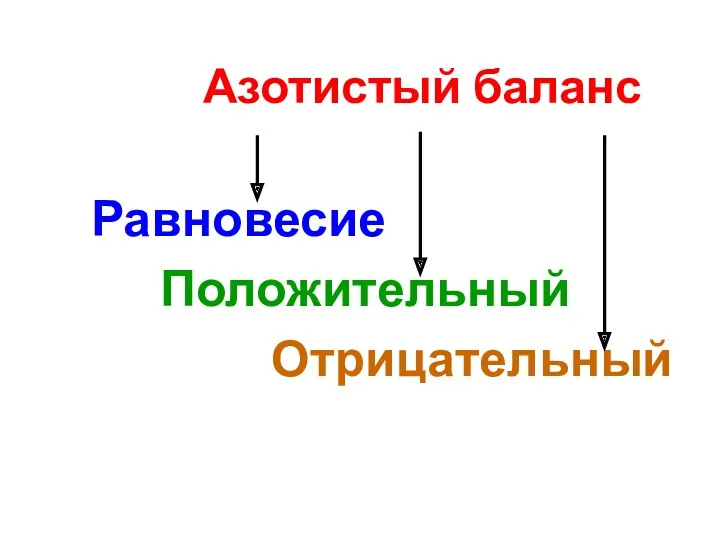
- 36. Азотистый баланс Равновесие Положительный Отрицательный
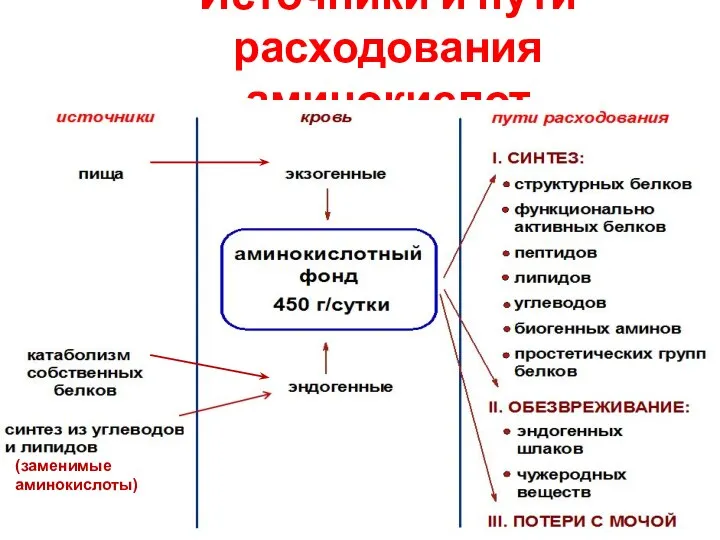
- 37. Источники и пути расходования аминокислот (заменимые аминокислоты)
- 38. Катепсины – лизосомальные протеолитические ферменты (протеиназы), обеспечивающие распад тканевых (собственных) белков, рН оптимум их лежит в
- 39. Потребность в пищевых белках 23,2 г/сут – коэффициент Рубнера – «коэффициент изнашивания» (азотистый баланс отрицательный). 30-45
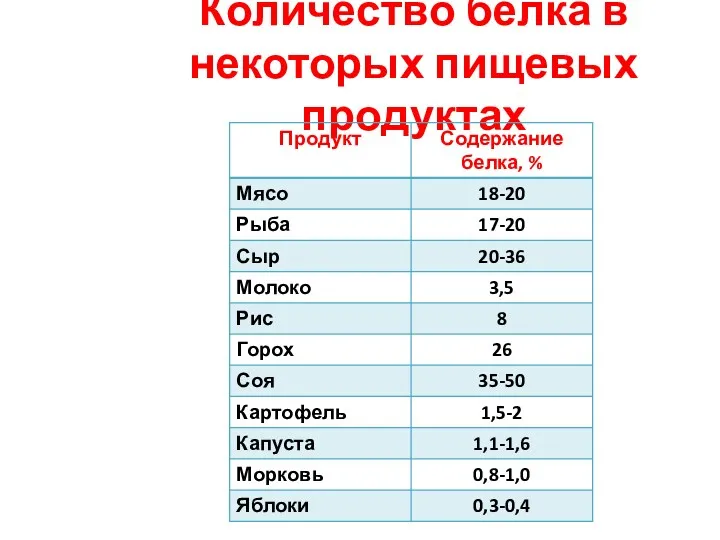
- 40. Количество белка в некоторых пищевых продуктах
- 41. Заменимые и незаменимые аминокислоты * - частично заменимые аминокислоты
- 42. Критерии полноценности пищевого белка Белок должен содержать все заменимые аминокислоты в соотношениях, близких к их соотношениям
- 43. Ферменты, переваривающие белки (гидролизующие пептидные связи), называются протеиназы (пептидазы, протеазы, протеолитические ферменты)
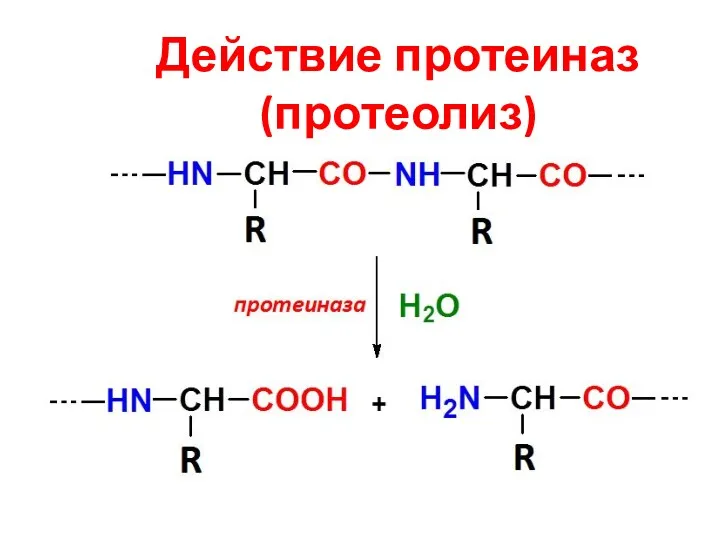
- 44. Действие протеиназ (протеолиз)
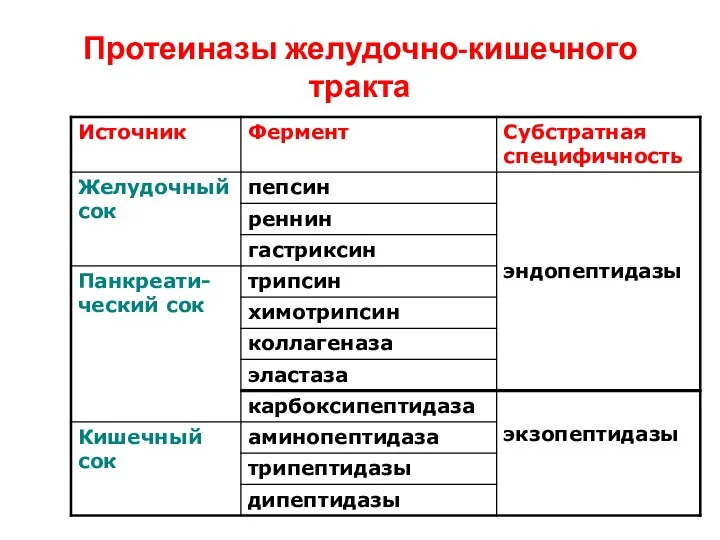
- 45. Протеиназы ЖКТ Эндопептидазы Пепсин; Реннин; Гастриксин; Трипсин; Химотрипсин; Эластаза. Экзопептидазы Карбоксипептидазы А и В; Аминопептидазы; Дипептидазы;
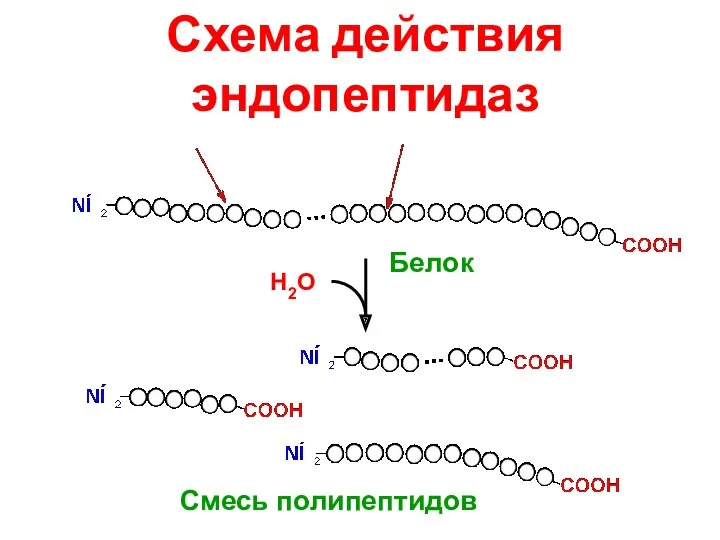
- 46. Схема действия эндопептидаз Н2О Смесь полипептидов Белок
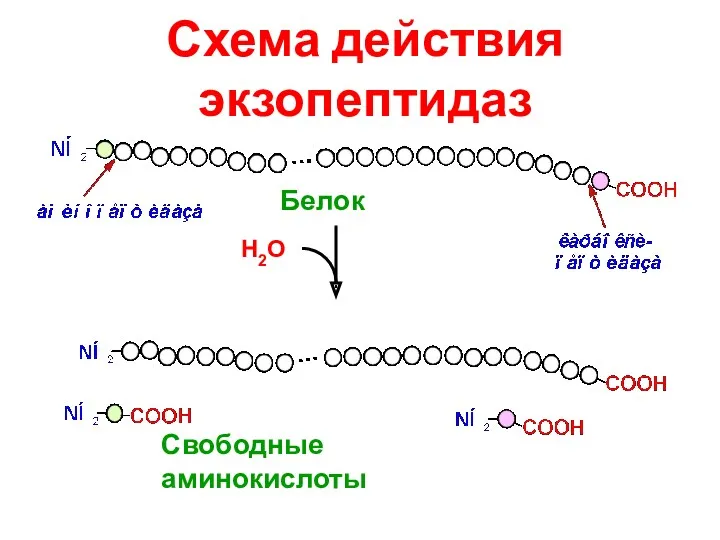
- 47. Схема действия экзопептидаз Н2О Свободные аминокислоты Белок
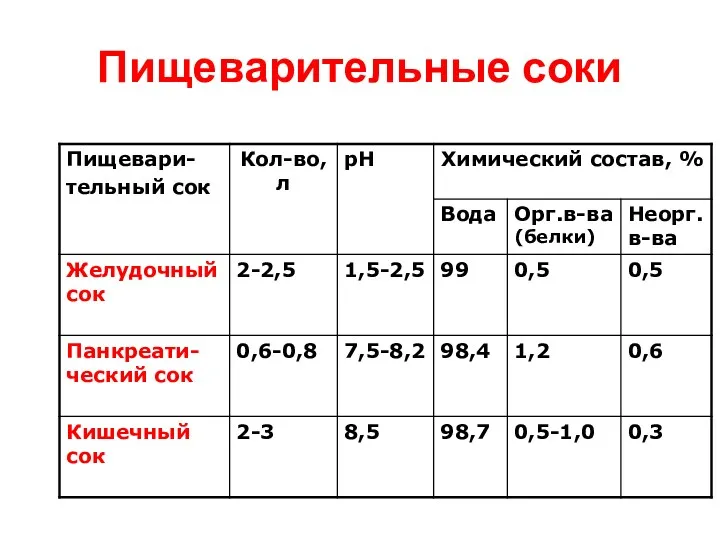
- 48. Пищеварительные соки
- 49. Протеиназы желудочно-кишечного тракта
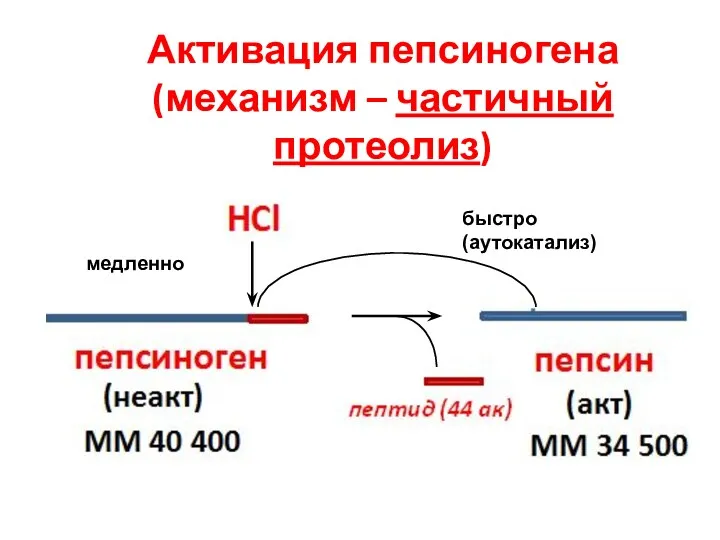
- 50. Активация пепсиногена (механизм – частичный протеолиз) медленно быстро (аутокатализ)
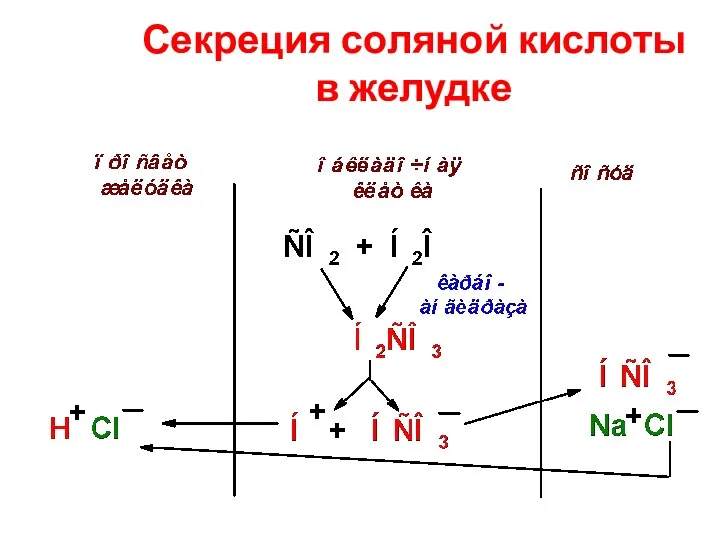
- 51. Секреция соляной кислоты в желудке
- 52. Функции соляной кислоты активация пепсиногена создание рН-оптимума для пепсина (1,5-2,5) бактерицидное действие денатурирует белки регулирует работу
- 53. Виды кислотности желудочного сока Общая кислотность (НСl + прочие кислые вещества – кислые соли, органические кислоты)
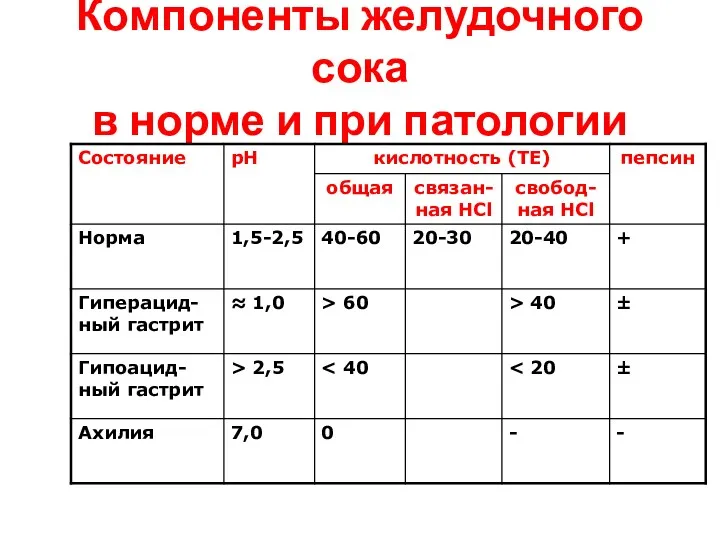
- 54. Компоненты желудочного сока в норме и при патологии
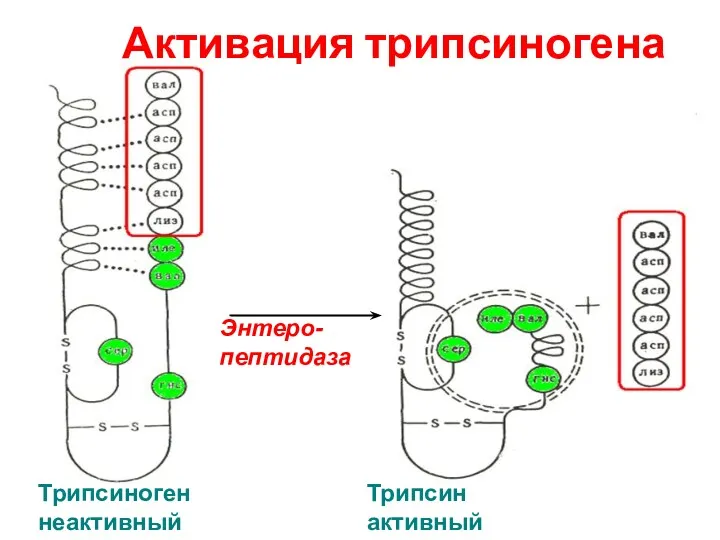
- 55. Активация трипсиногена Энтеро-пептидаза Трипсиноген неактивный Трипсин активный
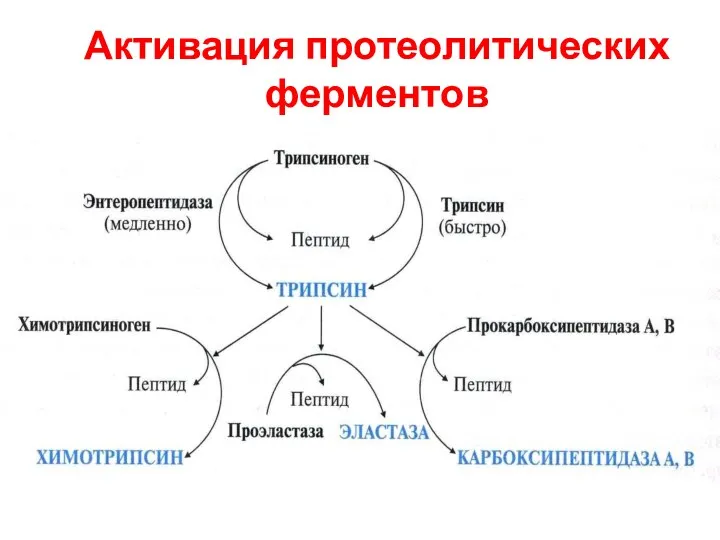
- 56. Активация протеолитических ферментов
- 57. Биологический смысл синтеза проферментов – защита тканей пищеварительных желёз от самопереваривания (аутолиза)
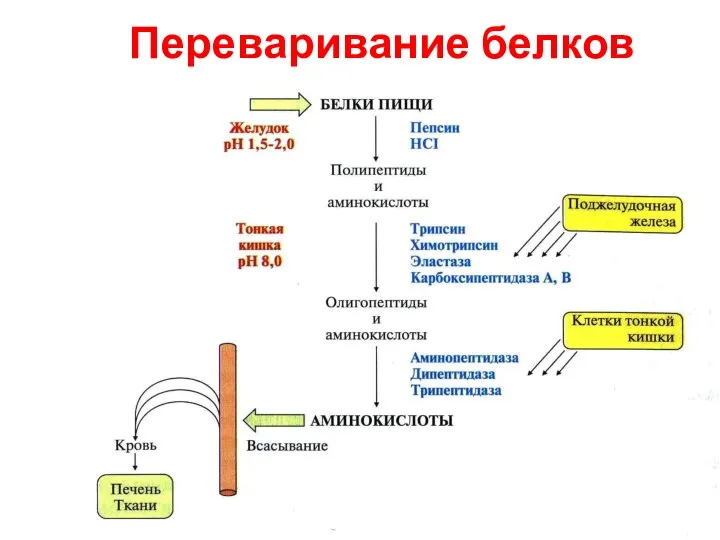
- 58. Переваривание белков
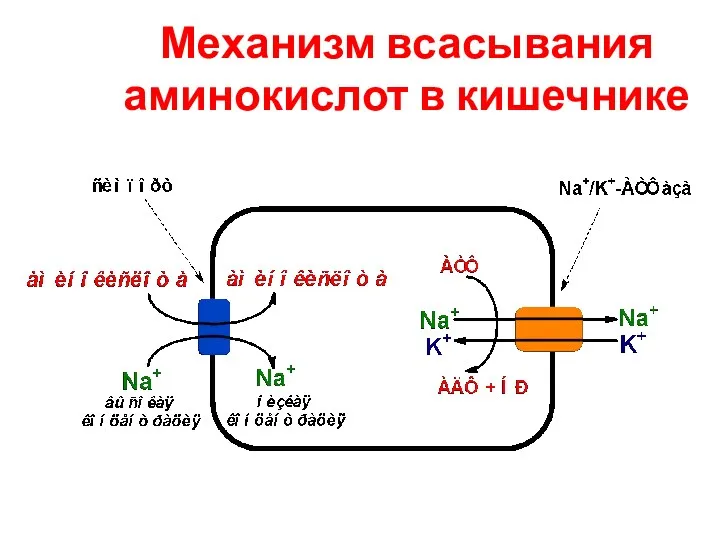
- 60. Механизм всасывания аминокислот в кишечнике
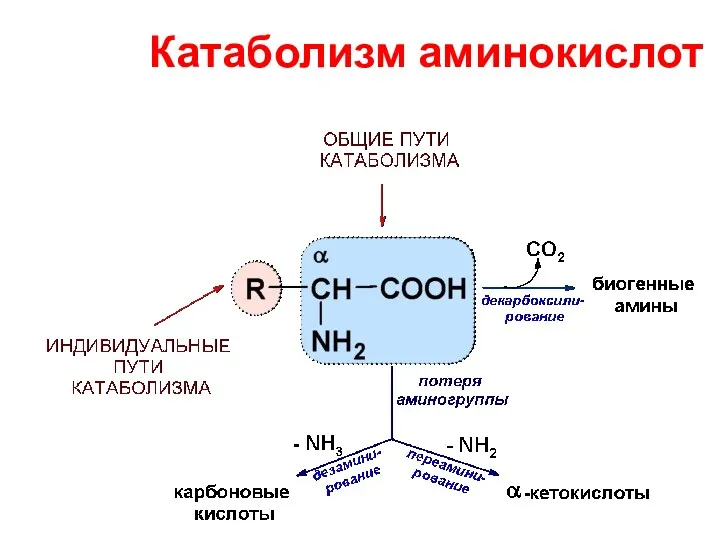
- 61. Катаболизм аминокислот
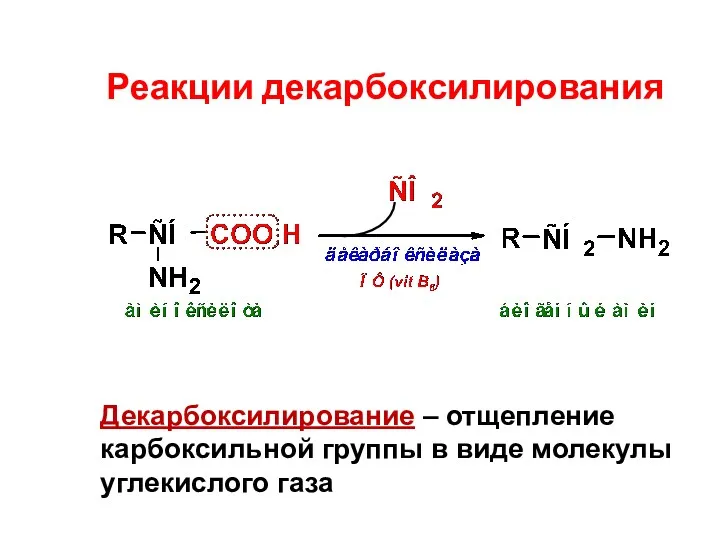
- 62. Реакции декарбоксилирования Декарбоксилирование – отщепление карбоксильной группы в виде молекулы углекислого газа
- 63. Биологическая роль реакций декарбоксилирования – образование биогенных аминов, которые могут быть: Гормонами Нейромедиаторами Входить в состав
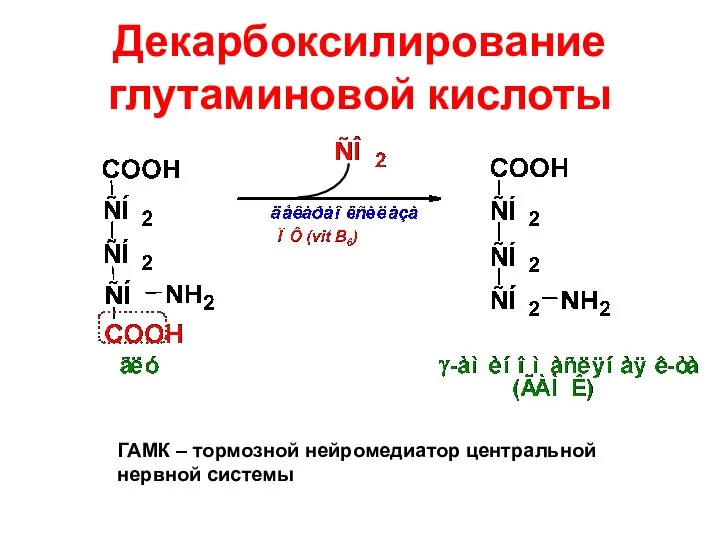
- 64. Декарбоксилирование глутаминовой кислоты ГАМК – тормозной нейромедиатор центральной нервной системы
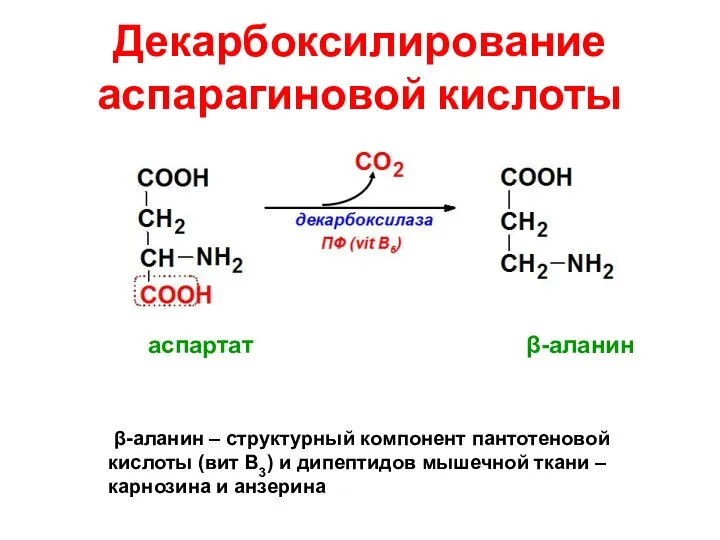
- 65. Декарбоксилирование аспарагиновой кислоты β-аланин – структурный компонент пантотеновой кислоты (вит В3) и дипептидов мышечной ткани –
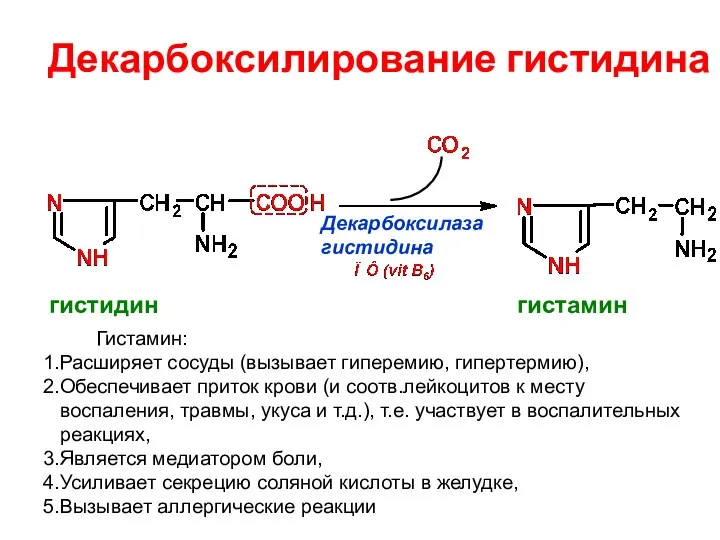
- 66. Декарбоксилирование гистидина Декарбоксилаза гистидина гистидин гистамин Гистамин: Расширяет сосуды (вызывает гиперемию, гипертермию), Обеспечивает приток крови (и
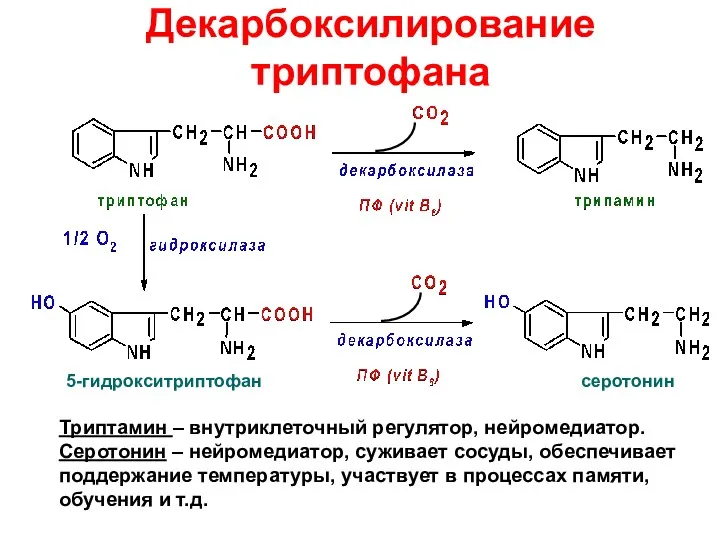
- 67. Декарбоксилирование триптофана 5-гидрокситриптофан серотонин Триптамин – внутриклеточный регулятор, нейромедиатор. Серотонин – нейромедиатор, суживает сосуды, обеспечивает поддержание
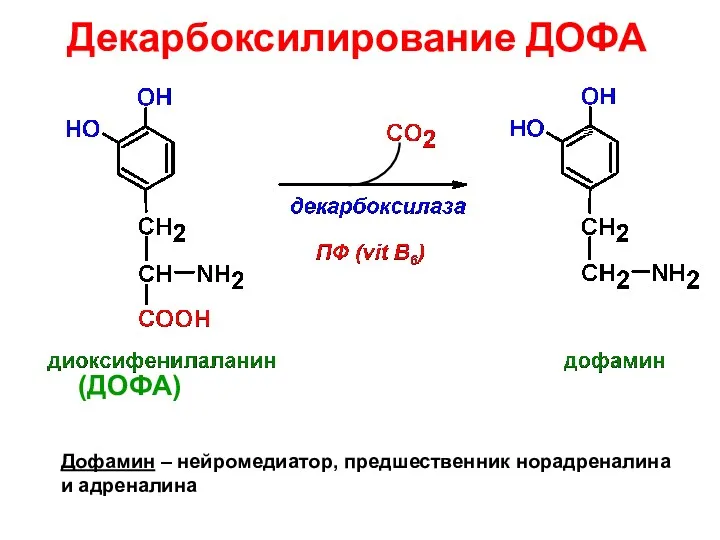
- 68. Декарбоксилирование ДОФА Дофамин – нейромедиатор, предшественник норадреналина и адреналина (ДОФА)
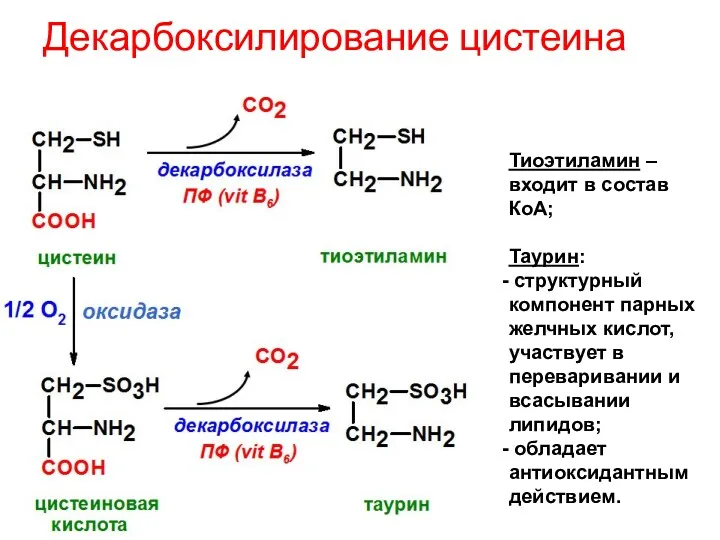
- 69. Декарбоксилирование цистеина Тиоэтиламин – входит в состав КоА; Таурин: структурный компонент парных желчных кислот, участвует в
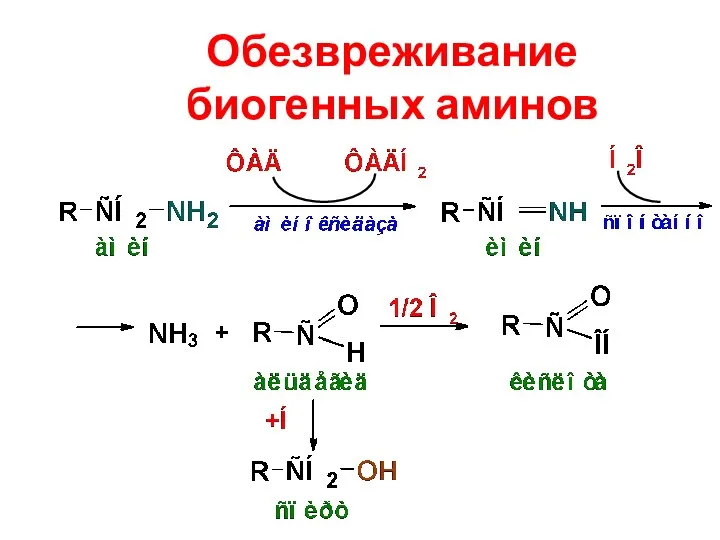
- 70. Обезвреживание биогенных аминов
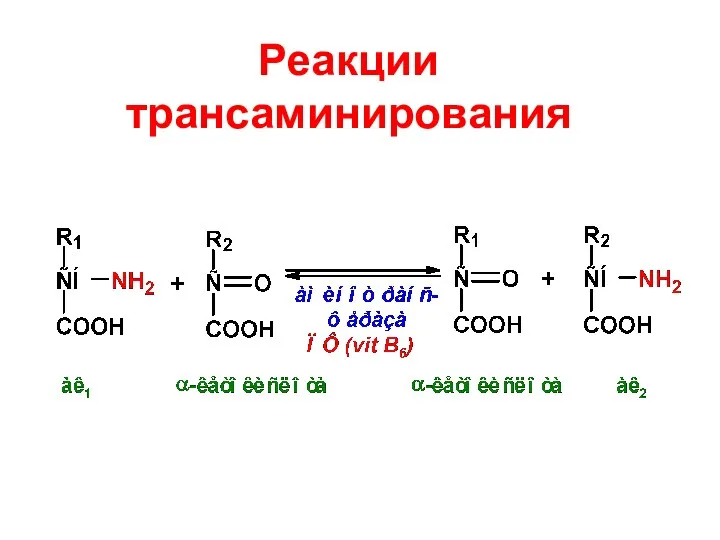
- 71. Реакции трансаминирования
- 72. Вещества, участвующие в трансаминировании: Аминокислоты – практически все, кроме треонина, лизина и пролина, но особенно активны
- 73. Роль пиридоксальфосфата в трансаминировании – является промежуточным переносчиком аминогруппы (первичным акцептором)
- 74. Биологическая роль трансаминирования Путь синтеза заменимых аминокислот Путь перераспределения азота без образования токсичного аммиака Путь пополнения
- 75. Реакции трансаминирования
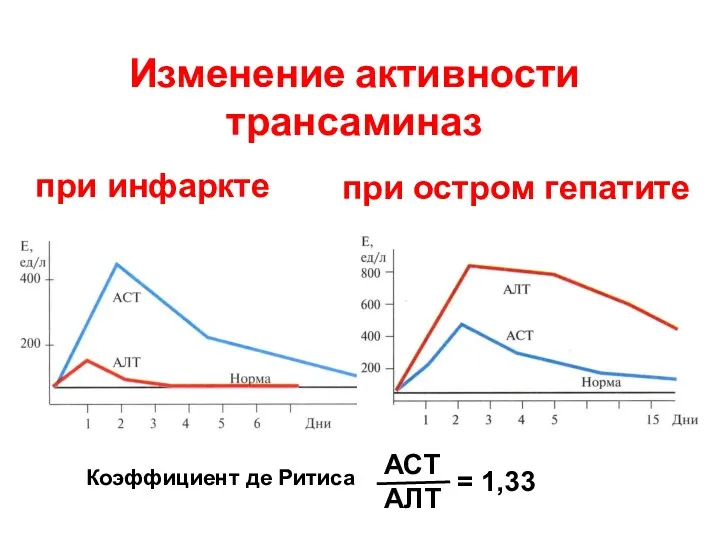
- 76. Изменение активности трансаминаз при инфаркте при остром гепатите Коэффициент де Ритиса АСТ АЛТ = 1,33
- 77. Типы реакций дезаминирования Восстановительное Гидролитическое Внутримолекулярное Окислительное Дезаминирование – отщепление аминогруппы в виде молекулы аммиака
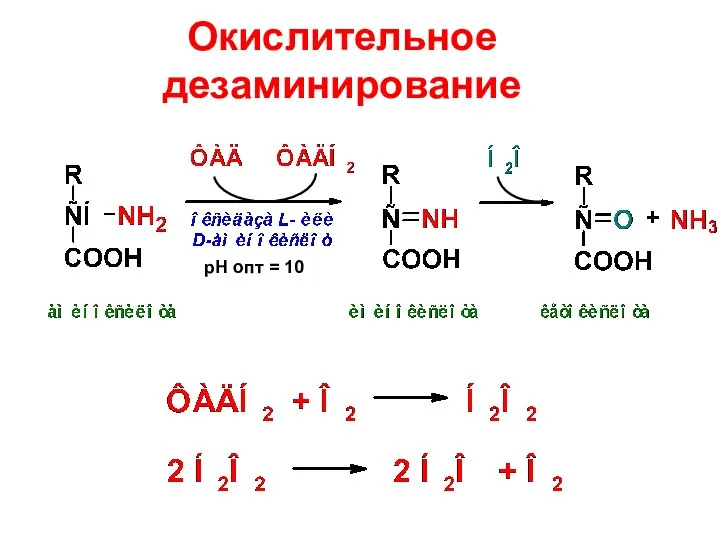
- 78. Окислительное дезаминирование рН опт = 10
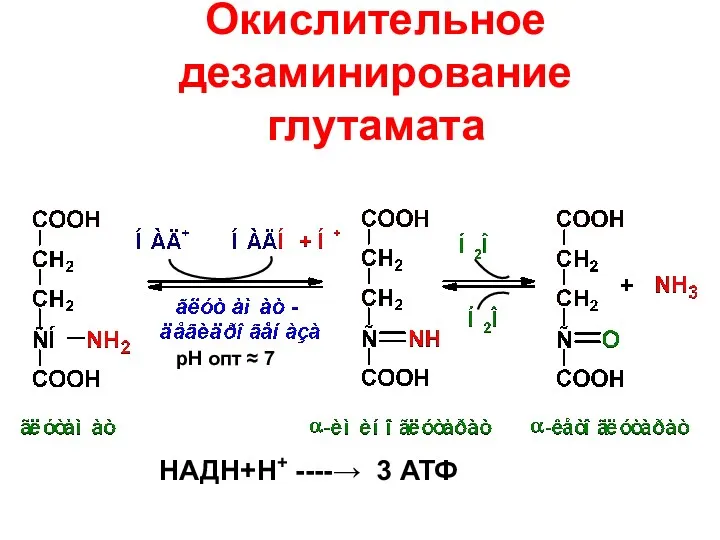
- 79. Окислительное дезаминирование глутамата НАДН+Н+ ----→ 3 АТФ рН опт ≈ 7
- 80. Отличия и роль процесса дезаминирования глутамата Глутаматдегидрогеназа активна при физиологических значениях рН; Глутаматдегидрогеназа обладает обратимостью действия
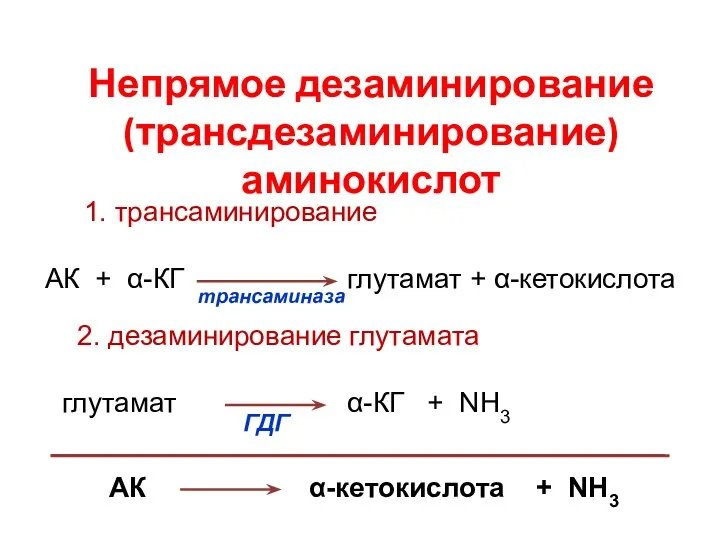
- 81. Непрямое дезаминирование (трансдезаминирование) аминокислот АК α-кетокислота + NH3 1. трансаминирование АК + α-КГ глутамат + α-кетокислота
- 83. Скачать презентацию






























 Растениеводство. Системы земледелия
Растениеводство. Системы земледелия Эндокринная система
Эндокринная система Положение человека в системе животного мира. Стадии антропогенеза
Положение человека в системе животного мира. Стадии антропогенеза Отряд Журавлеобразные
Отряд Журавлеобразные Выделение ДНК
Выделение ДНК Ядовитые растения Крыма
Ядовитые растения Крыма Физиология высшей нервной деятельности. Этология и стадность
Физиология высшей нервной деятельности. Этология и стадность Слуховой анализатор. Гигиена слуха. 8 класс
Слуховой анализатор. Гигиена слуха. 8 класс Типи взаємовідносин між організмами
Типи взаємовідносин між організмами Конечные продукты азотистого обмена. Биосинтез мочевины
Конечные продукты азотистого обмена. Биосинтез мочевины Статеві гормони. Гормони наднирників. Гормони щитовидної залози, гормони нейрогипофиза
Статеві гормони. Гормони наднирників. Гормони щитовидної залози, гормони нейрогипофиза 20181126_razvitie_nasekomyh
20181126_razvitie_nasekomyh Последствия близкородственных браков
Последствия близкородственных браков Келесі өзгерістерді катализдейтін ферменттер қай класс мен подкласка жатады а) Лактат + НАД+ ↔ пируват + НАДН +Н+
Келесі өзгерістерді катализдейтін ферменттер қай класс мен подкласка жатады а) Лактат + НАД+ ↔ пируват + НАДН +Н+ Общее учение о внутренностях
Общее учение о внутренностях Биохимия соединительной ткани
Биохимия соединительной ткани Железы. Гистофизиология секреторного процесса. Типы секреции
Железы. Гистофизиология секреторного процесса. Типы секреции Кровеносная система
Кровеносная система Тип Плоские черви (Plathelminthes)
Тип Плоские черви (Plathelminthes) Витамины. 9 класс
Витамины. 9 класс Карты генов наследственных заболеваний
Карты генов наследственных заболеваний Нуклеиновые кислоты
Нуклеиновые кислоты Показатели загрязненности почв и экологического неблагополучия агроэкосистемы
Показатели загрязненности почв и экологического неблагополучия агроэкосистемы Эволюционное учение (урок обобщающего повторения для 10 класса)
Эволюционное учение (урок обобщающего повторения для 10 класса) Самые необычные кошки планеты
Самые необычные кошки планеты Мышцы. Типы мышц, их строение и значение
Мышцы. Типы мышц, их строение и значение Зоопарк
Зоопарк Органи і системи органів тварин
Органи і системи органів тварин