Содержание
- 2. План лекции Биохимия – как наука. Предмет, цели и задачи биохимии. Метаболизм. Основные понятия. Виды метаболических
- 3. Биохимия – наука, изучающая вещества, входящие в состав живых организмов, их превращения, а также взаимосвязь этих
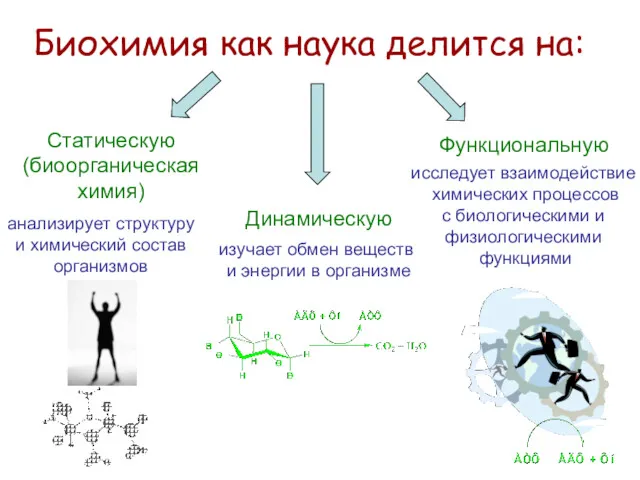
- 4. Биохимия как наука делится на: Статическую (биоорганическая химия) анализирует структуру и химический состав организмов Динамическую изучает
- 5. По объектам исследования, биохимия делится на: биохимию человека и животных; биохимию растений; биохимию микроорганизмов; биохимию грибов;
- 6. Объектом медицинской биохимии является человек Целью курса медицинской биохимии является изучение: молекулярных основ физиологических функций человека;
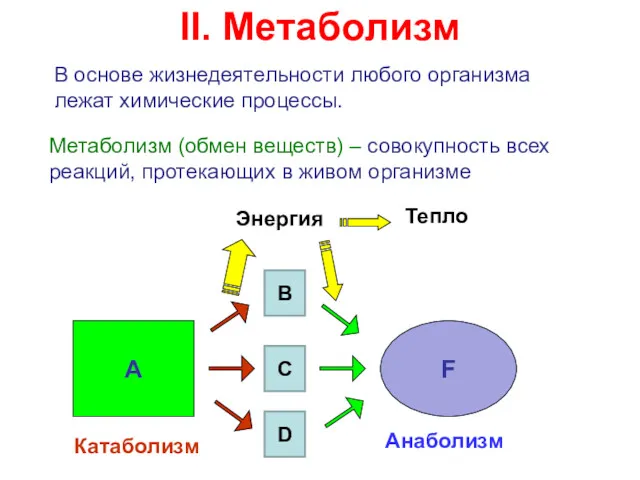
- 7. II. Метаболизм В основе жизнедеятельности любого организма лежат химические процессы. Метаболизм (обмен веществ) – совокупность всех
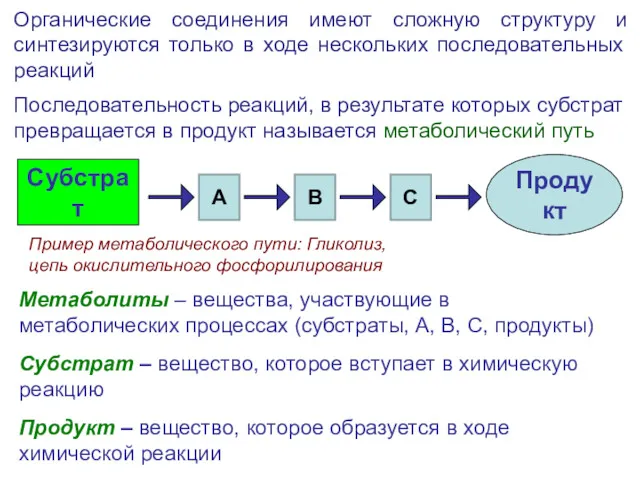
- 8. Метаболиты – вещества, участвующие в метаболических процессах (субстраты, А, В, С, продукты) Субстрат – вещество, которое
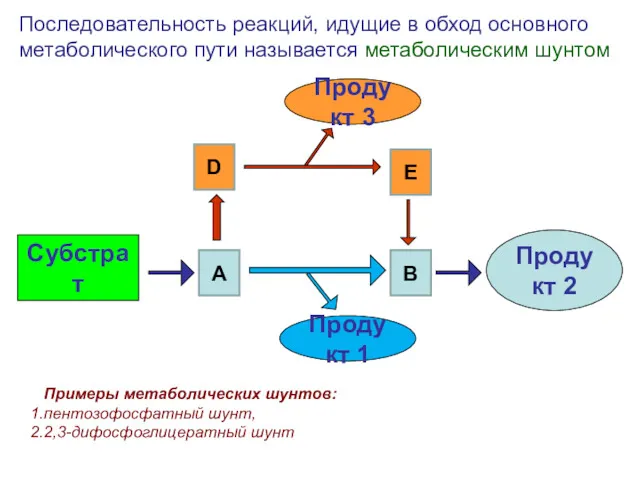
- 9. Субстрат Продукт 2 Последовательность реакций, идущие в обход основного метаболического пути называется метаболическим шунтом А В
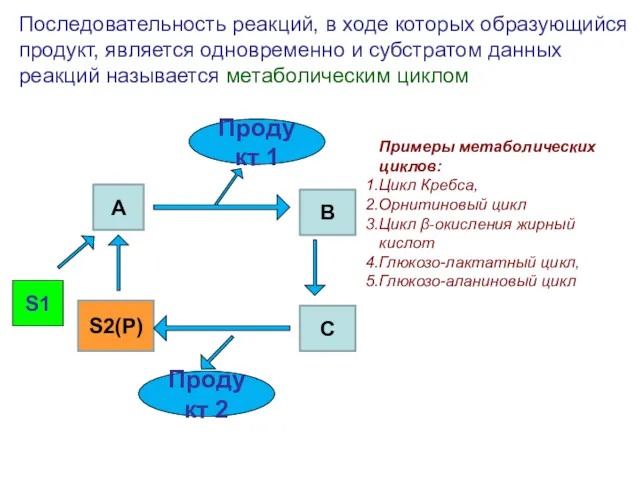
- 10. S1 Последовательность реакций, в ходе которых образующийся продукт, является одновременно и субстратом данных реакций называется метаболическим
- 11. Энзимология – наука, раздел биохимии, о ферментах III. Энзимология строение и свойства ферментов; ферментативные реакции и
- 12. Практически все реакции в живом организме протекают с участием ферментов Ферменты Ферменты (энзимы) – биологические катализаторы
- 13. Особенности действия ферментов Ускоряют только термодинамически возможные реакции Не изменяют состояние равновесия реакций, а только ускоряют
- 14. 1. Активный центр – это часть молекулы фермента, которая специфически взаимодействует с субстратом и принимает непосредственное
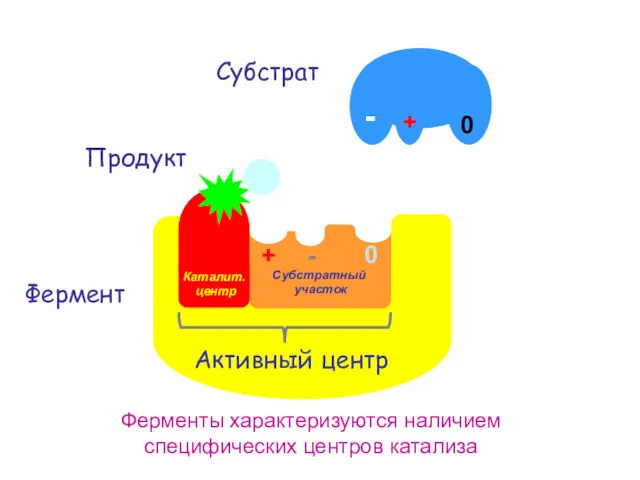
- 15. Фермент Субстрат Ферменты характеризуются наличием специфических центров катализа Продукт
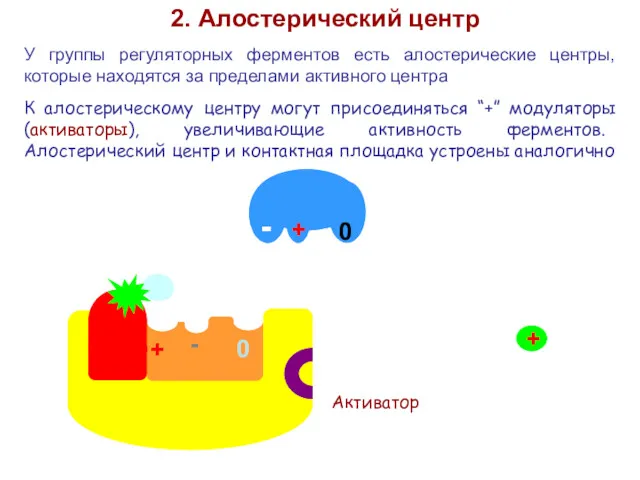
- 16. 2. Алостерический центр У группы регуляторных ферментов есть алостерические центры, которые находятся за пределами активного центра
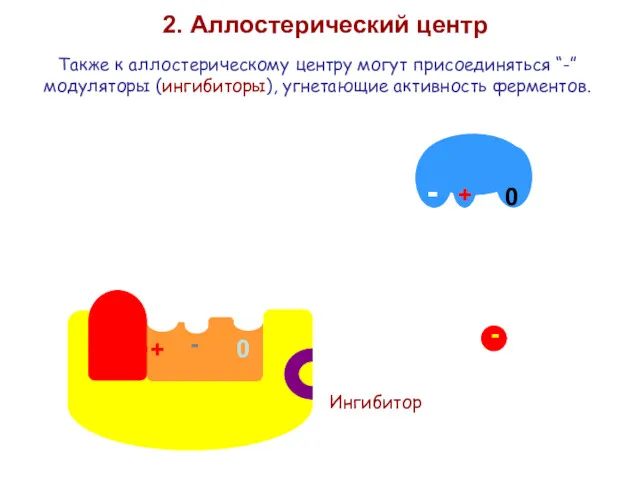
- 17. 2. Аллостерический центр Также к аллостерическому центру могут присоединяться “-” модуляторы (ингибиторы), угнетающие активность ферментов. -
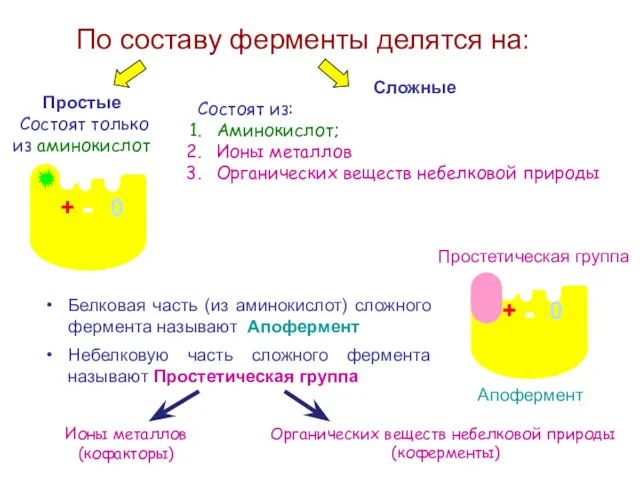
- 18. По составу ферменты делятся на: Простые Состоят только из аминокислот - Сложные Состоят из: Аминокислот; Ионы
- 19. Коферменты - органические вещества небелковой природы, которые участвуют в катализе в составе каталитического участка активного центра
- 20. В качестве коферментов функционируют: Гемы (коферменты цитохромов); Нуклеотиды (коферменты рибосом); коэнзим Q; ФАФС (коферменты трансфераз); SAM;
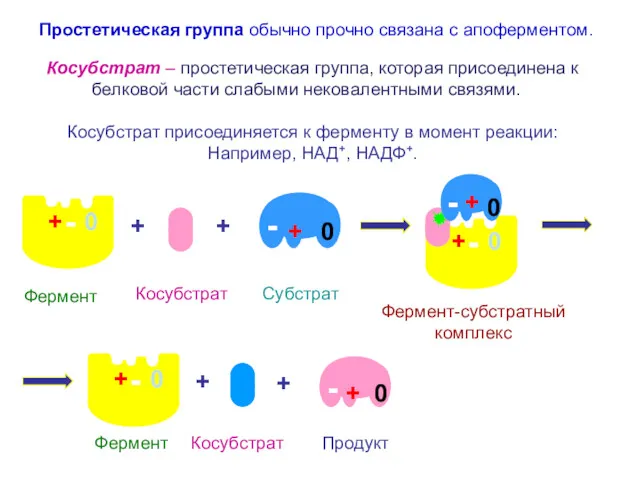
- 21. + + Косубстрат – простетическая группа, которая присоединена к белковой части слабыми нековалентными связями. Косубстрат присоединяется
- 22. Кофакторы В качестве кофакторов выступают ионы калия, магния, кальция, цинка, меди, железа и т.д. стабилизируют молекулы
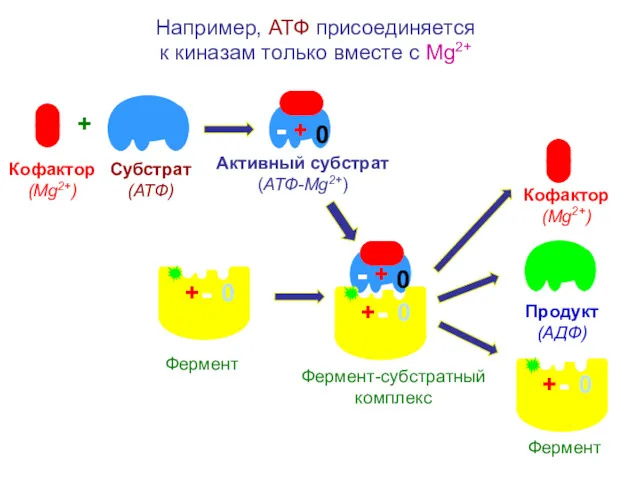
- 23. Например, АТФ присоединяется к киназам только вместе с Mg2+ + Субстрат (АТФ) Кофактор (Mg2+) Фермент Активный
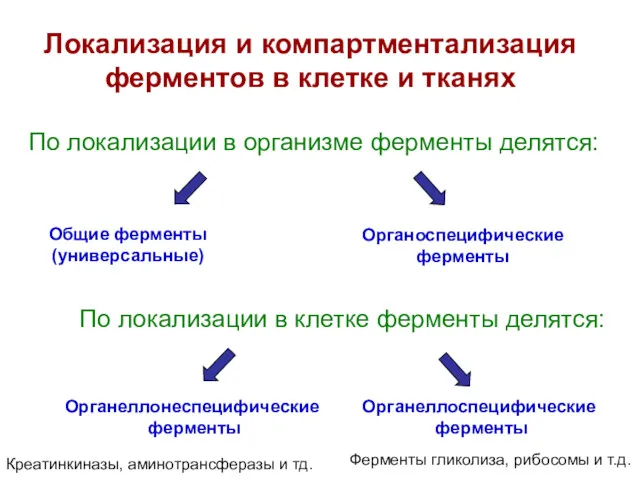
- 24. Локализация и компартментализация ферментов в клетке и тканях По локализации в организме ферменты делятся: Общие ферменты
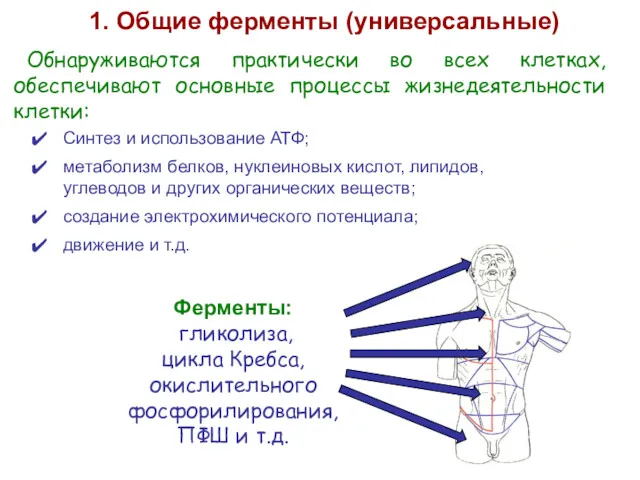
- 25. Обнаруживаются практически во всех клетках, обеспечивают основные процессы жизнедеятельности клетки: 1. Общие ферменты (универсальные) Ферменты: гликолиза,
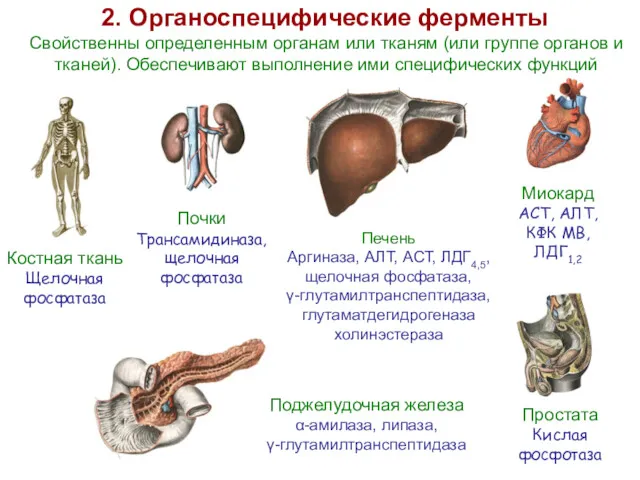
- 26. 2. Органоспецифические ферменты Костная ткань Щелочная фосфатаза Миокард АСТ, АЛТ, КФК МВ, ЛДГ1,2 Почки Трансамидиназа, щелочная
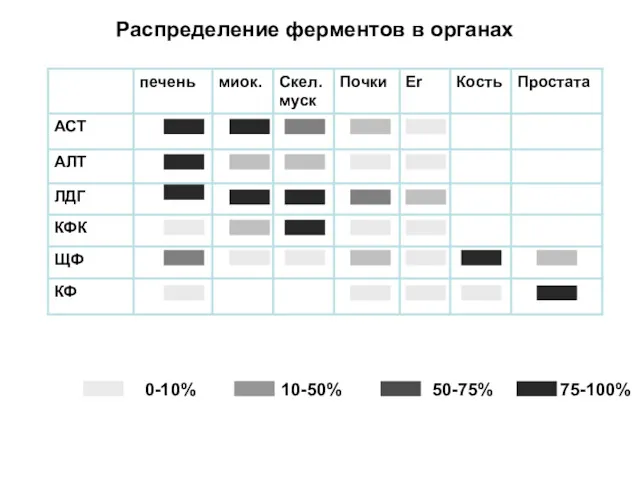
- 27. Распределение ферментов в органах 0-10% 10-50% 50-75% 75-100%
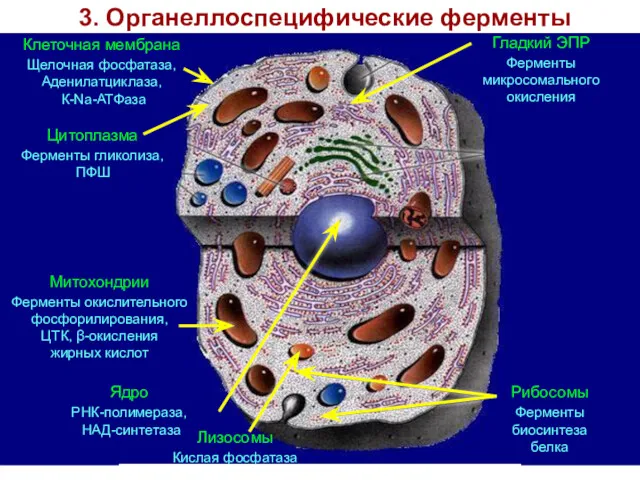
- 28. 3. Органеллоспецифические ферменты Клеточная мембрана Щелочная фосфатаза, Аденилатциклаза, К-Nа-АТФаза Цитоплазма Ферменты гликолиза, ПФШ Гладкий ЭПР Ферменты
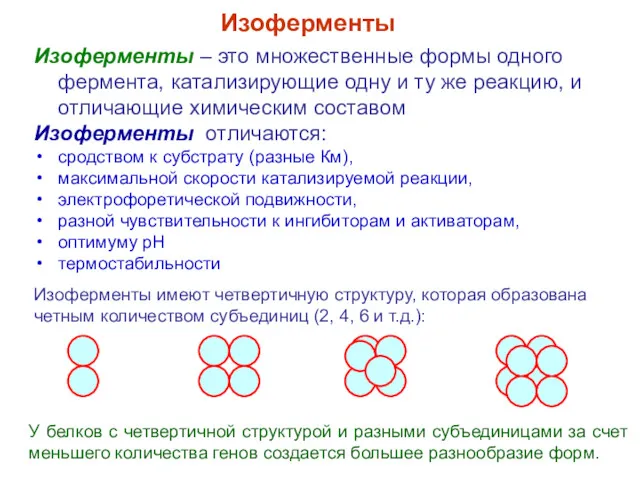
- 29. Изоферменты – это множественные формы одного фермента, катализирующие одну и ту же реакцию, и отличающие химическим
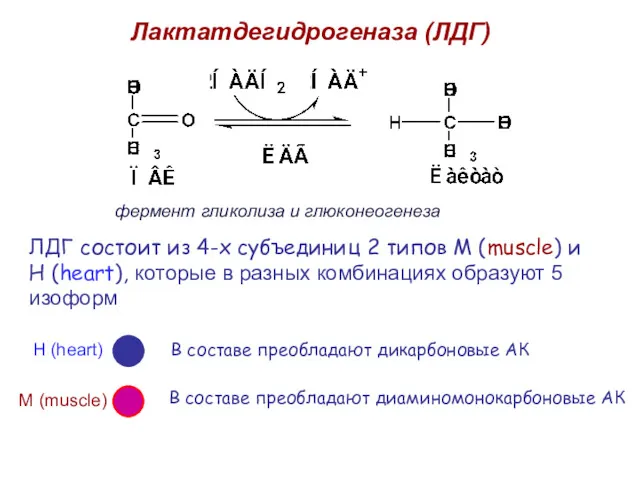
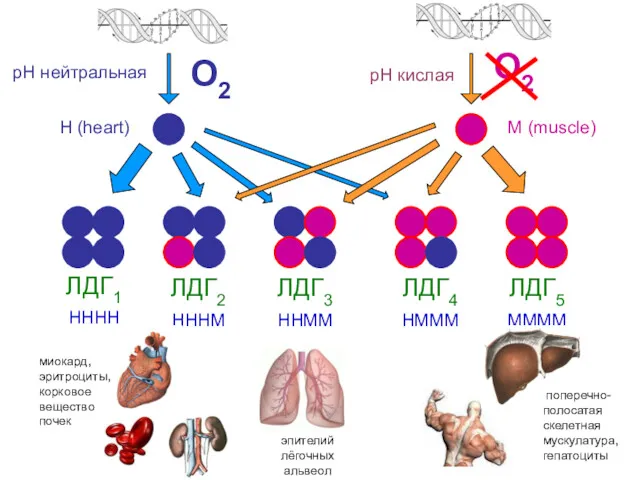
- 30. Лактатдегидрогеназа (ЛДГ) ЛДГ состоит из 4-х субъединиц 2 типов М (muscle) и Н (heart), которые в
- 31. ЛДГ1 НННН ЛДГ2 НННМ ЛДГ3 ННММ ЛДГ4 НМММ ЛДГ5 ММММ О2 О2 Н (heart) М (muscle)
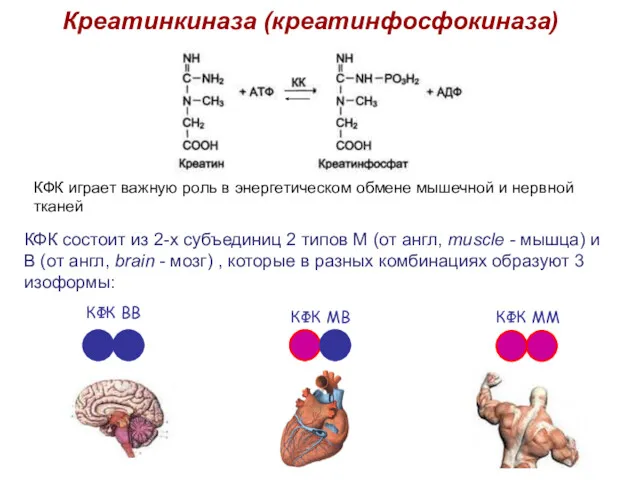
- 32. Креатинкиназа (креатинфосфокиназа) КФК состоит из 2-х субъединиц 2 типов М (от англ, muscle - мышца) и
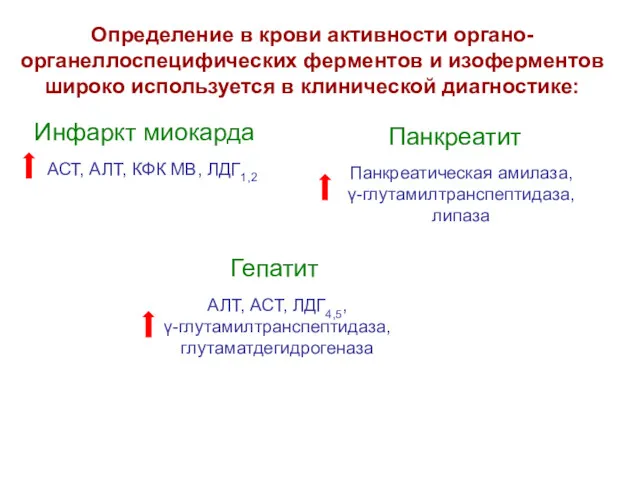
- 33. Определение в крови активности органо- органеллоспецифических ферментов и изоферментов широко используется в клинической диагностике: Инфаркт миокарда
- 34. Номенклатура – названия индивидуальных соединений, их групп, классов, а также правила составления этих названий Классификация –
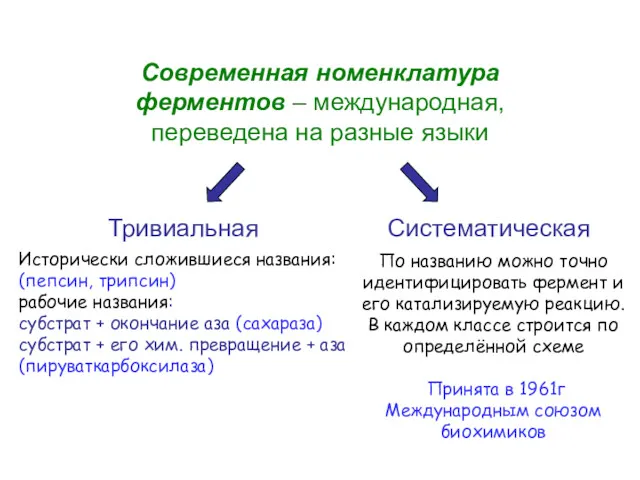
- 35. Современная номенклатура ферментов – международная, переведена на разные языки Исторически сложившиеся названия: (пепсин, трипсин) рабочие названия:
- 36. Классификация ферментов На основании 6 известных типов химических реакций ферменты, которые их катализируют, подразделяют на 6
- 38. Номенклатура ферментов В правилах названия ферментов нет единого подхода – в каждом классе свои правила Название
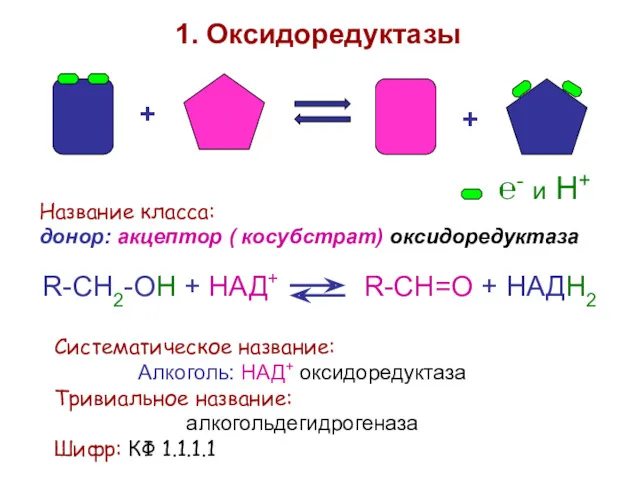
- 39. + + 1. Оксидоредуктазы Название класса: донор: акцептор ( косубстрат) оксидоредуктаза R-CH2-OH + НАД+ R-CH=О +
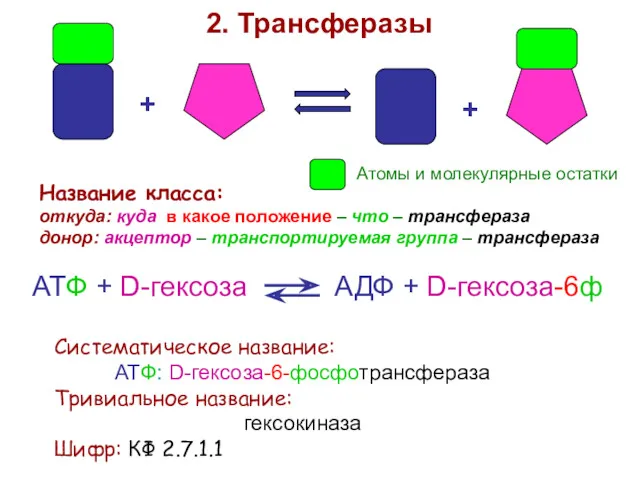
- 40. + + 2. Трансферазы Название класса: откуда: куда в какое положение – что – трансфераза донор:
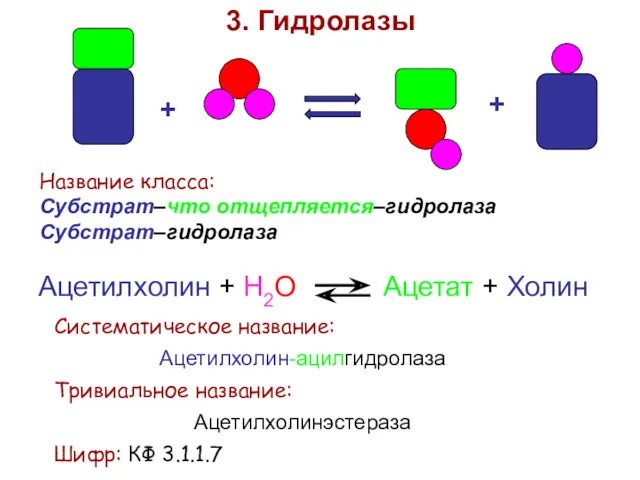
- 41. + + 3. Гидролазы Название класса: Субстрат–что отщепляется–гидролаза Субстрат–гидролаза Ацетилхолин + Н2О Ацетат + Холин Систематическое
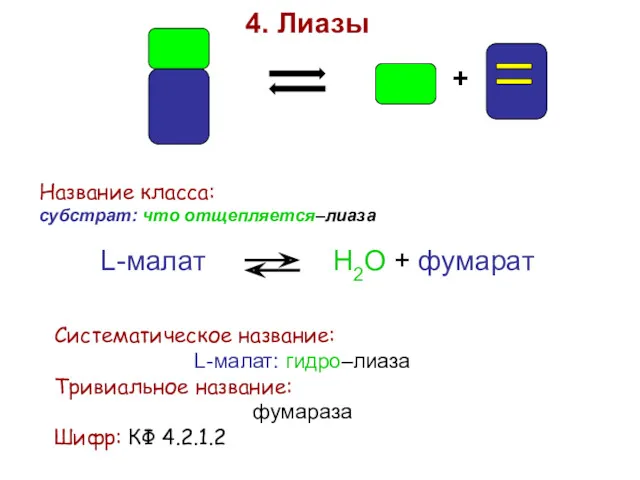
- 42. + 4. Лиазы Название класса: субстрат: что отщепляется–лиаза L-малат Н2О + фумарат Систематическое название: L-малат: гидро–лиаза
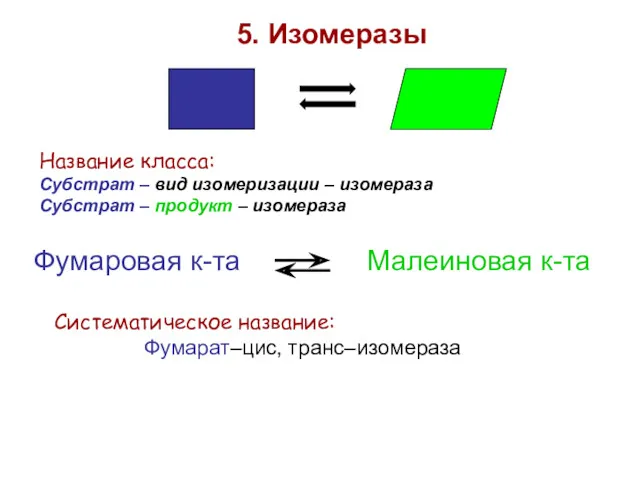
- 43. 5. Изомеразы Название класса: Субстрат – вид изомеризации – изомераза Субстрат – продукт – изомераза Фумаровая
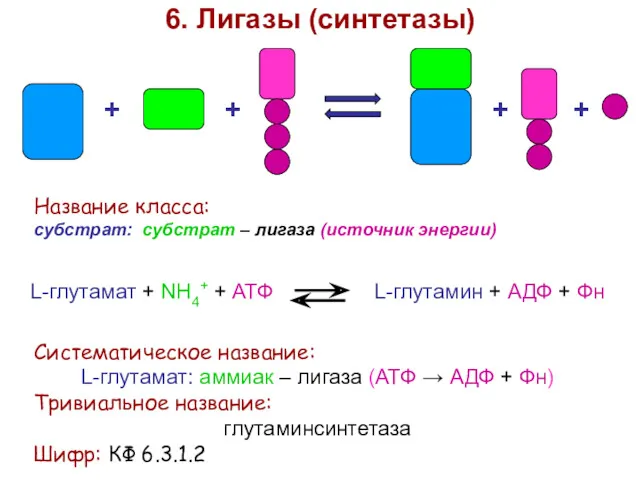
- 44. + + + + 6. Лигазы (синтетазы) Название класса: субстрат: субстрат – лигаза (источник энергии) L-глутамат
- 46. Скачать презентацию















 Онтогенез. Типы онтогенеза
Онтогенез. Типы онтогенеза Видообразование. Основные направления эволюционного процесса
Видообразование. Основные направления эволюционного процесса Физиология синапсов
Физиология синапсов Генная инженерия
Генная инженерия Системы, которые создают корневое давление и ответственны за поднятие корневого водного раствора вверх по сосудам ксилемы
Системы, которые создают корневое давление и ответственны за поднятие корневого водного раствора вверх по сосудам ксилемы Презентация. Разработка раздела по биологии, 8 класс
Презентация. Разработка раздела по биологии, 8 класс Видообразование. Результаты микроэволюции
Видообразование. Результаты микроэволюции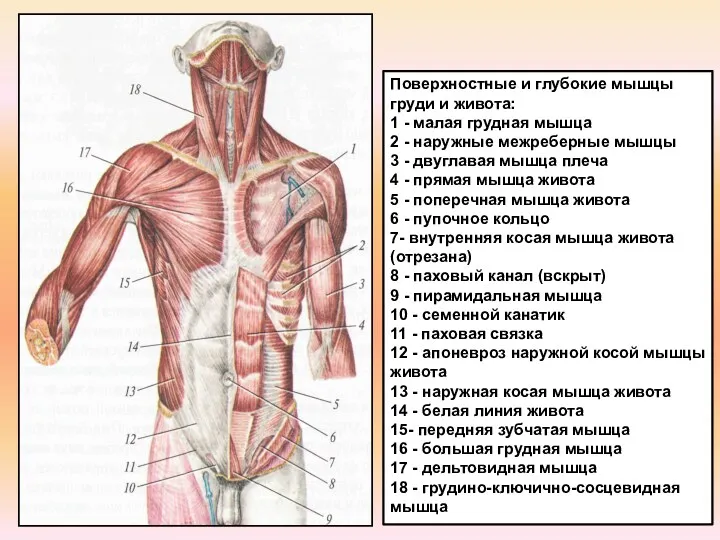 Поверхностные и глубокие мышцы груди и живота
Поверхностные и глубокие мышцы груди и живота Анатомия человека
Анатомия человека Плоды: значение и разнообразие. Типы семян
Плоды: значение и разнообразие. Типы семян Многообразие рыб
Многообразие рыб Эргастические вещества растительной клетки
Эргастические вещества растительной клетки Проектирование агротехнологий. Формирование структуры посевных площадей и севооборотов в современных агротехнологих
Проектирование агротехнологий. Формирование структуры посевных площадей и севооборотов в современных агротехнологих Імунна система людини, особливості її функціонування
Імунна система людини, особливості її функціонування Ягоды. Кроссворд
Ягоды. Кроссворд Паразитология как наука
Паразитология как наука Презентация по теме ''Лесные пожары''
Презентация по теме ''Лесные пожары'' Презентация к уроку биологии Дыхание животных
Презентация к уроку биологии Дыхание животных Клетка. Структура клетки. Органоиды клетки
Клетка. Структура клетки. Органоиды клетки Детоксикация ксенобиотиков
Детоксикация ксенобиотиков Млекопитающие отряда приматы
Млекопитающие отряда приматы Соотношение врожденного и приобретенного в поведении
Соотношение врожденного и приобретенного в поведении Тканевый обмен веществ
Тканевый обмен веществ Анализаторы. Литература
Анализаторы. Литература Марфуға Айтхожина
Марфуға Айтхожина Влияние талой воды на рост и развитие растений. 5 класс
Влияние талой воды на рост и развитие растений. 5 класс Органы дыхания
Органы дыхания Своя игра про животных
Своя игра про животных