Электрофорез
Электрофорез белков — способ разделения смеси белков на фракции или индивидуальные
белки.
Электрофорез белков применяют как для анализа компонентов смеси белков, так и для получения гомогенного белка.
Проблема: электрофоретическая подвижность зависит от заряда белка и его молекулярной массы (пространственной конфигурации)
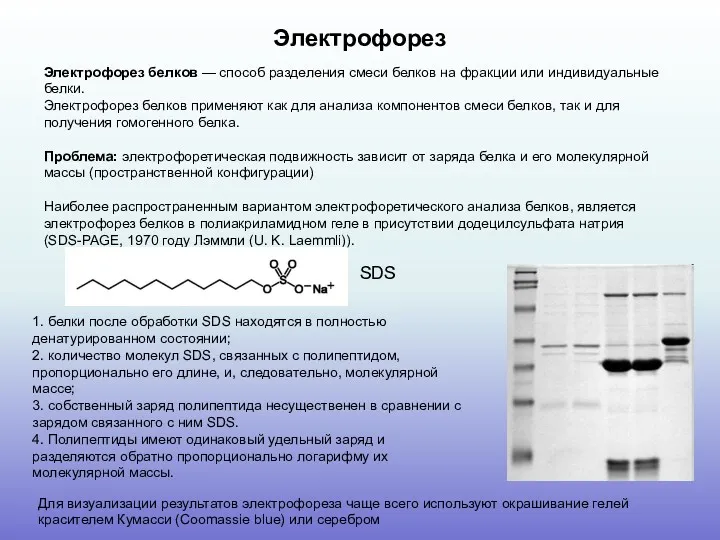
Наиболее распространенным вариантом электрофоретического анализа белков, является электрофорез белков в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE, 1970 году Лэммли (U. K. Laemmli)).
1. белки после обработки SDS находятся в полностью денатурированном состоянии;
2. количество молекул SDS, связанных с полипептидом, пропорционально его длине, и, следовательно, молекулярной массе;
3. собственный заряд полипептида несущественен в сравнении с зарядом связанного с ним SDS.
4. Полипептиды имеют одинаковый удельный заряд и разделяются обратно пропорционально логарифму их молекулярной массы.
SDS
Для визуализации результатов электрофореза чаще всего используют окрашивание гелей красителем Кумасси (Coomassie blue) или серебром




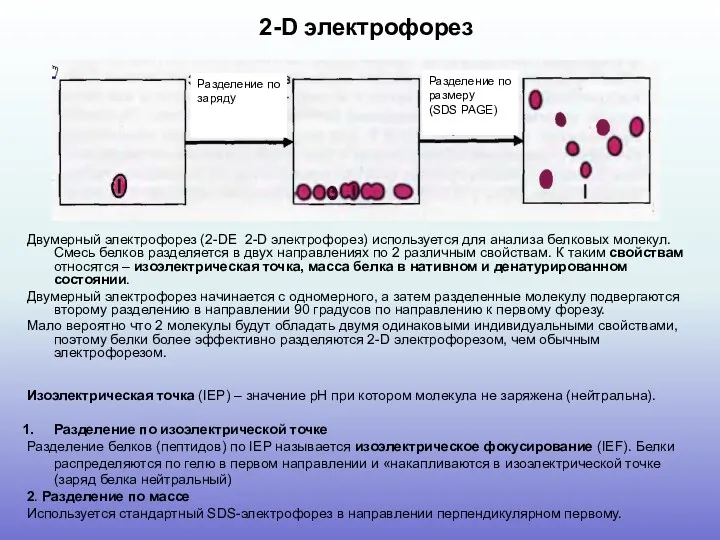
 Современная биология в сюжетах компьютерных игр
Современная биология в сюжетах компьютерных игр Chromista (Kingdom) - Царство Хромиста
Chromista (Kingdom) - Царство Хромиста Основные классы Типа Иглокожих. Биология 7 класс
Основные классы Типа Иглокожих. Биология 7 класс Эмбриогенез, общая морфофункциональная характеристика пищеварительной системы. Органы ротовой полости. Слюнные железы
Эмбриогенез, общая морфофункциональная характеристика пищеварительной системы. Органы ротовой полости. Слюнные железы Гипотезы происхождения жизни на Земле
Гипотезы происхождения жизни на Земле Доказательства эволюции
Доказательства эволюции Эмбриональное развитие осетровых
Эмбриональное развитие осетровых Хромосомная теория наследственности
Хромосомная теория наследственности Тип Членистоногие (Arthropoda)
Тип Членистоногие (Arthropoda) Сердечно-сосудистая система
Сердечно-сосудистая система Зуби ссавців
Зуби ссавців Тип Кишечнополостные
Тип Кишечнополостные Роль бактерий в природе и жизни человека
Роль бактерий в природе и жизни человека Пчелы
Пчелы Тип членистоногие. Класс насекомые: комнатная муха, вши, блохи
Тип членистоногие. Класс насекомые: комнатная муха, вши, блохи Презентация Беспозвоночные и позвоночные животные, 5 класс
Презентация Беспозвоночные и позвоночные животные, 5 класс Биология оқыту әдістемесінің негізгі дидактикалық принциптері. Биология оқыту формаларының жүйелері
Биология оқыту әдістемесінің негізгі дидактикалық принциптері. Биология оқыту формаларының жүйелері Молочнокислые бактерии
Молочнокислые бактерии Породы домашних животных
Породы домашних животных Рыбы. Приспособленность к обитанию в водной среде. 2
Рыбы. Приспособленность к обитанию в водной среде. 2 Голонасінні
Голонасінні В царстве цветов
В царстве цветов Строение и работа сердца
Строение и работа сердца Презентация Интегративное обучение в изучении предметов географии и биологии
Презентация Интегративное обучение в изучении предметов географии и биологии Витамины всем нужны
Витамины всем нужны Екологія мікроорганізмів. Мікрофлора організму людини. Мікрофлора ротової порожнини
Екологія мікроорганізмів. Мікрофлора організму людини. Мікрофлора ротової порожнини Молекулярная биология. (Лекция 5-6)
Молекулярная биология. (Лекция 5-6) Генетическая информация. Центральная догма молекулярной биологии
Генетическая информация. Центральная догма молекулярной биологии