Содержание
- 2. Omics-технологии – это оценка больших массивов данных о генах, белках или метаболитах биологического объекта путем обработки
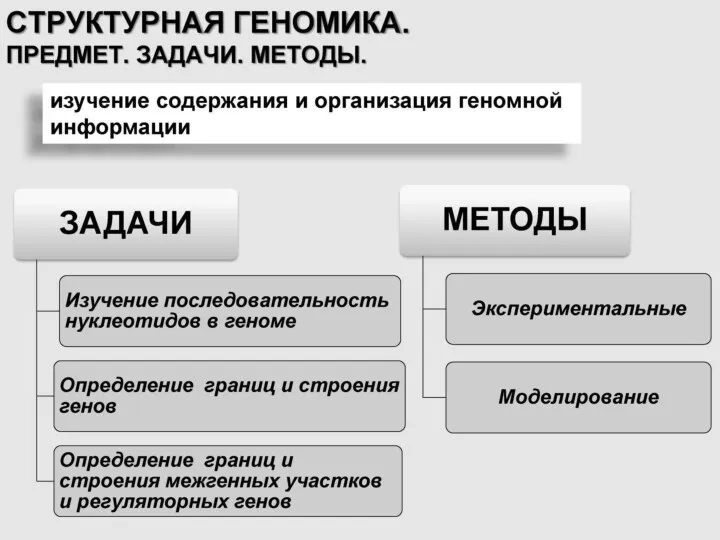
- 3. 1 ГЕНОМИКА Это область молекулярной генетики, посвящённая исследованию генома и генов живых организмов. Цель геномики –
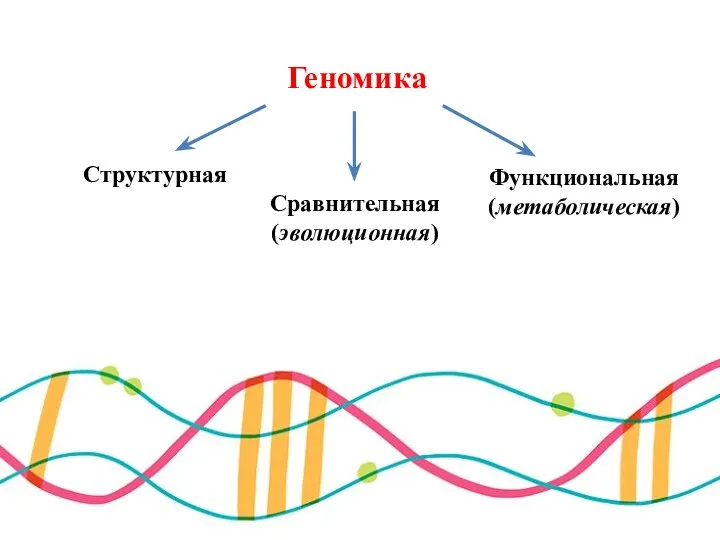
- 4. Геномика Структурная Сравнительная (эволюционная) Функциональная (метаболическая)
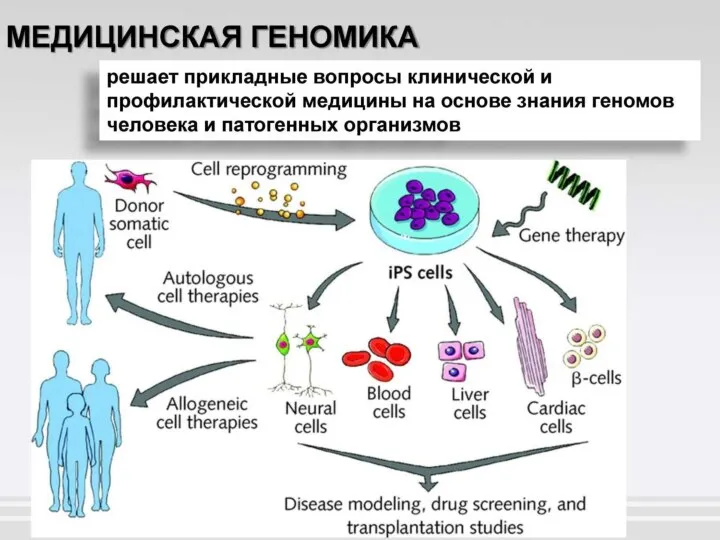
- 10. Это область геномики, исследующая, каким образом совокупность наследственной информации человека может влиять на эффект от принимаемых
- 11. Это научное направление, изучающее геномы с точки зрения их реакции на разные стрессорные условия окружающей среды
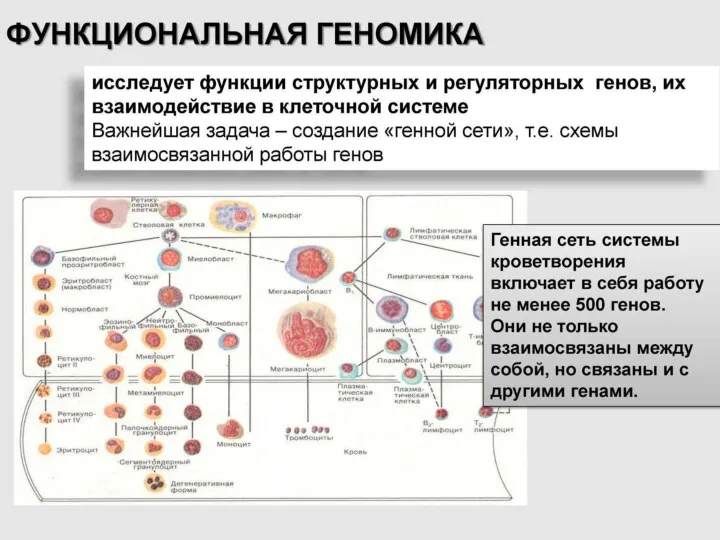
- 12. Изучает гены и некодирующие последовательности, необходимые для развития и функционирования головного мозга. КОГНИТИВНАЯ ГЕНОМИКА (геном и
- 13. ЭПИГЕНОМИКА / ЭПИГЕНЕТИКА Это область генетики, изучающая изменения экспрессии генов или фенотипа клетки, вызванных механизмами, не
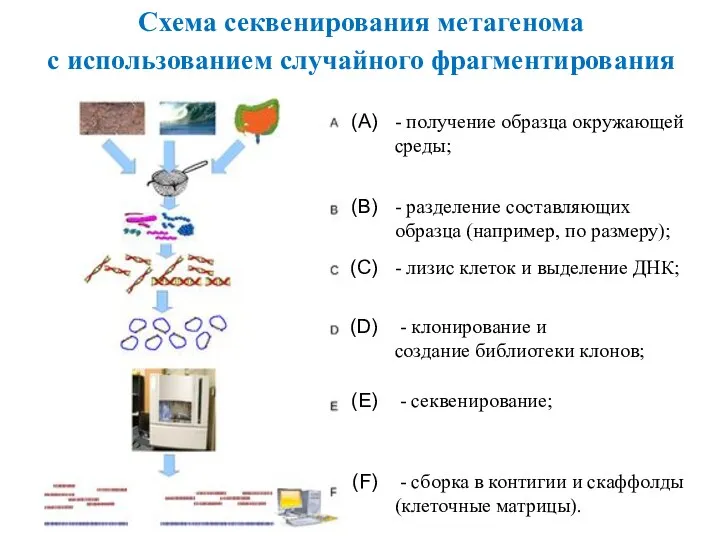
- 14. Это раздел молекулярной генетики, изучающий генетический материал всех микроорганизмов, находящихся в образце среды (метагеном). 2 МЕТАГЕНОМИКА
- 15. - получение образца окружающей среды; - разделение составляющих образца (например, по размеру); - лизис клеток и
- 16. [от лат. transcriptio – переписывание] – это идентификация всех матричных РНК, кодирующих белки, определение количества каждой
- 17. Методы транскриптомики SAGE (Serial analysis of gene expression) - серийный анализ экспрессии генов; ESTs (Expressed Sequence
- 18. «Серийный анализ экспрессии генов» (SAGE) — молекулярно-генетический метод, позволяющий одновременно количественно и качественно охарактеризовать экспрессию тысяч
- 19. «Прочитанные фрагменты экспрессированных последовательностей» (ESTs) Это очень мощный метод для глобального компьютерного анализа структуры транскриптов, реконструкции
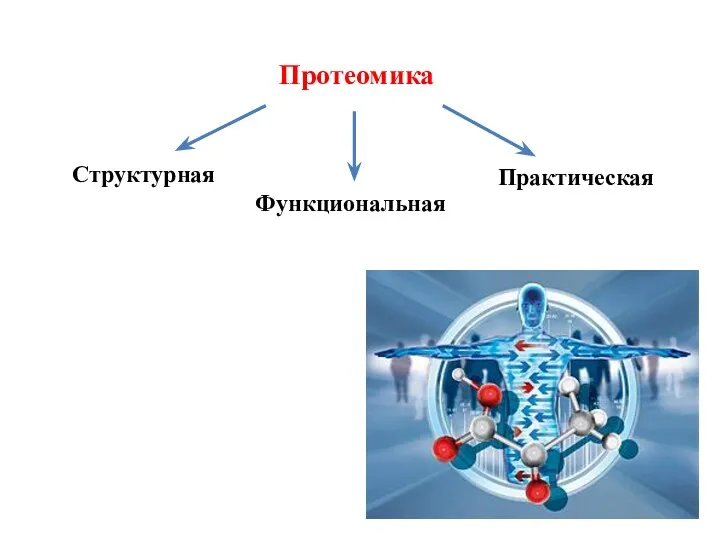
- 20. Это наука, изучающая белковый состав биологических объектов, а также структурно-функциональные свойства белковых молекул. 4 ПРОТЕОМИКА Задача
- 21. Протеомика Структурная Функциональная Практическая
- 22. Структурная протеомика Цель структурной протеомики – установление структуры всех белков живого организма. Задачи структурной протеомики: выделение
- 23. Функциональная протеомика Цель функциональной протеомики - определение функциональных свойств протеома. Задачи функциональной протеомики: установление функций каждого
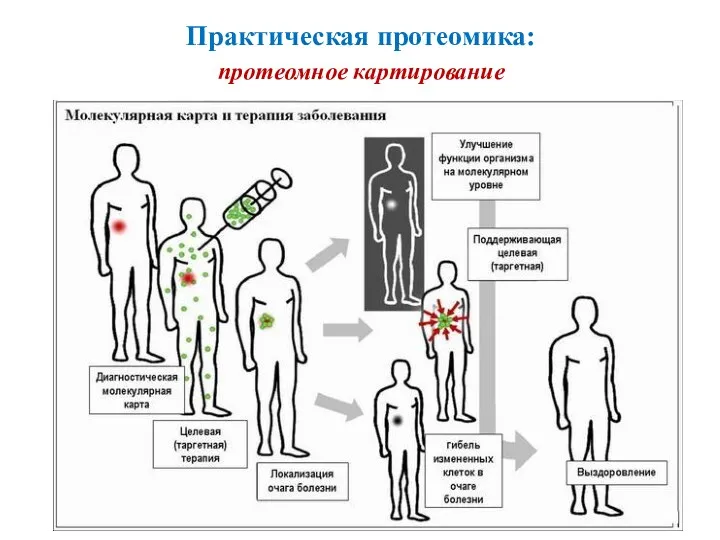
- 24. Практическая протеомика: протеомное картирование
- 25. .
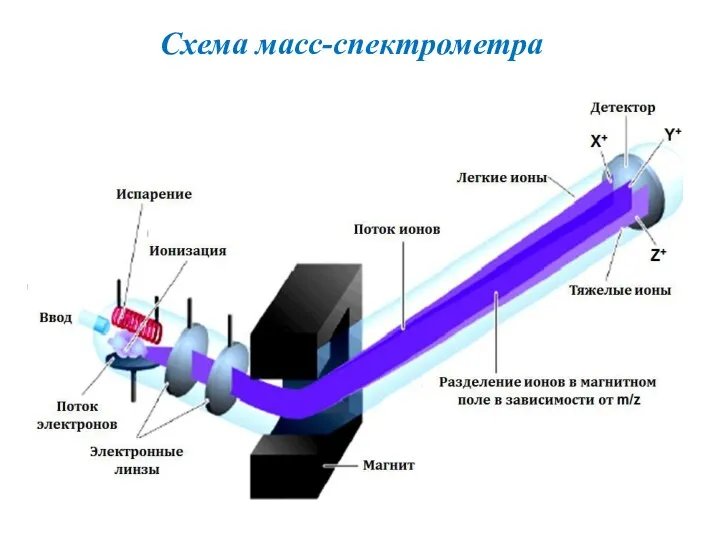
- 26. Схема масс-спектрометра
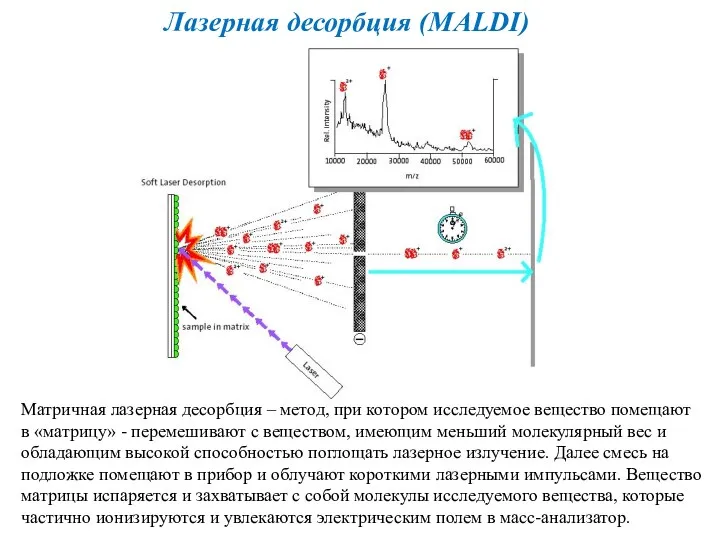
- 27. Лазерная десорбция (MALDI) Матричная лазерная десорбция – метод, при котором исследуемое вещество помещают в «матрицу» -
- 28. Двумерный (2D) электрофорез
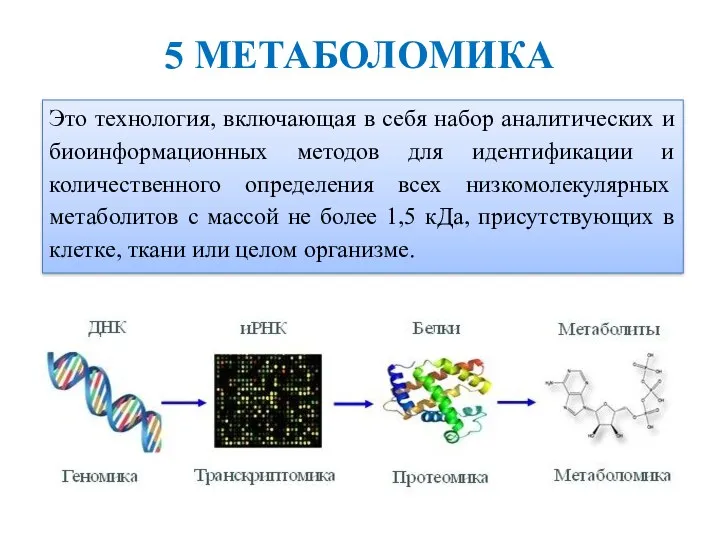
- 29. Это технология, включающая в себя набор аналитических и биоинформационных методов для идентификации и количественного определения всех
- 30. Это количественное измерение динамического многопараметрического метаболического ответа живых систем на патофизиологические воздействия или генные модификации. МЕТАБОНОМИКА
- 31. Это раздел метаболомики, основанный на анализе влияния ксенобиотиков на изменения метаболических процессов в организме человека. На
- 32. Аналитические методы метаболомики / метабономики 1. Методы разделения: - газовая хроматография; - высокоэффективная жидкостная хроматография; -
- 33. Это систематическое изучение всех гликановых структур клетки или организма (более 16 млн. структурных единиц). 6 ГЛИКОМИКА
- 34. Методы в гликомике Биоинформационные методы для анализа гликановых структур: 1) анализ гликозилирования; 2) масс-спектральный анализ; 3)
- 35. Это наука о липидах, основанная на исследовании идентификации и количественном определении различных клеточных липидов, их взаимодействии
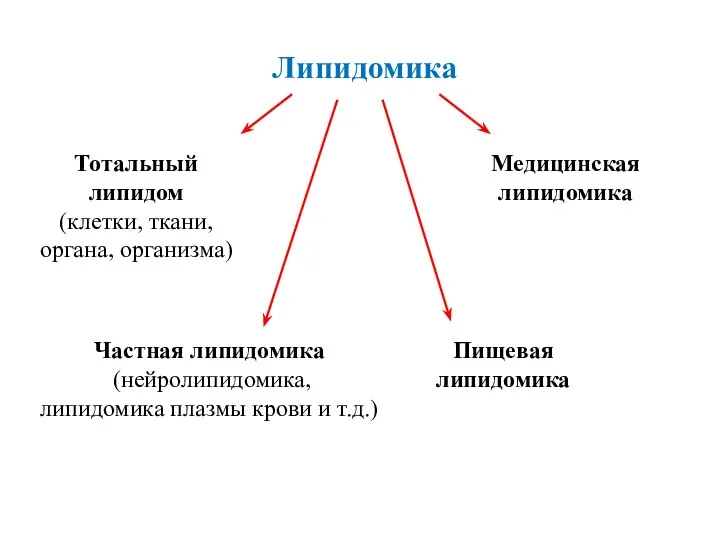
- 36. Липидомика Тотальный липидом (клетки, ткани, органа, организма) Частная липидомика (нейролипидомика, липидомика плазмы крови и т.д.) Пищевая
- 37. Методы, применяемые для анализа липидов - твердофазная экстракция; - тонкослойная хроматография (ТСХ); - ИК-спектроскопия (применяется для
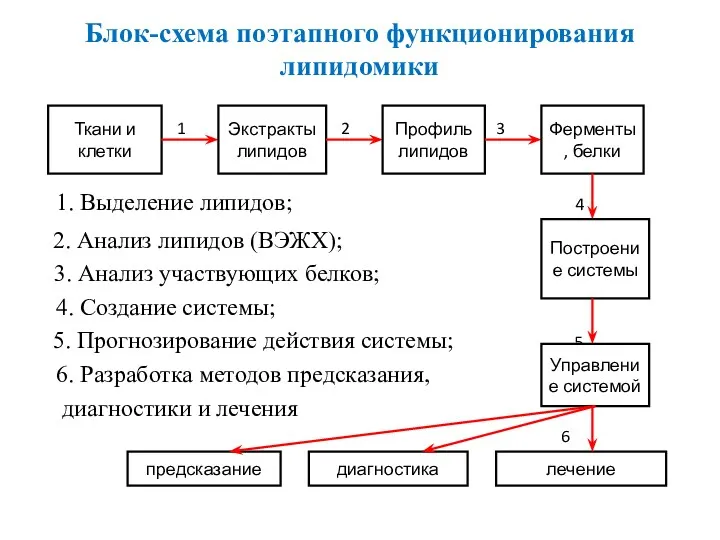
- 38. Блок-схема поэтапного функционирования липидомики 1 2 3 1. Выделение липидов; 4 2. Анализ липидов (ВЭЖХ); 3.
- 39. Применение липидомики: идентификация новых липидных молекул; использование липидов в качестве биомаркеров (медицинская липидомика); выявление регуляторной роли
- 40. Это область биоинформатики и системной биологии, идея которой заключается в объединении данных молекулярных взаимодействий на уровнях
- 41. Методы анализа интерактома афинная очистка и последующая масс-спектрометрия; валидация - путем сравнения его с уже известными
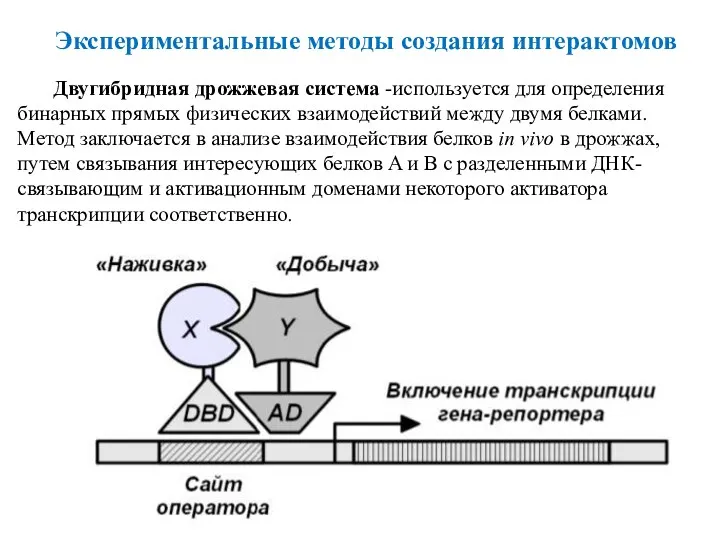
- 42. Двугибридная дрожжевая система -используется для определения бинарных прямых физических взаимодействий между двумя белками. Метод заключается в
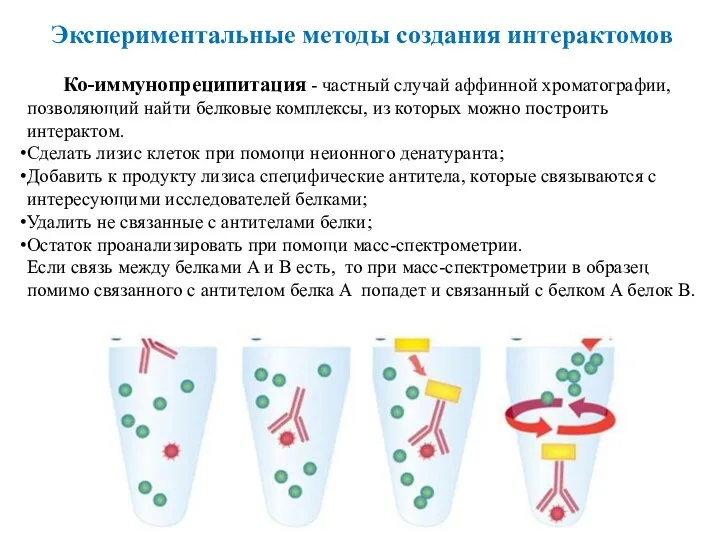
- 43. Ко-иммунопреципитация - частный случай аффинной хроматографии, позволяющий найти белковые комплексы, из которых можно построить интерактом. Сделать
- 44. Это суммарный анализ, используемый для персонифицируемой медицины и объединяющий данные о геноме, нуклеотидных последовательностях мРНК, белках,
- 45. Ключевые стадии интеграции данных:
- 47. Скачать презентацию









![[от лат. transcriptio – переписывание] – это идентификация всех матричных](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/347958/slide-15.jpg)




















 Учение академика В.И. Вернадского
Учение академика В.И. Вернадского Проект по биологии В защиту незаслуженно гонимых
Проект по биологии В защиту незаслуженно гонимых Углеводы. Функции углеводов
Углеводы. Функции углеводов Бактерии. Общая характеристика. Взаимоотношения с другими организмами
Бактерии. Общая характеристика. Взаимоотношения с другими организмами Транспорт веществ у растений и животных
Транспорт веществ у растений и животных Химический состав клетки
Химический состав клетки Презентация Как растения показывают погоду и время.
Презентация Как растения показывают погоду и время. Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Игра – акция Зимовка по науке
Игра – акция Зимовка по науке водоросли биология
водоросли биология Предмет и задачи генетики
Предмет и задачи генетики Презентация Витамины биология 8 класс
Презентация Витамины биология 8 класс Растениеводство. Жизненный цикл зерновых хлебов
Растениеводство. Жизненный цикл зерновых хлебов Голонасінні. Ялина європейська
Голонасінні. Ялина європейська Вирусы. Бактерии. Простейшие. Грибы. Лишайники
Вирусы. Бактерии. Простейшие. Грибы. Лишайники Строение клетки. Эндоплазматическая сеть. Комплекс гольджи. Лизосомы. Клеточные включения. Митохондрии. Пластиды
Строение клетки. Эндоплазматическая сеть. Комплекс гольджи. Лизосомы. Клеточные включения. Митохондрии. Пластиды Иммобилизованные ферменты, способы иммобилизации
Иммобилизованные ферменты, способы иммобилизации Строение и жизнедеятельность бактерий
Строение и жизнедеятельность бактерий Водоросли. Разнообразие водорослей
Водоросли. Разнообразие водорослей Царство грибы
Царство грибы Теңіз балдырлары
Теңіз балдырлары Живые клетки. Методы их изучения. Изучение строения клетки растения с помощью микроскопа. 5 класс
Живые клетки. Методы их изучения. Изучение строения клетки растения с помощью микроскопа. 5 класс Белки. Качественный состав белков
Белки. Качественный состав белков Генетические основы селекции собак
Генетические основы селекции собак Они рядом с нами редкие и исчезающие животные Кемеровской области
Они рядом с нами редкие и исчезающие животные Кемеровской области Электрические свойства тканей организма. (Лекция 6)
Электрические свойства тканей организма. (Лекция 6) Введение в общую биологию. (критерии и уровни организации жизни)
Введение в общую биологию. (критерии и уровни организации жизни) Viruses. Procaryotes. Cyanobacteria
Viruses. Procaryotes. Cyanobacteria