Содержание
- 2. Объяснение свойств вещества, исходя из представлений о его молекулярном строении, составляет предмет молекулярно-кинетической теории вещества.
- 3. Виды агрегатных состояний
- 4. Агрегатное состояние вещества характеризуется взаимным расположением, характером движения и взаимодействием молекул одного и того же вещества.
- 5. Реализация того или иного агрегатного состояния вещества зависит от соотношения кинетической и потенциальной энергии молекул, входящих
- 6. Твердые кристаллические тела Характеризуются в расположении равновесных положений атомов Силы электрического отталкивания ядер молекул противодействуют (на
- 7. Твёрдое тело ТВЕРДОЕ ТЕ́ЛО, агрегатное состояние вещества, отличающееся стабильностью формы и характером теплового движения атомов, которые
- 9. Рис. Расположение атомов в кристаллическом (а) и аморфном (б) веществе
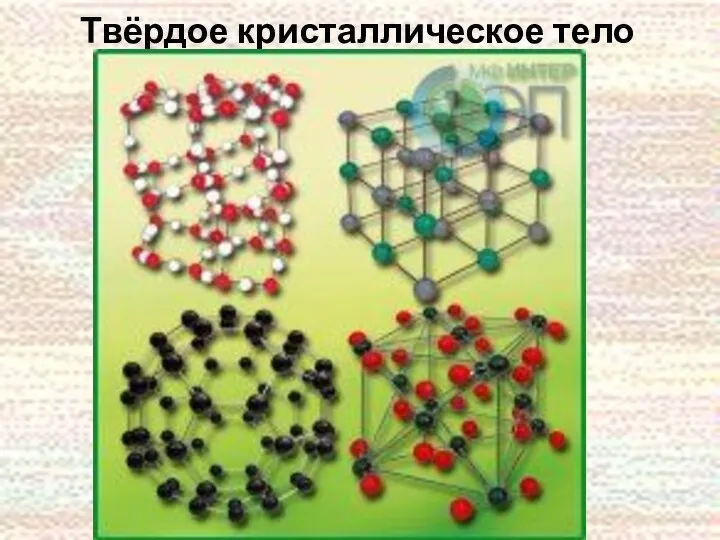
- 10. Твёрдое кристаллическое тело
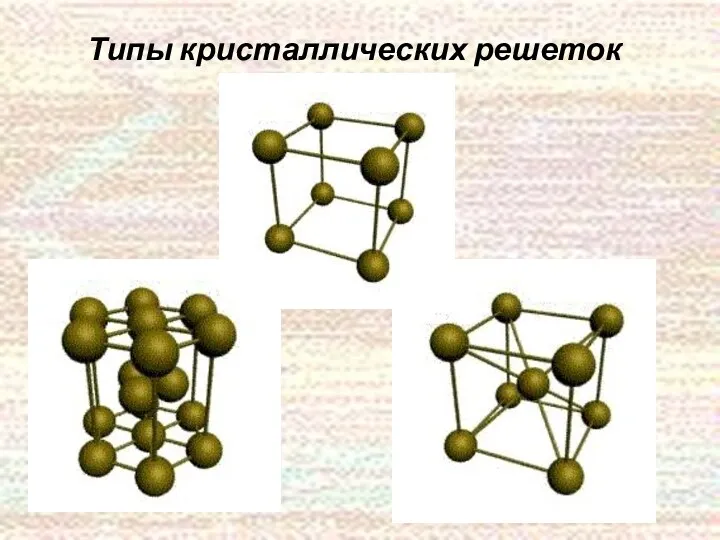
- 11. Типы кристаллических решеток
- 12. Положения равновесия, относительно которых происходят тепловые колебания частиц, называются узлами кристаллической решетки. Монокристалл — твердое тело,
- 13. Аморфные тела – это твёрдые тела, где сохраняется только ближний порядок в расположении атомов. (Кремнезём, смола,
- 14. Характерной особенностью аморфных тел является их изотропность, т. е. независимость всех физических свойств (механических, оптических и
- 15. Свойства аморфных тел. В аморфных твердых телах атомы колеблются около хаотически расположенных точек Сохраняют форму и
- 16. Уменьшение энергии связи при нагревании позволяет молекулам перескакивать из одного положения равновесия в другое. В результате
- 17. При фазовом переходе твёрдое тело – жидкость происходит нарушение симметрии системы. Относительные положения молекул в жидкости
- 18. ГА́З (франц. gaz, от греч. chaos — хаос), агрегатное состояние вещества, в котором составляющие его атомы
- 19. ГАЗЫ
- 20. Газы равномерно заполняют доступное для них пространство, и в отличие от жидкостей и твердых тел, не
- 21. Свойства большинства газов — прозрачность, бесцветность и легкость — затрудняло их изучение, поэтому физика и химия
- 22. Уравнение pV=RT называют уравнением состояния идеального газа. Оно было получено в 1834 Б. Клапейроном и обобщено
- 23. Внутренняя энергия идеального газа (среднее значение полной энергии всех его частиц) зависит только от его температуры.
- 24. Любое вещество можно перевести в газообразное состояние соответствующим подбором давления и температуры. Поэтому возможную область существования
- 25. Жидкость Вещество находится в жидком состоянии, если средняя кинетическая энергия молекул соизмерима со средней потенциальной энергией
- 26. ЖИ́ДКОСТЬ, агрегатное состояние вещества, сочетающее в себе черты твердого состояния (сохранение объема, определенная прочность на разрыв)
- 28. Под действием внешней силы жидкость течет, сохраняя свой объем, и принимает форму сосуда. Сжимаемость жидкости невелика
- 29. ПЛА́ЗМА (от греч. plasma — вылепленное, оформленное), ионизованный газ, в котором концентрации положительных и отрицательных зарядов
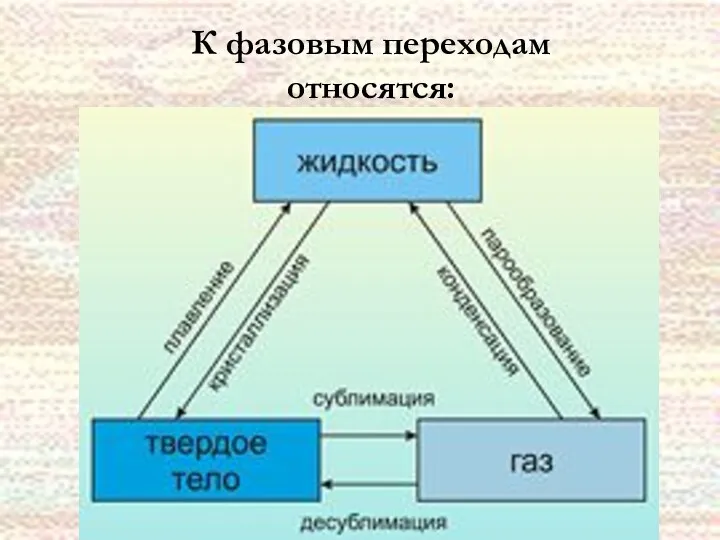
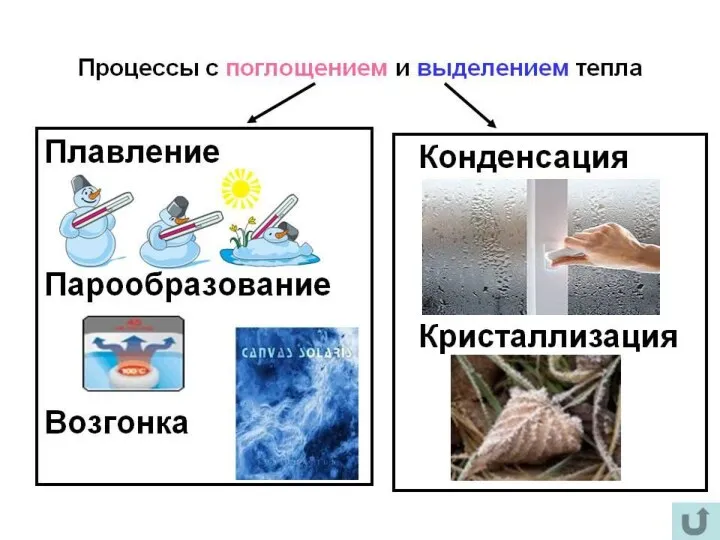
- 30. Переход системы из одного агрегатного состояния в другое называется ФАЗОВЫМ ПЕРЕХОДОМ При фазовом переходе скачкообразно изменяется
- 31. К фазовым переходам относятся:
- 33. собой. Плавление - переход тела из кристаллического твёрдого состояния в жидкое. Плавление происходит с поглощением удельной
- 34. собой. При плавлении объем большинства кристаллических тел увеличивается (на 3-6%), а при отвердевании уменьшается. Но, существуют
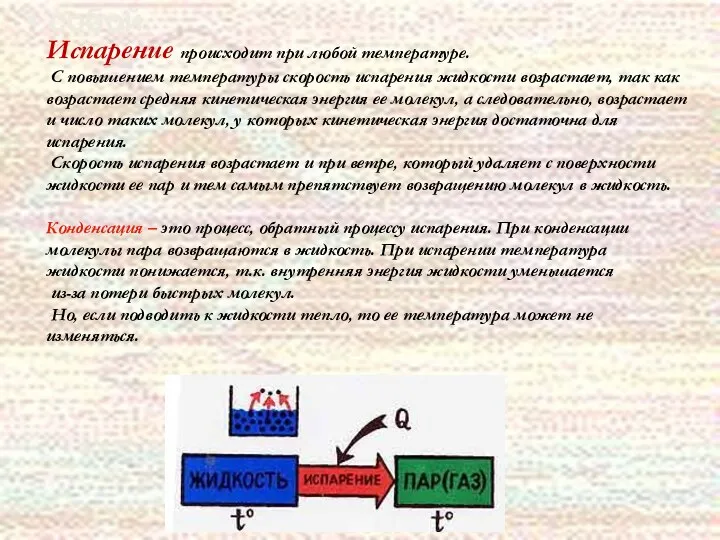
- 35. собой. Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение
- 36. собой. Испарение происходит при любой температуре. С повышением температуры скорость испарения жидкости возрастает, так как возрастает
- 37. собой. Иониза́ция — эндотермический процесс образования ионов из нейтральных атомов или молекул. Положительно заряженный ион образуется,
- 39. Скачать презентацию






























 ТО Рулевого управления с электроприводом
ТО Рулевого управления с электроприводом Электромагнитное поле. Электромагнитные волны
Электромагнитное поле. Электромагнитные волны Конструктивное выполнение РУ ПС (часть 1)
Конструктивное выполнение РУ ПС (часть 1) Производственный процесс ремонта АТ
Производственный процесс ремонта АТ Карбюратор. Устройство
Карбюратор. Устройство §9. Сложное движение точки
§9. Сложное движение точки Итоговая контрольная работа по физике 7 клас
Итоговая контрольная работа по физике 7 клас Реактивное движение
Реактивное движение Радиоактивные превращения атомных ядер
Радиоактивные превращения атомных ядер Нагревание проводников электрическим током. Закон Джоуля – Ленца
Нагревание проводников электрическим током. Закон Джоуля – Ленца The fuel system
The fuel system Методы определения реологических свойств
Методы определения реологических свойств Диапазоны частот. Радиоволны
Диапазоны частот. Радиоволны Ремонт автомобилей. Ремонт автомобильных шин. (Тема 4.12)
Ремонт автомобилей. Ремонт автомобильных шин. (Тема 4.12) Движение электрона в атоме
Движение электрона в атоме Своя игра. Физика. 7 класс.
Своя игра. Физика. 7 класс. Screw Locking Devices of Disconnected Joins
Screw Locking Devices of Disconnected Joins Внеклассное мероприятие по физике в 7 классе
Внеклассное мероприятие по физике в 7 классе Трехфазные цепи
Трехфазные цепи Эксплуатация оборудования для диагностики автомобилей
Эксплуатация оборудования для диагностики автомобилей Требования к машинам и деталям
Требования к машинам и деталям Есептеу әдістемесі мен механикалық құралжабдықтарды таңдау
Есептеу әдістемесі мен механикалық құралжабдықтарды таңдау Урок по физике Соединение проводников. Работа и мощность электрического тока
Урок по физике Соединение проводников. Работа и мощность электрического тока Изотермический, изобарный и изохорный процессы. (10 класс)
Изотермический, изобарный и изохорный процессы. (10 класс) Что такое физика
Что такое физика Презентация к уроку по теме: Электрическое поле. Действие электрического поля на заряды
Презентация к уроку по теме: Электрическое поле. Действие электрического поля на заряды Неравномерное плавно изменяющееся движение воды в нецилиндрических искусственных руслах. Схема открытого русла
Неравномерное плавно изменяющееся движение воды в нецилиндрических искусственных руслах. Схема открытого русла Источники электрического тока. Физика. 8 класс
Источники электрического тока. Физика. 8 класс