Содержание
- 2. Все, что видим мы, - видимость только одна. Далеко от поверхности мира до дна. Полагай несущественным
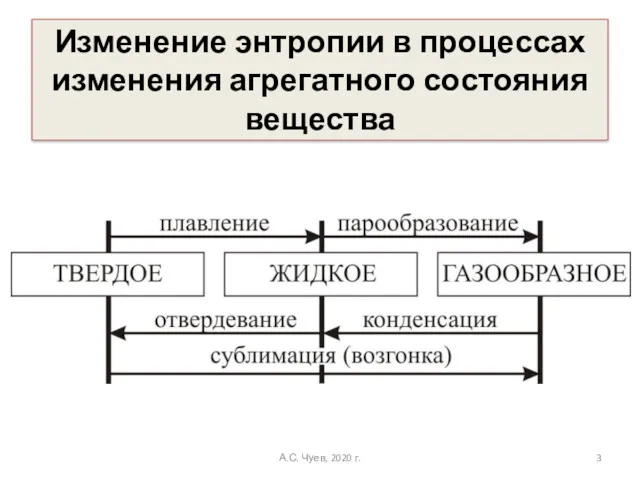
- 3. Изменение энтропии в процессах изменения агрегатного состояния вещества А.С. Чуев, 2020 г.
- 4. При равных температурах фазовая область молекул газа значительно больше фазовой области молекул жидкости, и энтропия газа
- 5. Условие равновесия фаз Макроскопическая часть среды (вещества), имеющая однородный физико-химический состав, называется фазой. В состоянии равновесия
- 6. Первое из этих условий означает равенство температур и с разных сторон границы раздела фаз: Второе условие
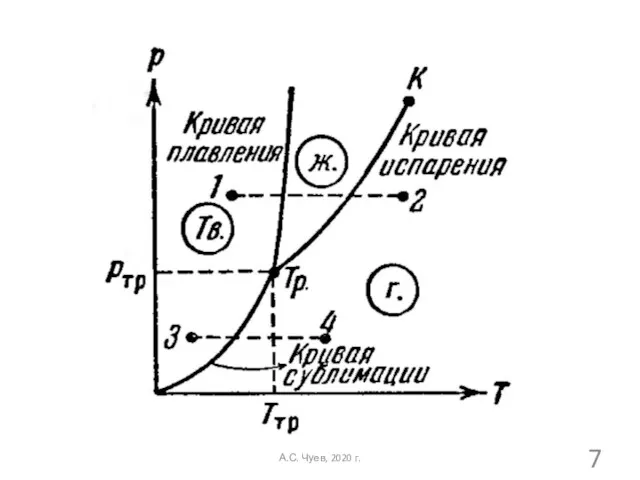
- 7. А.С. Чуев, 2020 г.
- 8. В отличие от удельных термодинамических потенциалов, величины которых на границе раздела фаз одинаковые, при фазовых превращениях
- 9. Изотермы уравнения Ван-дер-Ваальса Проанализируем изотермы уравнения Ван-дер-Ваальса – зависимости Р от V для реального газа при
- 10. Поскольку данное уравнение имеет третью степень относительно V, а коэффициенты при V действительны, то оно имеет
- 11. А.С. Чуев, 2020 г.
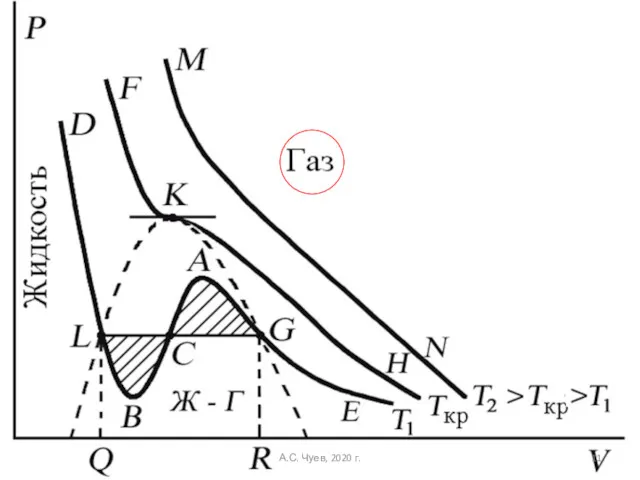
- 12. При T > Tкр вещество находится только в одном – газообразном состоянии При температуре газа ниже
- 13. При квазистатическом сжатии, начиная с точки G, система распадается на 2 фазы – жидкость и газ,
- 14. Наличие критической точки на изотерме Ван-дер-Ваальса означает, что для каждой жидкости существует такая температура, выше которой
- 15. Такую температуру Менделеев назвал температурой абсолютного кипения. Выше этой температуры, согласно Менделееву, газ не может быть
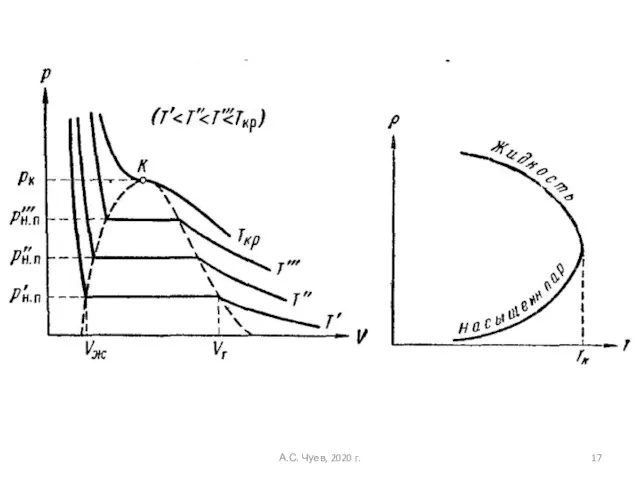
- 16. Критическая точка K - точка перегиба критической изотермы, в которой касательная к изотерме горизонтальна А.С. Чуев,
- 17. А.С. Чуев, 2020 г.
- 18. Изучим критическую точку А.С. Чуев, 2020 г.
- 19. Связь критических параметров: А.С. Чуев, 2020 г.
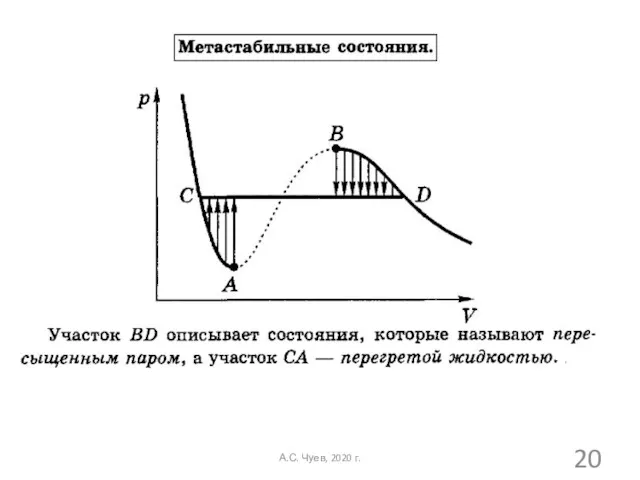
- 20. А.С. Чуев, 2020 г.
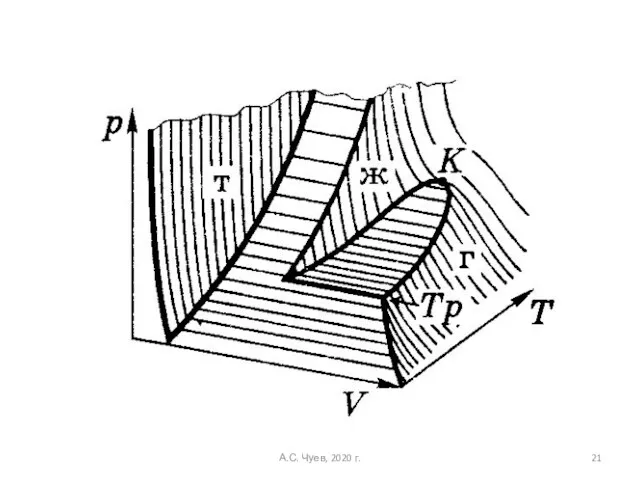
- 21. А.С. Чуев, 2020 г.
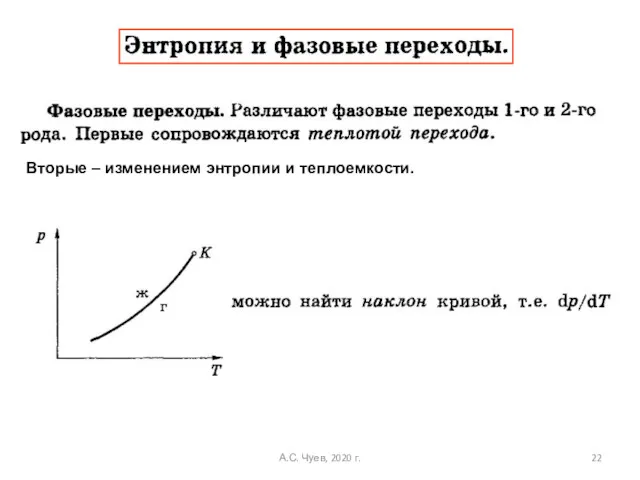
- 22. Вторые – изменением энтропии и теплоемкости. А.С. Чуев, 2020 г.
- 23. А.С. Чуев, 2020 г.
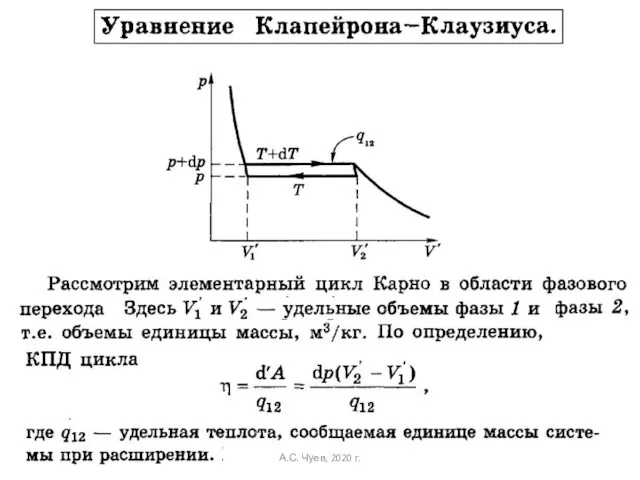
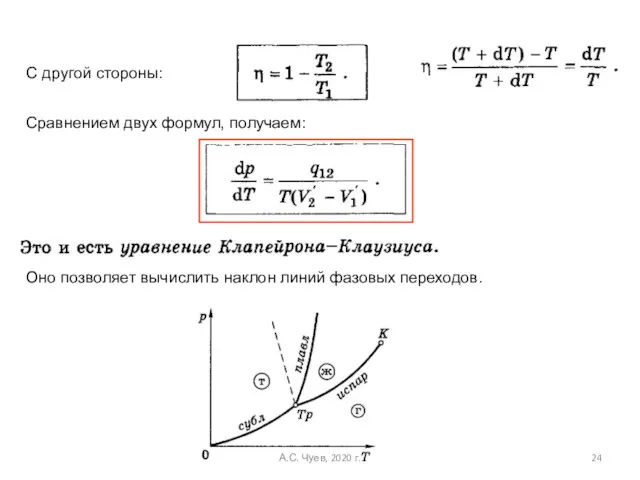
- 24. Оно позволяет вычислить наклон линий фазовых переходов. С другой стороны: Сравнением двух формул, получаем: А.С. Чуев,
- 25. Сила и энергия поверхностного натяжения А.С. Чуев, 2020 г.
- 26. А.С. Чуев, 2020 г.
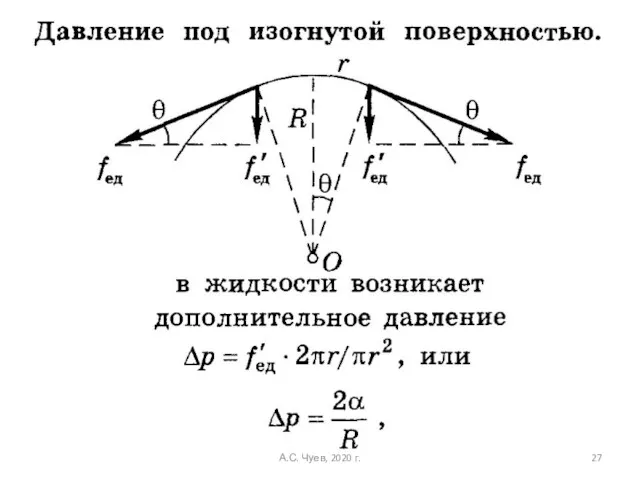
- 27. А.С. Чуев, 2020 г.
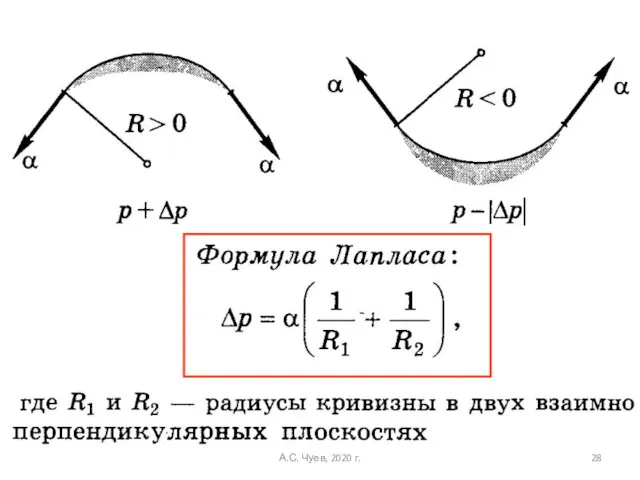
- 28. А.С. Чуев, 2020 г.
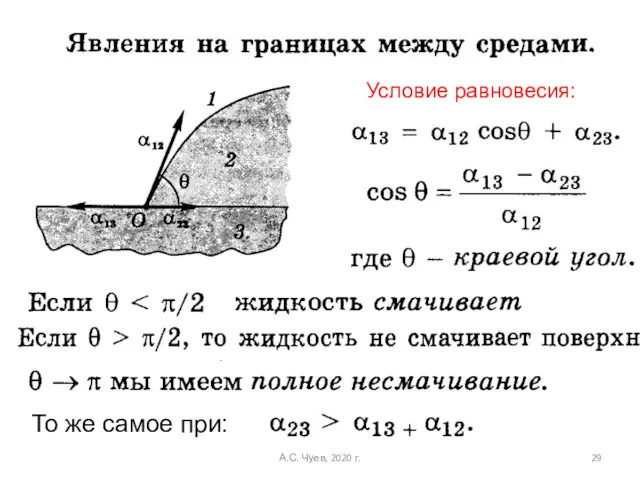
- 29. Условие равновесия: То же самое при: А.С. Чуев, 2020 г.
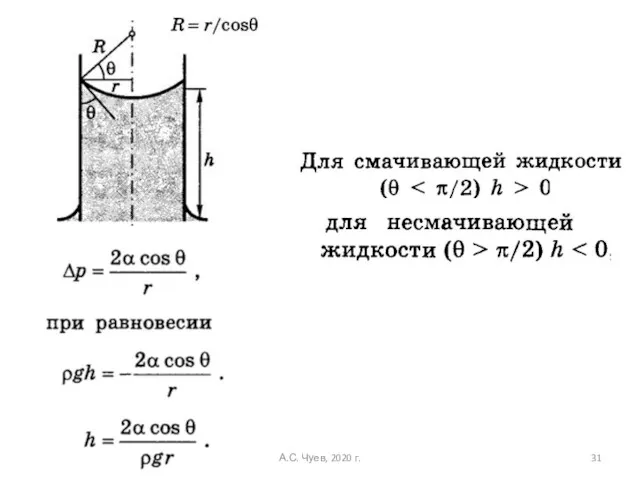
- 30. Капиллярные явления А.С. Чуев, 2020 г.
- 31. А.С. Чуев, 2020 г.
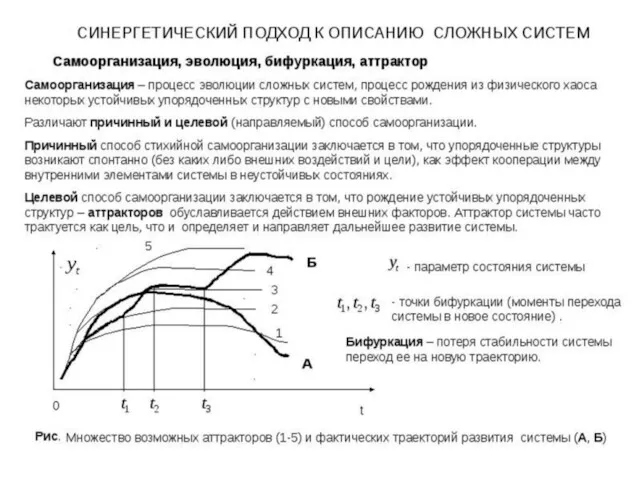
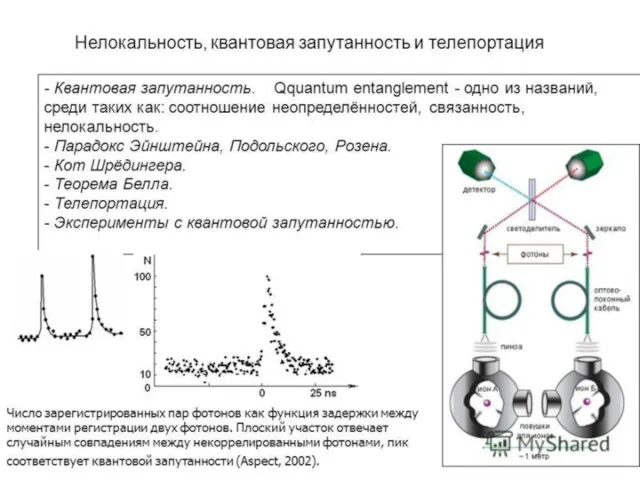
- 32. О диссипативных структурах А.С. Чуев, 2020 г. Факультативный материал
- 33. А.С. Чуев, 2020 г.
- 34. А.С. Чуев, 2020 г.
- 35. А.С. Чуев, 2020 г.
- 36. А.С. Чуев, 2020 г.
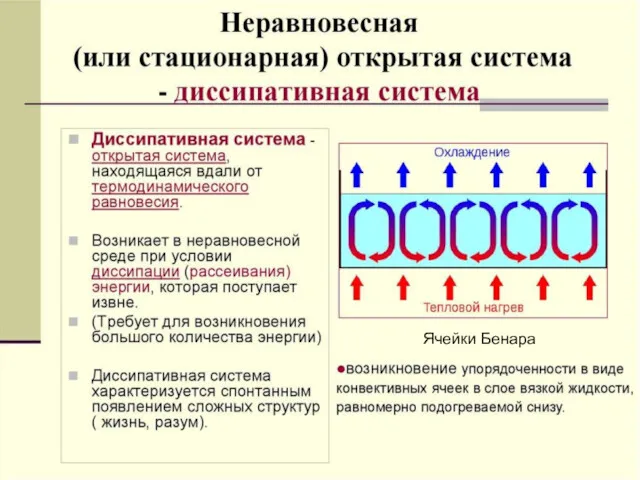
- 37. А.С. Чуев, 2020 г. Ячейки Бенара
- 38. А.С. Чуев, 2020 г.
- 39. А.С. Чуев, 2020 г.
- 40. А.С. Чуев, 2020 г.
- 41. А.С. Чуев, 2020 г.
- 42. А.С. Чуев, 2020 г.
- 43. А.С. Чуев, 2020 г.
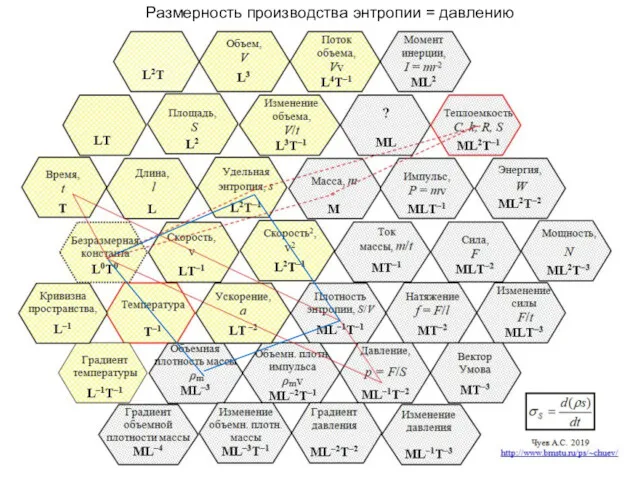
- 44. А.С. Чуев, 2020 г. Размерность производства энтропии = давлению
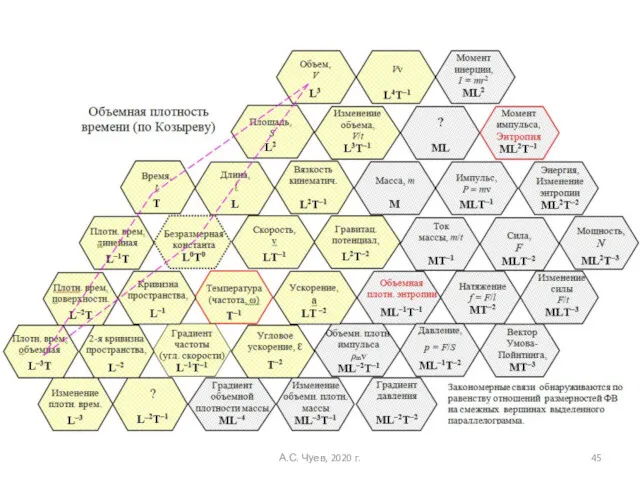
- 45. А.С. Чуев, 2020 г.
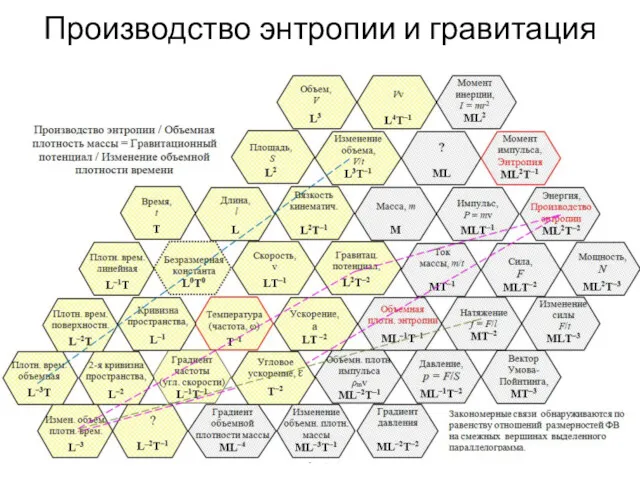
- 46. Производство энтропии и гравитация А.С. Чуев, 2020 г.
- 47. А.С. Чуев, 2020 г.
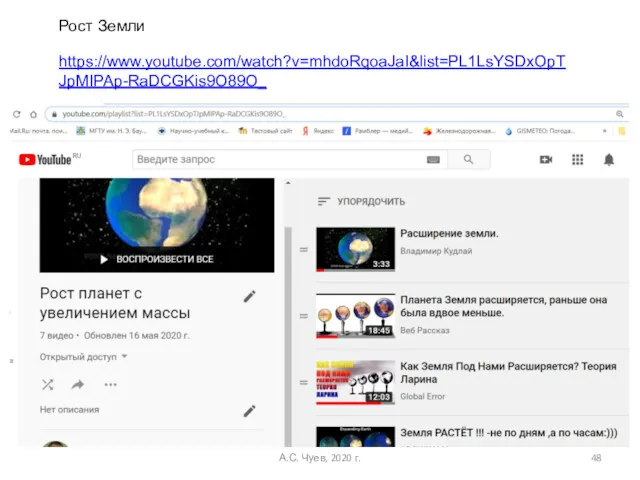
- 48. А.С. Чуев, 2020 г. Рост Земли https://www.youtube.com/watch?v=mhdoRqoaJaI&list=PL1LsYSDxOpTJpMIPAp-RaDCGKis9O89O_
- 50. Скачать презентацию

























 Световая волна. Интерференция света. Когерентность
Световая волна. Интерференция света. Когерентность Сварка. Сварные соеденения
Сварка. Сварные соеденения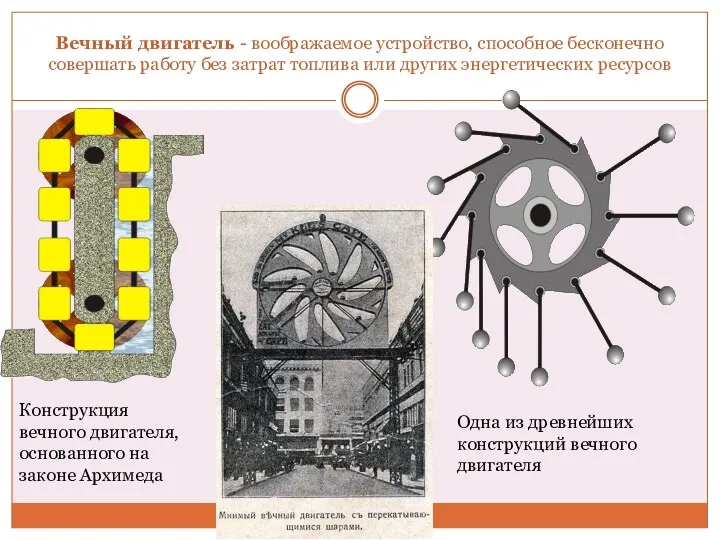 Первый закон термодинамики
Первый закон термодинамики Дизель Д49 детально
Дизель Д49 детально Тепловые двигатели и охрана окружающей среды
Тепловые двигатели и охрана окружающей среды Обертальний рух в природі, як основа відліку часу
Обертальний рух в природі, як основа відліку часу Теория возраста. энергия нейтрона до и после рассеяния
Теория возраста. энергия нейтрона до и после рассеяния Four-Stroke Engine
Four-Stroke Engine Сила упругости. Закон Гука (7 класс)
Сила упругости. Закон Гука (7 класс) Уравнение состояния идеального газа. Газовые законы
Уравнение состояния идеального газа. Газовые законы Прочность металлов и сплавов как совокупная характеристика влияния структурных уровней
Прочность металлов и сплавов как совокупная характеристика влияния структурных уровней Подготовка к ЕГЭ и ГИА по физике (вариант 1, задания 13-32)
Подготовка к ЕГЭ и ГИА по физике (вариант 1, задания 13-32) Линза. Выпуклые линзы
Линза. Выпуклые линзы Тяжелые катастрофы на зарубежных ядерных станциях
Тяжелые катастрофы на зарубежных ядерных станциях Детали машин и основы конструирования. Основы проектирования, критерии работоспособности и расчета деталей машин. (Лекция 1)
Детали машин и основы конструирования. Основы проектирования, критерии работоспособности и расчета деталей машин. (Лекция 1) Катушки индуктивности
Катушки индуктивности Трение скольжения. Трение качения
Трение скольжения. Трение качения Шекаралық қабат теңдеулерінің жуық шешімдері
Шекаралық қабат теңдеулерінің жуық шешімдері Радиоактивное излучение и использование ядерной энергии
Радиоактивное излучение и использование ядерной энергии Вечный двигатель
Вечный двигатель Урок физики Колебания, их виды и характеристики.
Урок физики Колебания, их виды и характеристики. Перископ
Перископ Биологическое действие радиации. Закон радиоактивного распада
Биологическое действие радиации. Закон радиоактивного распада История фрезерного станка
История фрезерного станка Подготовка к ЕГЭ по физике.
Подготовка к ЕГЭ по физике. Физические основы высоких технологий (часть 3)
Физические основы высоких технологий (часть 3) Ядерный магнитный резонанс
Ядерный магнитный резонанс Электрический ток. Условия, необходимые для существования электрического тока. Закон Ома
Электрический ток. Условия, необходимые для существования электрического тока. Закон Ома