Содержание
- 2. Сэр Джозеф Джон Томсон 1856-1940 Ноб. лаур. 1906 Модель атома Томсона (1903) Первую модель атома (Plum
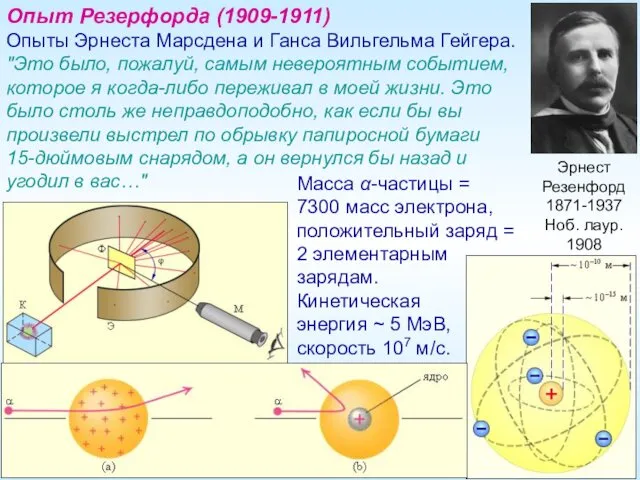
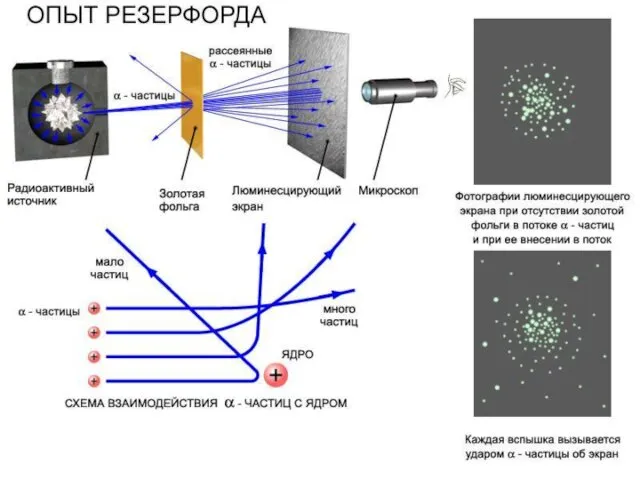
- 3. Эрнест Резенфорд 1871-1937 Ноб. лаур. 1908 Опыт Резерфорда (1909-1911) Опыты Эрнеста Марсдена и Ганса Вильгельма Гейгера.
- 5. Эрнест Резенфорд 1871-1937 Ноб. лаур. 1908 Модель атома Резерфорда (1911) Планетарная (ядерная) модель атома – положительный
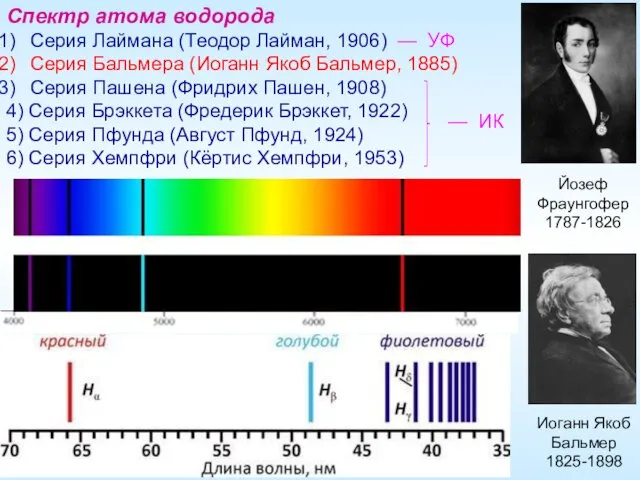
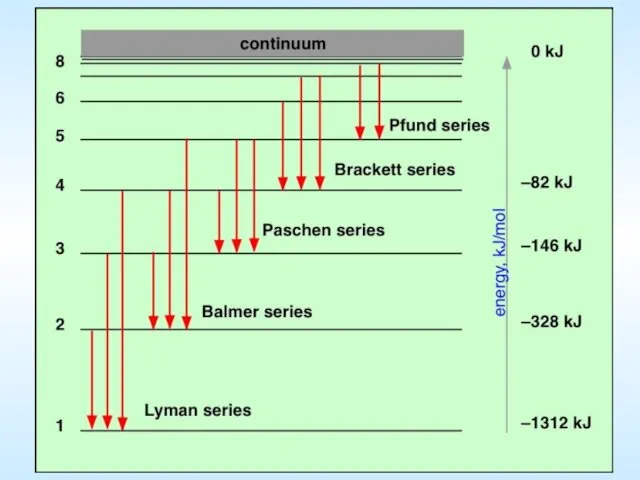
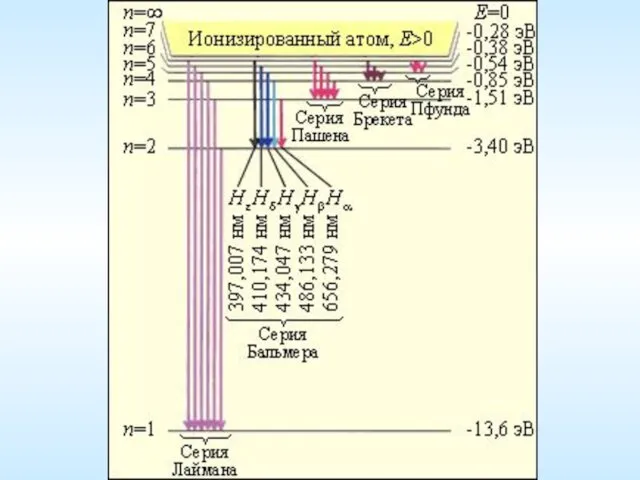
- 6. Иоганн Якоб Бальмер 1825-1898 Спектр атома водорода Серия Лаймана (Теодор Лайман, 1906) — УФ Серия Бальмера
- 7. Спектральные серии атома водорода Серия Лаймана Серия Бальмера Серия Пашена 4) Серия Брэккета 5) Серия Пфунда
- 8. Нильс Хенрик Давид Бор 1885-1962 Ноб. лаур. 1922 Постулаты Бора (1913) Построена для атома водорода или
- 9. Боровская теория водородо-подобного атома На электрон со стороны ядра действует притягивающая сила Кулона, которая создает центростремительное
- 10. Отрицательное значение энергии электрона в атоме показывает, что он находится в связанном состоянии, т.е. принадлежит данному
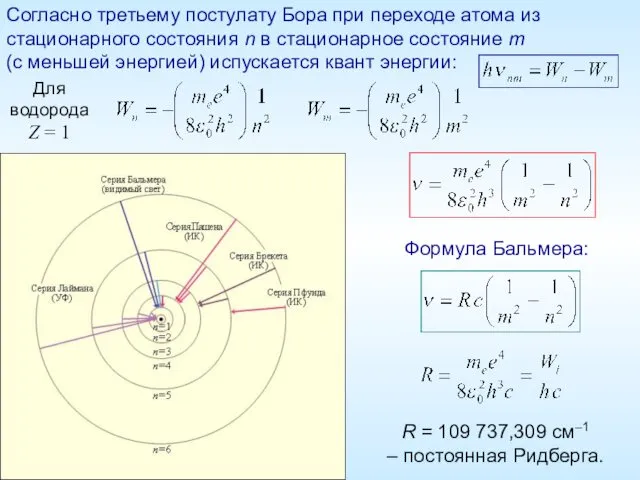
- 11. Согласно третьему постулату Бора при переходе атома из стационарного состояния n в стационарное состояние m (c
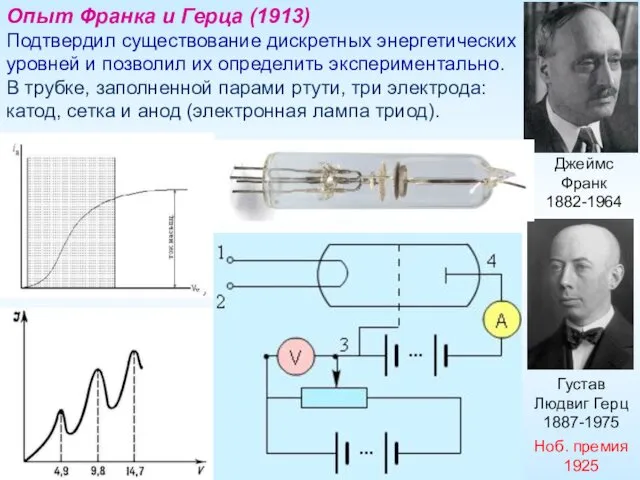
- 14. Джеймс Франк 1882-1964 Опыт Франка и Герца (1913) Подтвердил существование дискретных энергетических уровней и позволил их
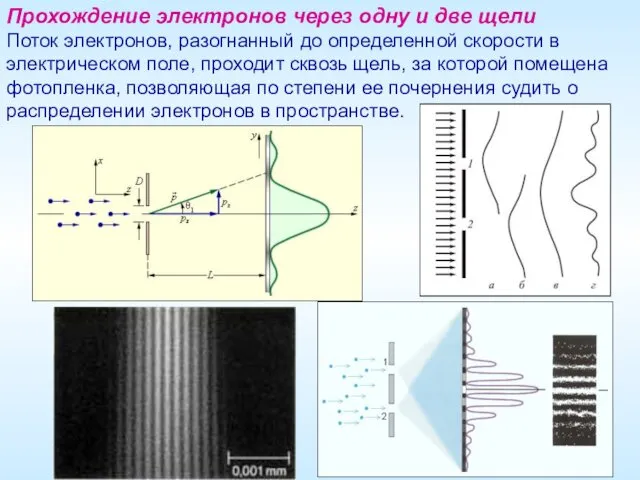
- 15. Прохождение электронов через одну и две щели Поток электронов, разогнанный до определенной скорости в электрическом поле,
- 16. Луис Виктор Пьер Раймон, 7-й герцог де Бройли 1892-1987 Ноб. лаур. 1929 Гипотеза Луи де Бройля
- 17. Клинтон Джозеф Дэвиссон 1881-1958 Ноб. лаур. 1937 Лестер Хэлберт Джермер 1896-1971 Опыт Дэвиссона и Джермера (1927)
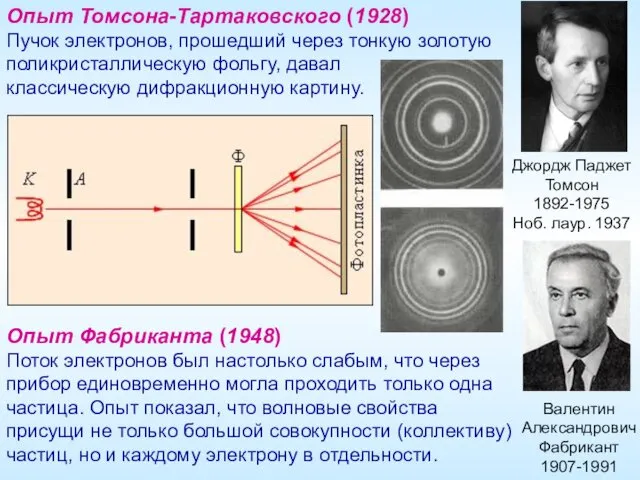
- 18. Опыт Томсона-Тартаковского (1928) Пучок электронов, прошедший через тонкую золотую поликристаллическую фольгу, давал классическую дифракционную картину. Джордж
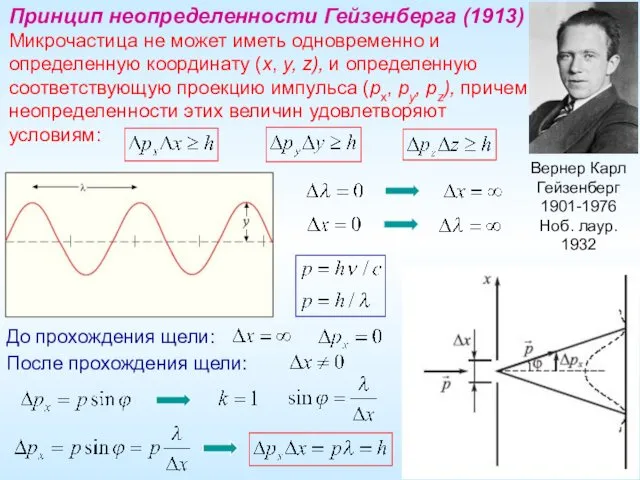
- 19. Вернер Карл Гейзенберг 1901-1976 Ноб. лаур. 1932 Принцип неопределенности Гейзенберга (1913) Микрочастица не может иметь одновременно
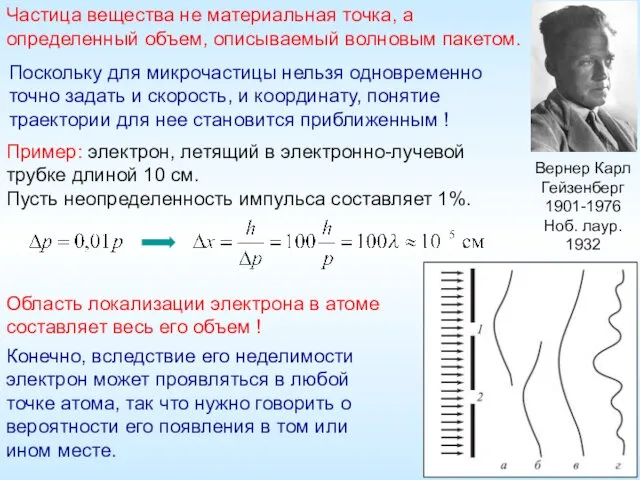
- 20. Вернер Карл Гейзенберг 1901-1976 Ноб. лаур. 1932 Поскольку для микрочастицы нельзя одновременно точно задать и скорость,
- 21. Вероятностный смысл волновой функции Квадрат модуля волновой функции имеет смысл плотности вероятности, т.е. определяет вероятность нахождения
- 22. Эрвин Рудольф Йозеф Александр Шрёдингер 1887-1961 Ноб. лаур. 1933 Уравнение Шредингера (1926) Если силовые поля на
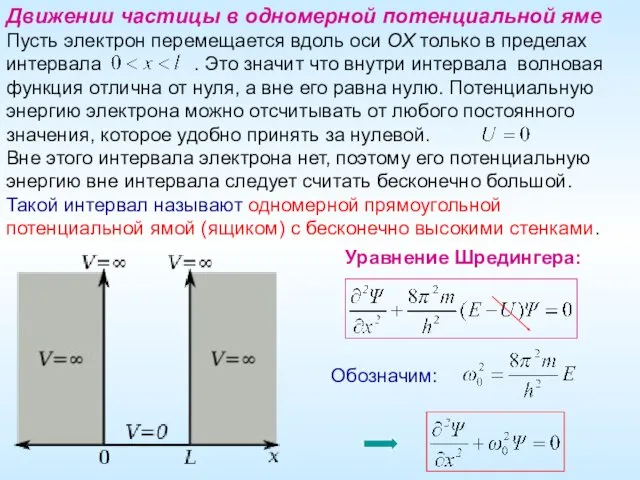
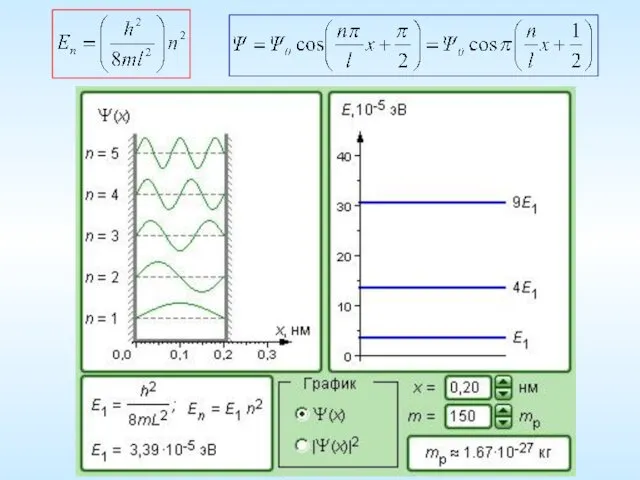
- 23. Движении частицы в одномерной потенциальной яме Пусть электрон перемещается вдоль оси ОХ только в пределах интервала
- 24. Решение уравнения – гармоническая функция по координате: Значения находятся из граничных условий: 1) При : 2)
- 27. Скачать презентацию











 Волновая оптика. Интерференция света
Волновая оптика. Интерференция света Магнитное поле в вакууме
Магнитное поле в вакууме Экспериментальные факты, лежащие в основе теории магнетизма
Экспериментальные факты, лежащие в основе теории магнетизма Техническое обучение по харвестерной головке Лог Макс 6000
Техническое обучение по харвестерной головке Лог Макс 6000 Плавление тел
Плавление тел Волновые свойства света: интерференция, дифракция
Волновые свойства света: интерференция, дифракция Машины для уборки и послеуборочной доработки картофеля. (Тема 13)
Машины для уборки и послеуборочной доработки картофеля. (Тема 13) Электромагнитные волны (ЭМВ)
Электромагнитные волны (ЭМВ) Микроскоп – знакомство, создание, опыты
Микроскоп – знакомство, создание, опыты Квантовая физика. Фотоэффект. Урок 29
Квантовая физика. Фотоэффект. Урок 29 Нахождение механической силы через силу и перемещение
Нахождение механической силы через силу и перемещение Кинематика твердого тела
Кинематика твердого тела Взаимозаменяемость шпоночных и шлицевых соединений
Взаимозаменяемость шпоночных и шлицевых соединений Методические рекомендации по организации экспериментальной работы на уроках физики и во внеурочное время
Методические рекомендации по организации экспериментальной работы на уроках физики и во внеурочное время использование энергии деления ядер
использование энергии деления ядер Ойын алаңы.Теориялық механика
Ойын алаңы.Теориялық механика Тема урока Последовательное соединение
Тема урока Последовательное соединение Электрические источники света. Светодиодные, люминесцентные и индукционные лампы, их достоинства и недостатки
Электрические источники света. Светодиодные, люминесцентные и индукционные лампы, их достоинства и недостатки Сравнение вариантов монтажных кранов
Сравнение вариантов монтажных кранов Дефектация деталей и ремонт типовых сборочных единиц ДСМ
Дефектация деталей и ремонт типовых сборочных единиц ДСМ Кинематика. Основные понятия. Траектория. Средняя и мгновенная скорости. Ускорение. Закон равноускоренного движения
Кинематика. Основные понятия. Траектория. Средняя и мгновенная скорости. Ускорение. Закон равноускоренного движения Наноматеріали
Наноматеріали Електромагнітна індукція
Електромагнітна індукція Планирование наземной экспериментальной отработки и летных испытаний космических аппаратов
Планирование наземной экспериментальной отработки и летных испытаний космических аппаратов Техническое обслуживание и текущий ремонт двигателя, системы охлаждения и смазки
Техническое обслуживание и текущий ремонт двигателя, системы охлаждения и смазки Көміртекті нанотүтікше
Көміртекті нанотүтікше Звуковые волны
Звуковые волны Гальваническое покрытие
Гальваническое покрытие