Содержание
- 2. «Основы физики ядерного реактора» ПЛАН лекции: Введение: цели, план, график курса Кратко: основы атомной и ядерной
- 3. Введение Задачи курса – изучить физические основы ядерных энергетических установок, причины и взаимосвязь физических процессов в
- 4. В основе ядерных физико-энергетических установок (и ядерных реакторов в том числе) лежат сложные физические процессы –
- 5. Введение Учебники и учебные пособия: А.Н.Климов - Ядерная физика и ядерные реакторы (издания 1984 года и
- 6. Введение (продолжение) История создания и развития ядерной индустрии связана с открытием и детальным изучением явления радиоактивности,
- 7. Атомизм - учение о гетерогенном (дискретном) строении вещества: мир состоит из мельчайших элементарных частиц . Начало
- 8. 1803 - Дж. Дальтон сформулировал закон кратных отношений («отношение масс двух простых веществ из сложного есть
- 9. Закон Авогадро: «в равных объемах любых газов при одних и тех же условиях (давление и температура)
- 10. 1860 г. - Четкие определения понятий атома и молекулы (С.Каниццаро – 1858) были приняты в на
- 11. 1869 г. – Дм.И.Менделеев – Периодический Закон Менделеева: Периодическая зависимость химических свойств элементов от их атомного
- 12. Конец XIX - начало ХХ века - Атомная физика - изучение строения и состояния атомов (!
- 13. Конец ХIХ века – открытие электрона- История: опыты с высоковольтными разрядами в стеклянной трубке. 1853 г.
- 14. Конец XIX - начало ХХ века - Атомная физика - 1897 г. - открытие электрона (термин:
- 15. Результаты: Минимальный заряд - е = 1,6 ∙ 10-19 Кл (заряд электрона). Масса электрона – 1/
- 16. Конец XIX - начало ХХ века - Атомная физика - В результате – первые модели атома:
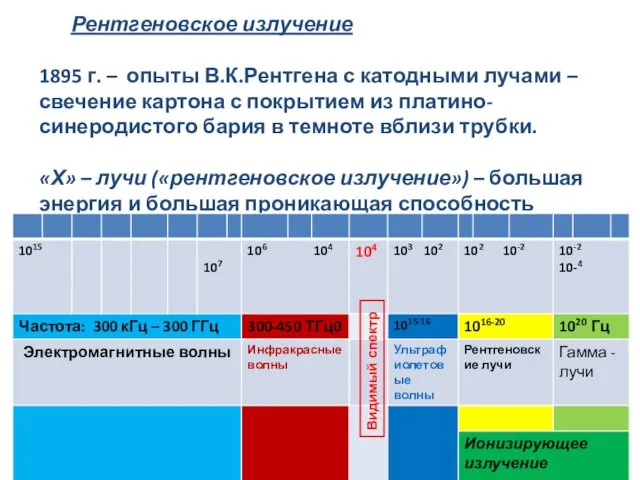
- 17. Рентгеновское излучение 1895 г. – опыты В.К.Рентгена с катодными лучами – свечение картона с покрытием из
- 18. Естественная радиоактивность 1896 г. – открытие радиоактивности (А. Беккерель) - урановая соль на закрытой фотопластинке 1903
- 19. Естественная радиоактивность Термин: «радиоактивность». Выводы: В природе есть нестабильные вещества, из атомов которых вылетают заряженные частицы
- 20. В результате – модель ядра и атома : 1911 г. – планетарная модель атома (Э.Резерфорд) –
- 21. Новый физический «инструмент» – альфа-частица – один из продуктов радиоактивного распада. Высокая скорость (~ 107 м/с),
- 22. Квантовая физика 1900 г. - создание квантовой теории излучения (М.Планк). 1913 г. - Нильс Бор –
- 23. Элементарные частицы: Особенности: – способность к взаимопревращениям (т.е. «кирпичики» мироздания - не неизменны). почти каждая элементарная
- 24. Элементарные частицы: Протон: 1913 г. – открытие протона (Э.Резерфорд) - N(14,7) + α(4, +2) = O(17,8)
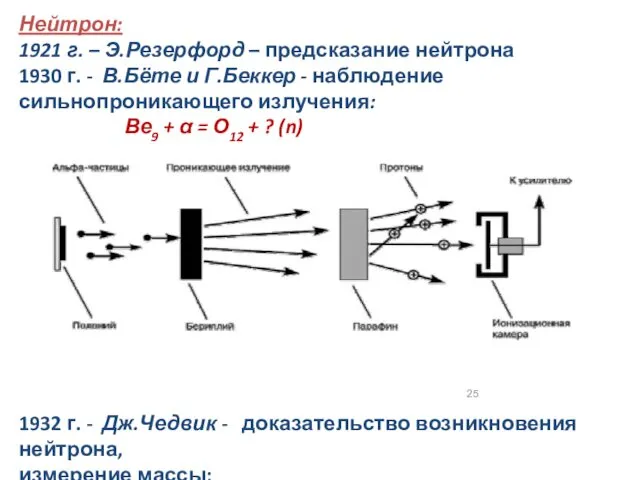
- 25. Нейтрон: 1921 г. – Э.Резерфорд – предсказание нейтрона 1930 г. - В.Бёте и Г.Беккер - наблюдение
- 26. 1933 г. – гипотеза о существовании антивещества (П.Дирак) 1934 г. – экспериментальное доказательство аннигиляции электронов и
- 27. Нейтрино: 1930 г. - В.Паули - гипотеза о существовании нейтрино 1932 г. - Э.Ферми - название
- 28. Строение ядра: 1908 – 1911 гг. – Э.Резерфорд: анализ опытов Г.Гейгера по рассеянию альфа-частиц на тонких
- 29. Строение ядра: 1930 г. - обнаружено существование «ядерного» (или – «сильного») типа взаимодействия – «ядерные» силы
- 30. Квантовая теория ядра: 1900 г. – М.Планк – квантовая теория излучения, постоянная Планка (h = 6,626
- 32. Скачать презентацию



























 Resistors. Transistors. Diodes
Resistors. Transistors. Diodes Урок по теме: Функциональная зависимость
Урок по теме: Функциональная зависимость Турбомашиналардың паралель жұмыс істеуі бір
Турбомашиналардың паралель жұмыс істеуі бір Конструкционные материалы на основе легких металлов: сплавы бериллия
Конструкционные материалы на основе легких металлов: сплавы бериллия Второй закон Ньютона
Второй закон Ньютона Атомная энергия
Атомная энергия Интеллектуальные игры
Интеллектуальные игры Давление. Атмосфернео давление. Закон паскаля. Закон архимеда
Давление. Атмосфернео давление. Закон паскаля. Закон архимеда Фізичні та хімічні явища
Фізичні та хімічні явища Энергия и работа (лекция 6)
Энергия и работа (лекция 6) Реальные газы
Реальные газы урок по теме плотность вещества
урок по теме плотность вещества Физика – основа естествознания
Физика – основа естествознания Второй закон термодинамики. Обратимые и необратимые процессы. Энтропия
Второй закон термодинамики. Обратимые и необратимые процессы. Энтропия Вакуумдағы электр тогы жөніндегі оқу материалын тө мендегідей жүйелілікпен оқытқан қолайлы болар деп санаймыз
Вакуумдағы электр тогы жөніндегі оқу материалын тө мендегідей жүйелілікпен оқытқан қолайлы болар деп санаймыз Световые волны. Оптические явления
Световые волны. Оптические явления Мобильный телефон с точки зрения физики
Мобильный телефон с точки зрения физики ПРЕЗЕНТАЦИЯ К УРОКУ Свободное падение
ПРЕЗЕНТАЦИЯ К УРОКУ Свободное падение Изобретение радио А.С. Поповым
Изобретение радио А.С. Поповым Сила трения
Сила трения Концентраторные солнечные электростанции с системами слежения за солнцем
Концентраторные солнечные электростанции с системами слежения за солнцем Строение вещества. Молекулы
Строение вещества. Молекулы Презентация Звук
Презентация Звук Действие магнитного поля на проводник с током. Электродвигатель
Действие магнитного поля на проводник с током. Электродвигатель Энтропия
Энтропия Презентация Давление жидкостей и газов для 7 класса
Презентация Давление жидкостей и газов для 7 класса Презентация к уроку физики в 9 классе по теме: Линзы
Презентация к уроку физики в 9 классе по теме: Линзы Презентация Мирный атом или энергия будущего
Презентация Мирный атом или энергия будущего