Содержание
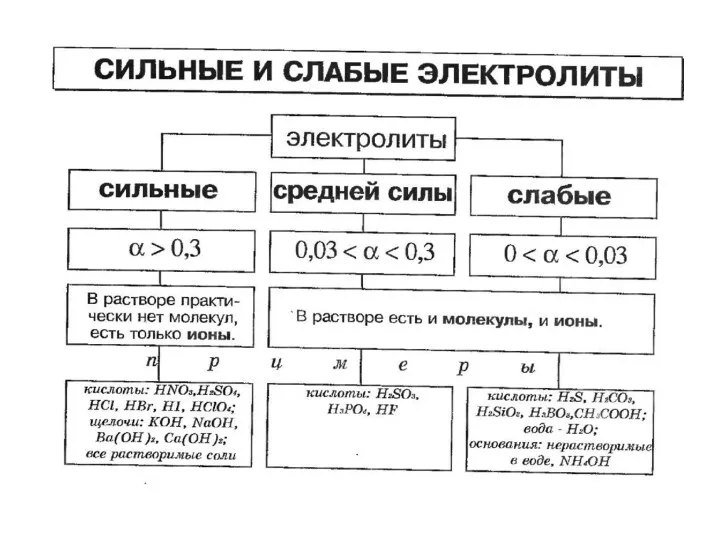
- 2. Электролиты Электроли́т — вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах
- 4. Электролитическая диссоциация Электролитическая диссоциация – это расщепление молекул электролита на положительные и отрицательные ионы под действием
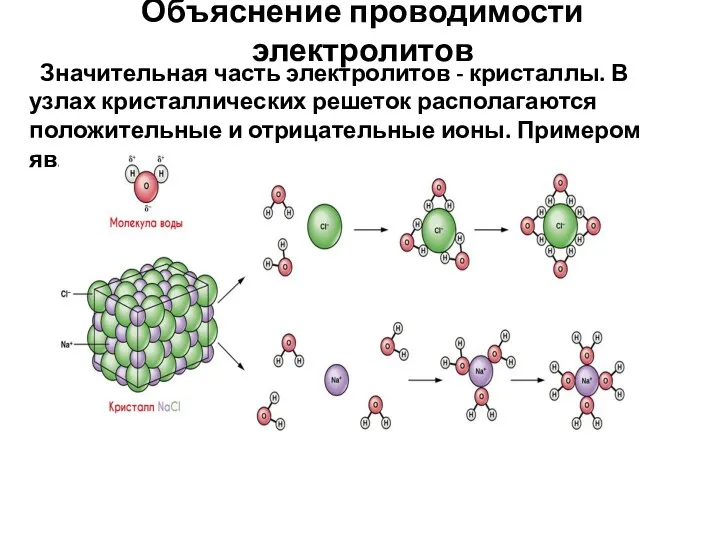
- 5. Объяснение проводимости электролитов Значительная часть электролитов - кристаллы. В узлах кристаллических решеток располагаются положительные и отрицательные
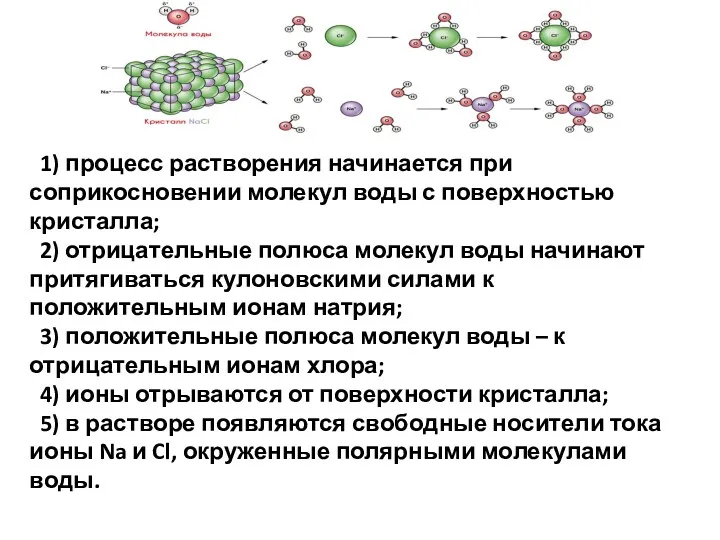
- 6. 1) процесс растворения начинается при соприкосновении молекул воды с поверхностью кристалла; 2) отрицательные полюса молекул воды
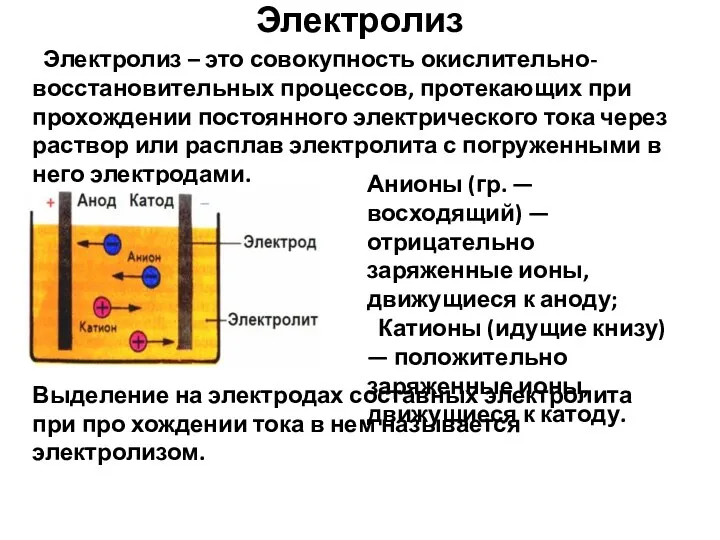
- 7. Электролиз Электролиз – это совокупность окислительно-восстановительных процессов, протекающих при прохождении постоянного электрического тока через раствор или
- 8. Зависимость сопротивления электролита от температуры Температурная зависимость сопротивления электролита объясняется в основном изменением удельного сопротивления. Где
- 9. Законы электролиза В 1833 г. М. Фарадей установил: Масса вещества, которое выделяется при прохож дении электрического
- 10. Электрохимический эквивалент вещества показывает, какая масса вещества в килограммах выделяется на электроде при прохождении тока, пере
- 11. Значение постоянной Фарадея F = 1,6 • 10-19 Кл • 6,023 • 1023 моль-1 = -9,65
- 12. Электрохимический эквивалент Коэффициент пропорциональности k называют электрохимическим эквивалентом вещества. Он различен для разных веществ. Например, для
- 13. Применение Электролиза Электрохимические процессы широко применяются в различных областях современной техники, в аналитической химии , биохимии
- 14. Гальванотехника – область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и
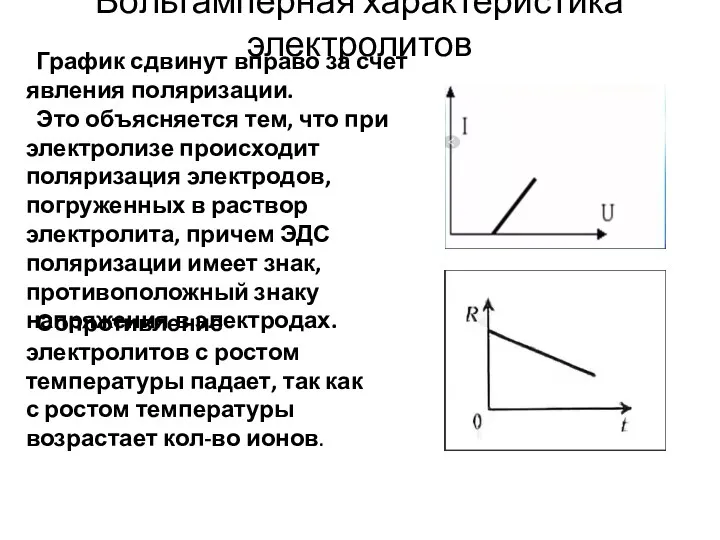
- 15. Вольтамперная характеристика электролитов График сдвинут вправо за счет явления поляризации. Это объясняется тем, что при электролизе
- 17. Скачать презентацию









 Зрительная (подзорная) труба
Зрительная (подзорная) труба Маломощные радиостанции КВ диапазона. Тактико-технические данные радиостанции Р-130М. (Тема 4.1)
Маломощные радиостанции КВ диапазона. Тактико-технические данные радиостанции Р-130М. (Тема 4.1) Спектроскопия электронного парамагнитного резонанса
Спектроскопия электронного парамагнитного резонанса Приборы измерения мощности
Приборы измерения мощности Масса тела. Единицы массы
Масса тела. Единицы массы Теоретические основы надёжности технологических систем в технике
Теоретические основы надёжности технологических систем в технике Юные знатоки физики
Юные знатоки физики ЖРД. Устройство и принцип действия, внутрикамерные процессы. (Лекция 2)
ЖРД. Устройство и принцип действия, внутрикамерные процессы. (Лекция 2) Физика в белом халате
Физика в белом халате Микроскоптың шығу тарихы
Микроскоптың шығу тарихы Повторительно - обобщающий урок по теме: Архимедова сила. Плавание. Воздухоплавание.
Повторительно - обобщающий урок по теме: Архимедова сила. Плавание. Воздухоплавание. Устройство плавного пуска асинхронных и синхронных двигателей среднего и высокого напряжения
Устройство плавного пуска асинхронных и синхронных двигателей среднего и высокого напряжения Трактори та мінітрактори, які використовуються у лісовому господарстві. Лекція 1. Частина 1
Трактори та мінітрактори, які використовуються у лісовому господарстві. Лекція 1. Частина 1 Физические поля и электромагнитные излучения
Физические поля и электромагнитные излучения Дипломный проект: Технологический процесс технического обслуживания и ремонта сцепления автомобиля
Дипломный проект: Технологический процесс технического обслуживания и ремонта сцепления автомобиля Магниторазведка. Магнетизм и магнетики
Магниторазведка. Магнетизм и магнетики Энергетические возможности ядерных реакторов различных типов
Энергетические возможности ядерных реакторов различных типов Ядерные реакции
Ядерные реакции Технология коллоидов и наносистем. Лекция 4. Физико-химические основы нуклеации и технологии формирования новой фазы
Технология коллоидов и наносистем. Лекция 4. Физико-химические основы нуклеации и технологии формирования новой фазы Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Карданный вал
Карданный вал Электризация тел при соприкосновении. Взаимодействие заряженных тел. Два рода электрических зарядов
Электризация тел при соприкосновении. Взаимодействие заряженных тел. Два рода электрических зарядов Силы в природе
Силы в природе открытый урок-презентация на тему История Российской атомной энергетики
открытый урок-презентация на тему История Российской атомной энергетики Ядерна енергетика в Україні
Ядерна енергетика в Україні Презентация к уроку физики в 8 классе на тему: Кипение
Презентация к уроку физики в 8 классе на тему: Кипение Возбуждение и распространение детонации конденсированных взрывчатых веществ
Возбуждение и распространение детонации конденсированных взрывчатых веществ ÐекÑÐ¸Ñ 3. ÐÐТÐÐÐ
ÐекÑÐ¸Ñ 3. ÐÐТÐÐÐ