Содержание
- 3. Электролиты – это … водные растворы солей, кислот, щелочей, а так же расплавы некоторых солей и
- 4. Носителями заряда в электролитах являются… положительные и отрицательные ионы. - +
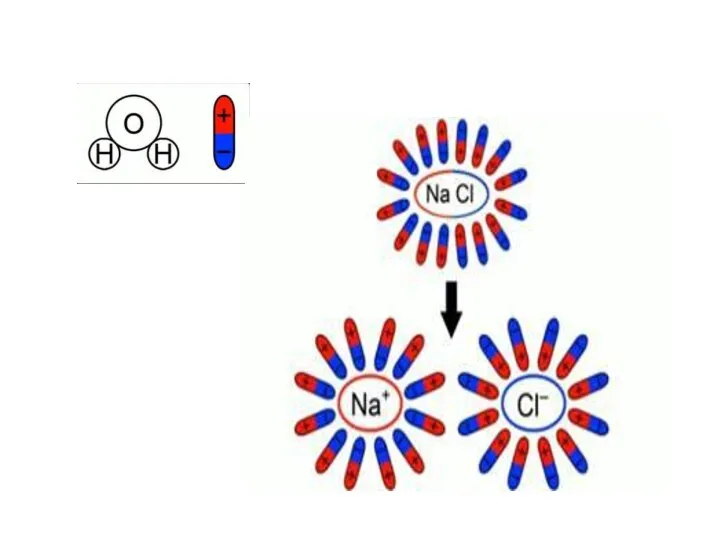
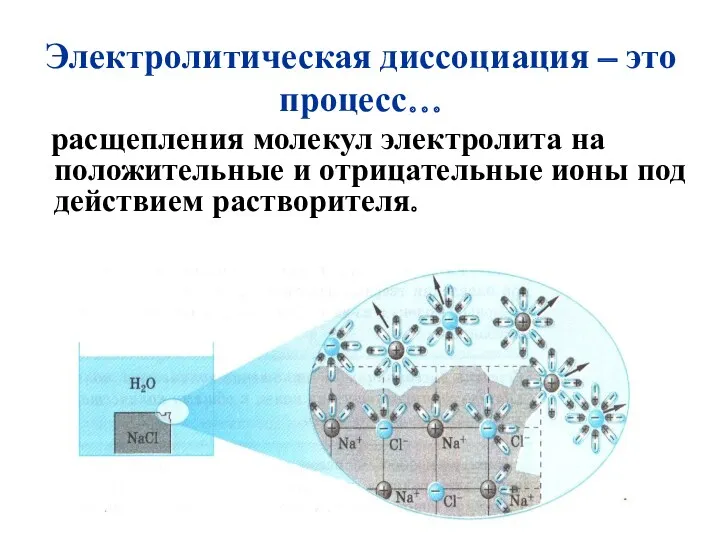
- 5. Электролитическая диссоциация – это процесс… расщепления молекул электролита на положительные и отрицательные ионы под действием растворителя.
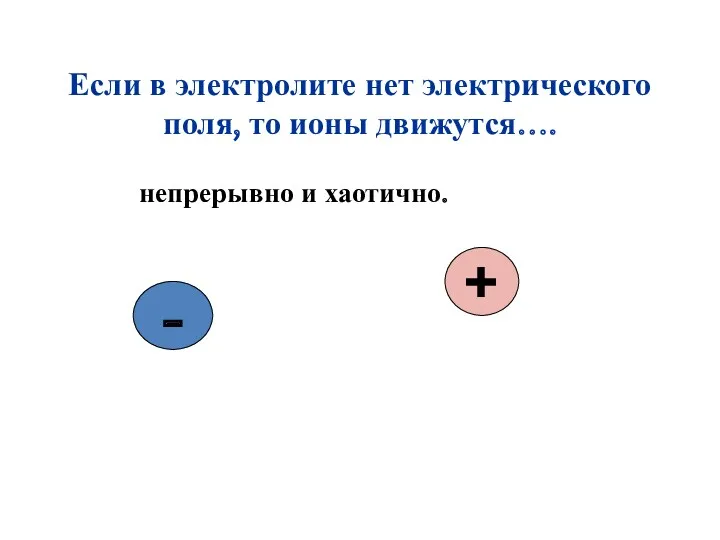
- 6. Если в электролите нет электрического поля, то ионы движутся…. непрерывно и хаотично. - +
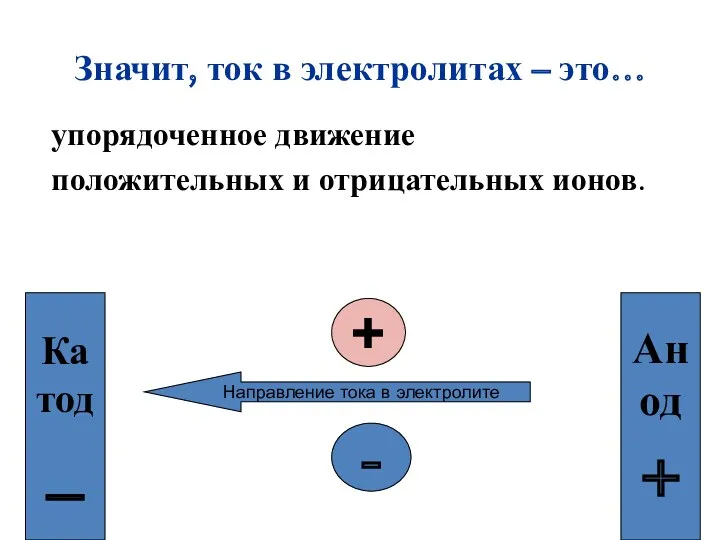
- 7. Значит, ток в электролитах – это… упорядоченное движение положительных и отрицательных ионов. + - Катод _
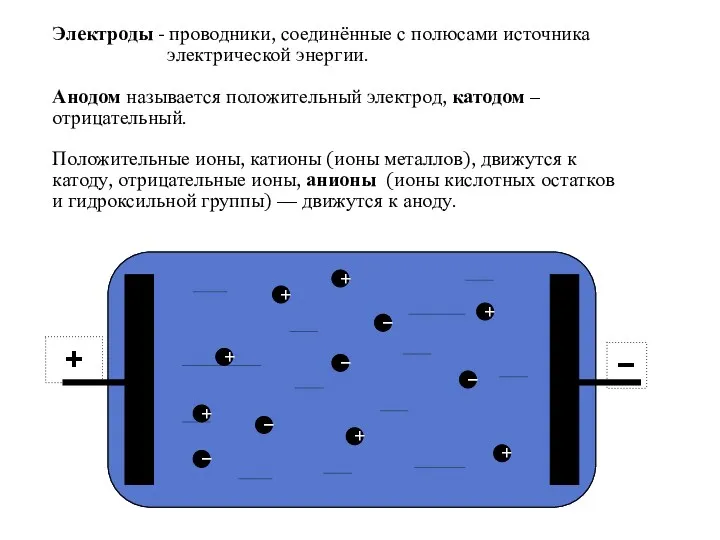
- 8. Электроды - проводники, соединённые с полюсами источника электрической энергии. Анодом называется положительный электрод, катодом – отрицательный.
- 9. Электролиз – это явление… выделения на электродах веществ, входящих в состав электролита, при протекании через него
- 10. Закон Фарадея для электролиза Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду q, прошедшему через
- 11. Второй закон Фарадея М – молярная масса электролита (М=А*10-3кг/моль, атомная масса) е – элементарный заряд n
- 12. Применение электролиза
- 13. С электропроводностью растворов солей в воде (электролитов) связано очень многое в нашей жизни. С первого удара
- 14. Явление электролиза широко применяется в современном промышленном производстве. получение неорганических веществ (водорода, кислорода, хлора, щелочей и
- 15. обработка поверхностей металлов (азотирование, борирование, электрополировка,очистка) получение гальванических покрытий Часто стальной кузов автомобиля покрывают снизу тонким
- 16. Гальванотехника область прикладной химии, охватывающая процессы электролитического осаждения металлов на поверхность металлических и неметаллических изделий. Гальванотехника
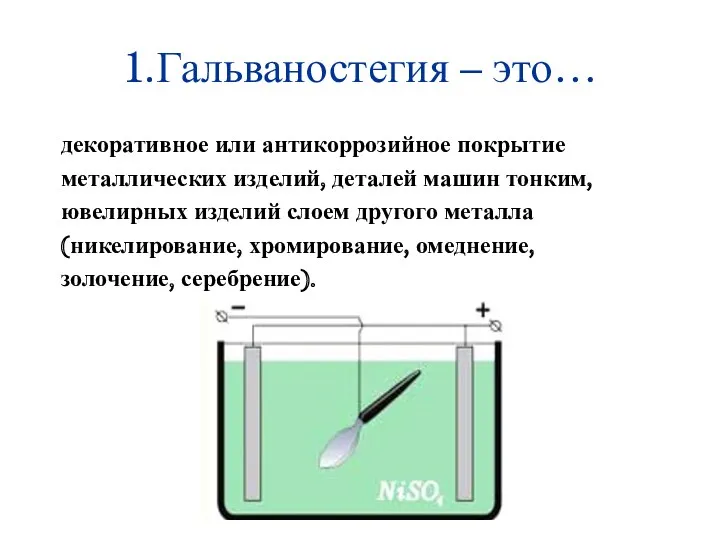
- 17. 1.Гальваностегия – это… декоративное или антикоррозийное покрытие металлических изделий, деталей машин тонким, ювелирных изделий слоем другого
- 18. 2.Гальванопластика – это… электролитическое изготовление металлических копий, рельефных предметов.
- 19. Одно из первых применений гальванопластики — создание декоративной скульптуры. Техникой гальванопластики в 30—40-х гг. XIX в.
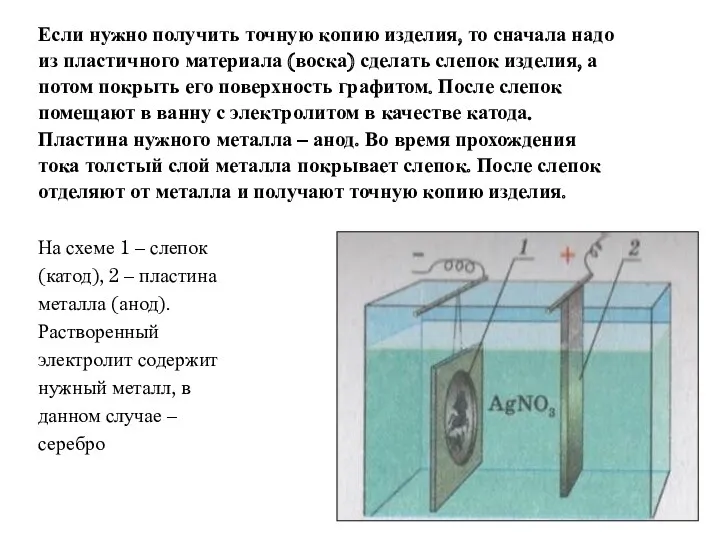
- 20. На схеме 1 – слепок (катод), 2 – пластина металла (анод). Растворенный электролит содержит нужный металл,
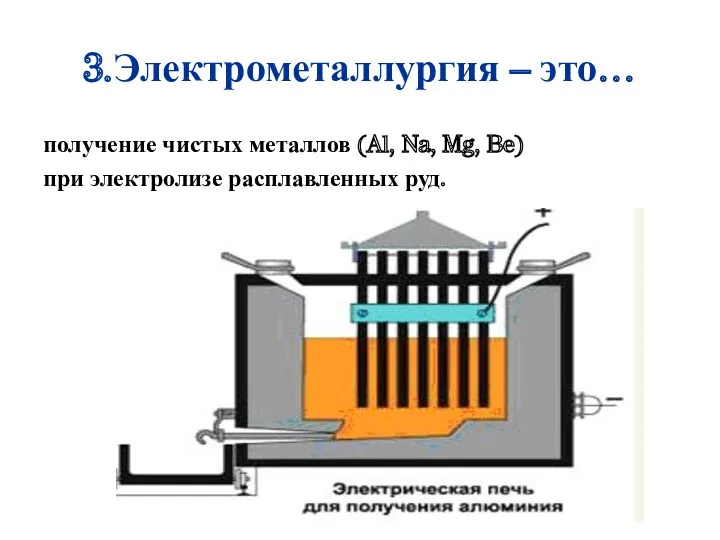
- 21. 3.Электрометаллургия – это… получение чистых металлов (Al, Na, Mg, Be) при электролизе расплавленных руд.
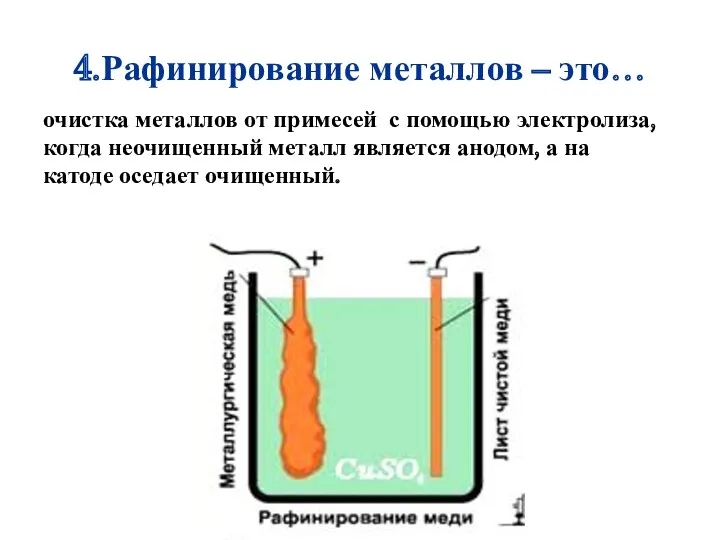
- 22. 4.Рафинирование металлов – это… очистка металлов от примесей с помощью электролиза, когда неочищенный металл является анодом,
- 24. Скачать презентацию












 Сварочные тележки
Сварочные тележки Учебно-методическое пособие Тесты по физике 11 класс
Учебно-методическое пособие Тесты по физике 11 класс Кипение. Влажность воздуха. Способы определения влажности воздуха
Кипение. Влажность воздуха. Способы определения влажности воздуха Простой механизм. Двигатель
Простой механизм. Двигатель Качество электроэнергии
Качество электроэнергии Тербелістер мен толқындар
Тербелістер мен толқындар Урок по физике 8 класс. Обобщение материала по теме: Изменения агрегатных состояний вещества
Урок по физике 8 класс. Обобщение материала по теме: Изменения агрегатных состояний вещества Условные графические обозначения на принципиальных электрических схемах
Условные графические обозначения на принципиальных электрических схемах Рост наноструктур и микроскопия. Методы выращивания наноструктур
Рост наноструктур и микроскопия. Методы выращивания наноструктур презентация Виды теплообмена
презентация Виды теплообмена Электрическая проводимость металлов
Электрическая проводимость металлов Робот-исследователь, способный измерять некоторые физические факторы среды
Робот-исследователь, способный измерять некоторые физические факторы среды Типы приводов
Типы приводов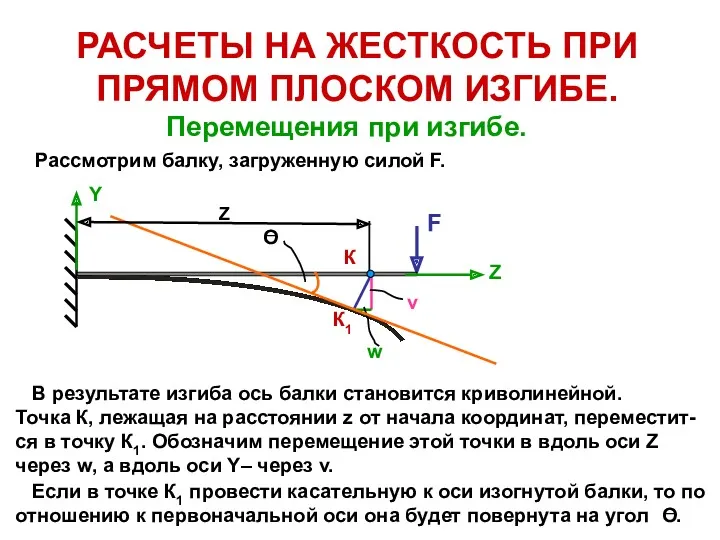 Расчеты на жесткость при прямом плоском изгибе. Перемещения при изгибе
Расчеты на жесткость при прямом плоском изгибе. Перемещения при изгибе Гидростатическое давление. Билет 20. Получение формулы для расчета давления жидкости
Гидростатическое давление. Билет 20. Получение формулы для расчета давления жидкости Моделирование электрофизических свойств gaas методом монте-карло
Моделирование электрофизических свойств gaas методом монте-карло Урок узагальнення та систематизації знань з теми Теплові явища. Розв’язування задач. 8 клас
Урок узагальнення та систематизації знань з теми Теплові явища. Розв’язування задач. 8 клас Основные законы электростатики
Основные законы электростатики Физический диктант (Ядерная физика 9 класс)
Физический диктант (Ядерная физика 9 класс) Использование комплекта Я сдам ЕГЭ для подготовки к экзамену по физике
Использование комплекта Я сдам ЕГЭ для подготовки к экзамену по физике Презентация к уроку в 7 классе по теме Масса тела.Измерение массы тела с помощью весов
Презентация к уроку в 7 классе по теме Масса тела.Измерение массы тела с помощью весов Явление диффузии в жидкостях
Явление диффузии в жидкостях Тұрақты электр тоғы
Тұрақты электр тоғы Исполнительные механизмы и регулирующие органы
Исполнительные механизмы и регулирующие органы Тиск. Результат тиску твердого тіла
Тиск. Результат тиску твердого тіла Топологические изоляторы и смежные вопросы
Топологические изоляторы и смежные вопросы Синтез нанокомпозитных материалов на основе субоксида кремния и наноструктур благородных металлов
Синтез нанокомпозитных материалов на основе субоксида кремния и наноструктур благородных металлов Эксперимент. Что такое эксперимент?
Эксперимент. Что такое эксперимент?