Содержание
- 2. A.J. Bard, L.R. Faulkner “Electrochemical Methods: Fundamentals and Applications” J. Wang “Analytical Electrochemistry” C. Gabrielli “Identification
- 3. Electroanalysis: widest dynamic range (down to a single molecule detection) less sensitive to matrix effects (insensitive
- 4. Электрохимия Химия посредством электричества Электричество посредством химии
- 5. Дополнительная степень свободы Химия хим. состав, температура, давление Электрохимия хим. состав, температура, давление + электричество
- 6. Первый закон термодинамики в химии (изобарно-изотермический потенциал) ∆U = Q – A A = p∆ V
- 7. Первый закон термодинамики в электрохимии (изобарно-изотермический потенциал) ∆U = Q – A A = p∆ V+q∆E
- 8. Ток – кинетический параметр
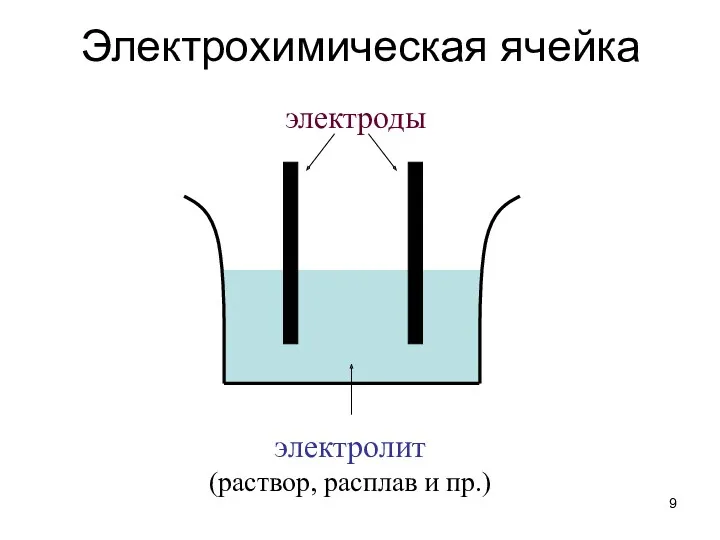
- 9. Электрохимическая ячейка электроды электролит (раствор, расплав и пр.)
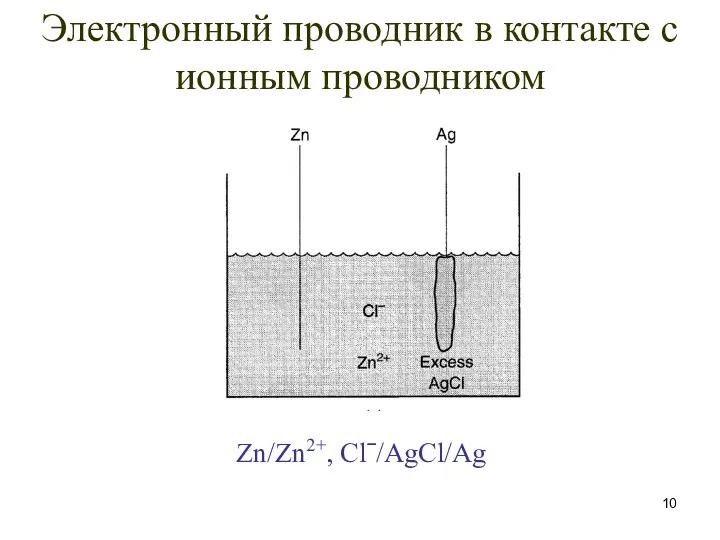
- 10. Zn/Zn2+, Сlˉ/AgCl/Ag Электронный проводник в контакте с ионным проводником
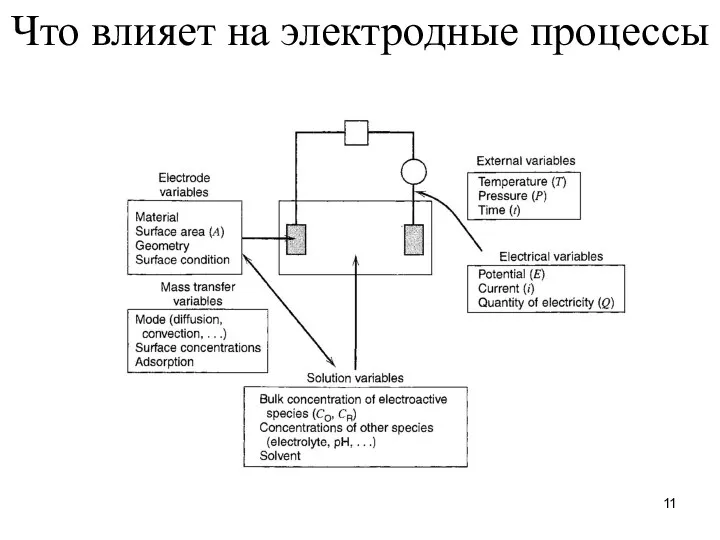
- 11. Что влияет на электродные процессы
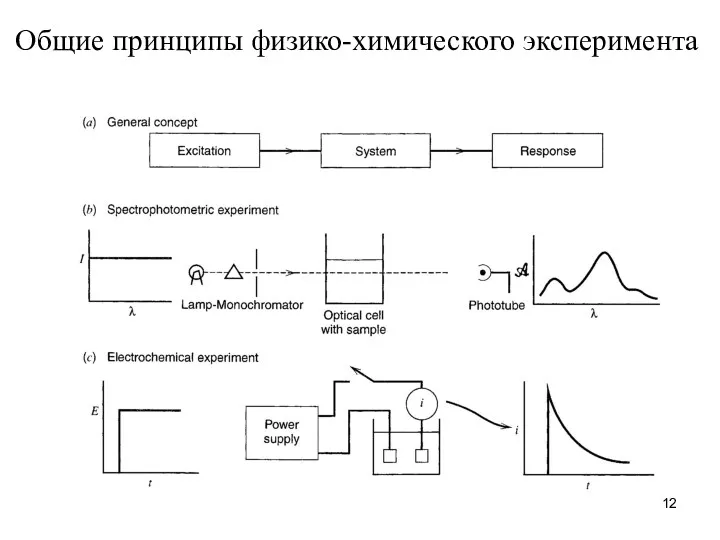
- 12. Общие принципы физико-химического эксперимента
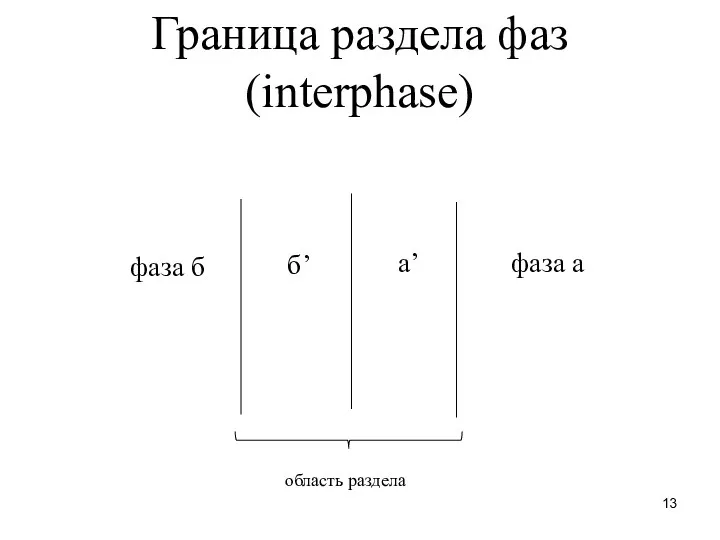
- 13. Граница раздела фаз (interphase) фаза а фаза б а’ б’ область раздела
- 14. Определения Поляризация –смещение потенциала относительно его равновесного (стационарного) значения под действием тока. Катод – электрод с
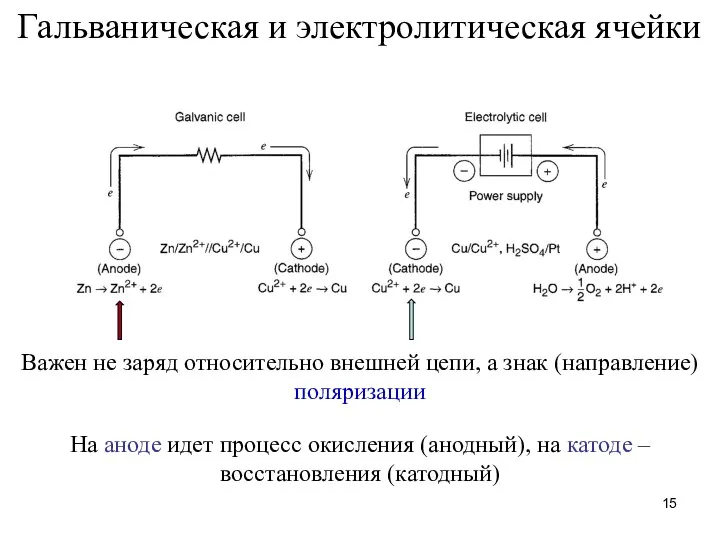
- 15. Гальваническая и электролитическая ячейки Важен не заряд относительно внешней цепи, а знак (направление) поляризации На аноде
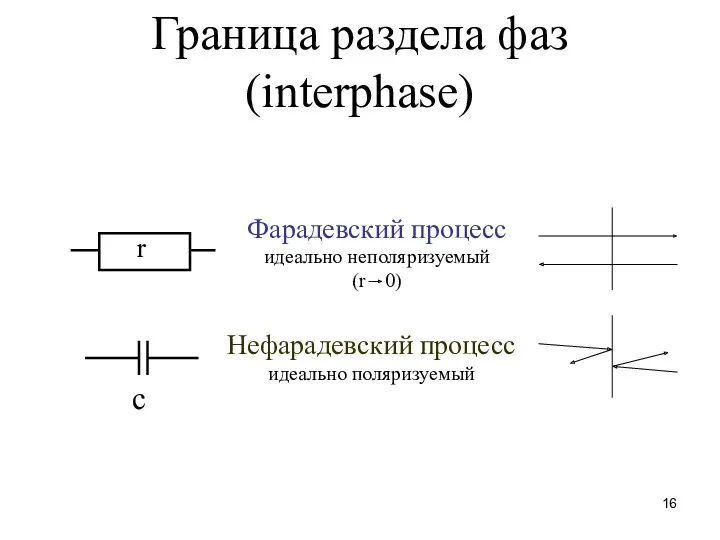
- 16. Граница раздела фаз (interphase) Нефарадевский процесс идеально поляризуемый
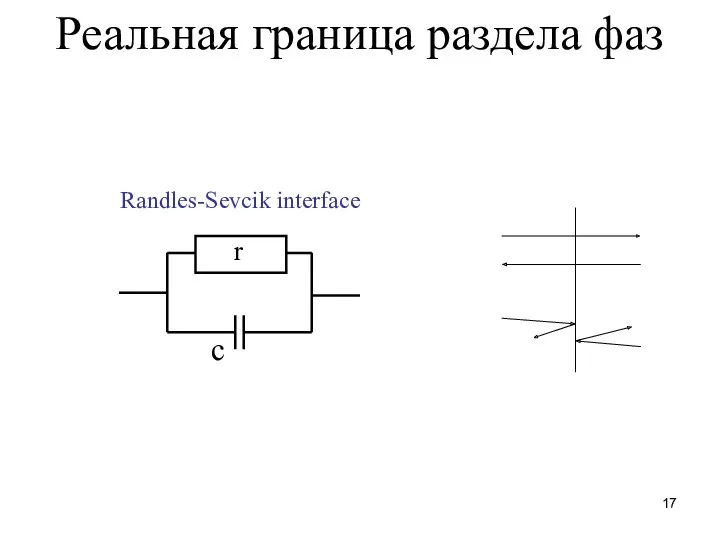
- 17. Реальная граница раздела фаз Randles-Sevcik interface
- 18. Электрохимическая термодинамика
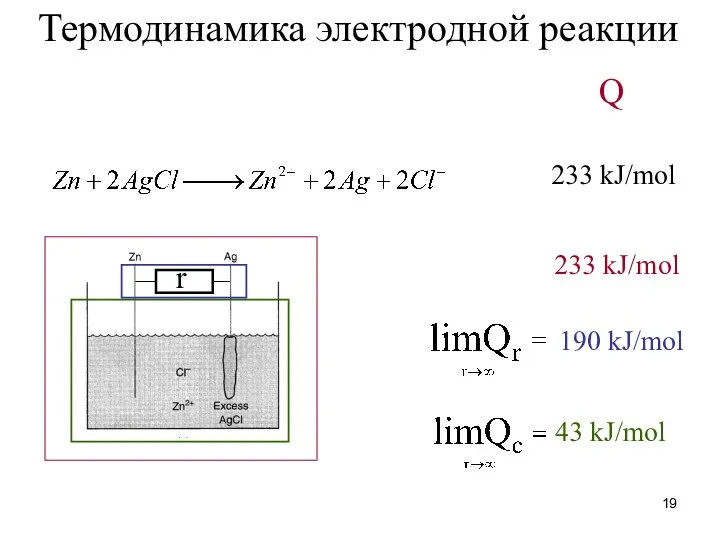
- 19. Термодинамика электродной реакции Q 233 kJ/mol 233 kJ/mol
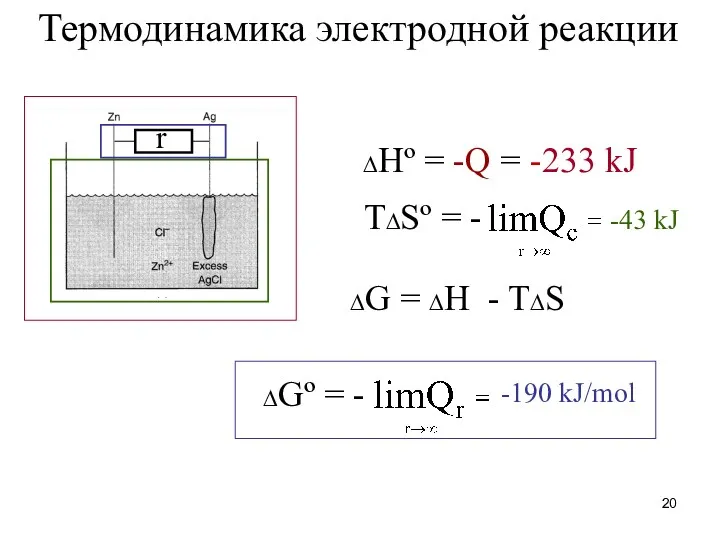
- 20. Термодинамика электродной реакции r ∆Hº = -Q = -233 kJ ∆G = ∆H - T∆S
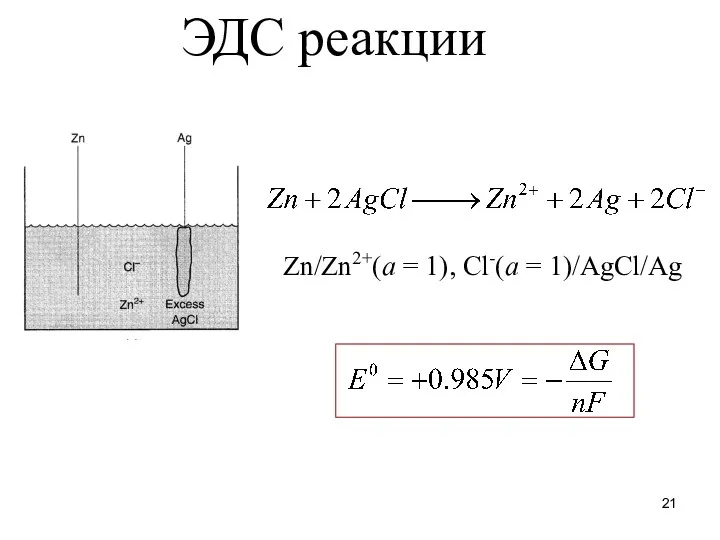
- 21. ЭДС реакции Zn/Zn2+(a = 1), Cl-(a = 1)/AgCl/Ag
- 22. Полуреакции и восстановительные потенциалы Pt/H+(a = 1)/H2(a = 1) NHE Ag+(a = 1)/Ag 0.779 V vs
- 23. ЭДС и концентрация Nernst уравнение для потенциала электрода
- 24. Формальные потенциалы
- 25. Измерение потенциала Zn/Zn2+, Сlˉ/AgCl/Ag
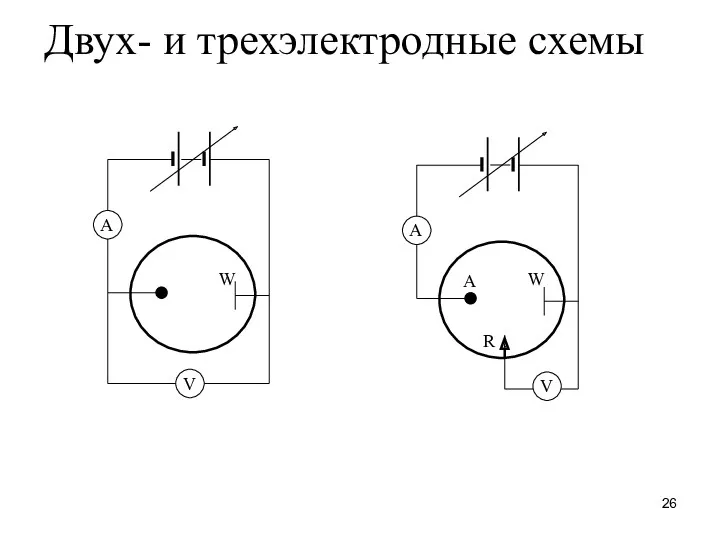
- 26. Двух- и трехэлектродные схемы
- 27. Электрохимический потенциал для незаряженных частиц для равновесия между фазами α и β
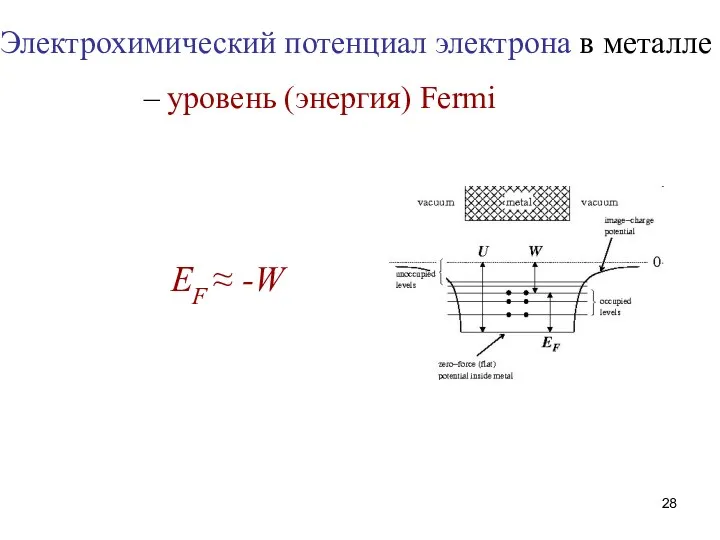
- 28. Электрохимический потенциал электрона в металле – уровень (энергия) Fermi EF ≈ -W
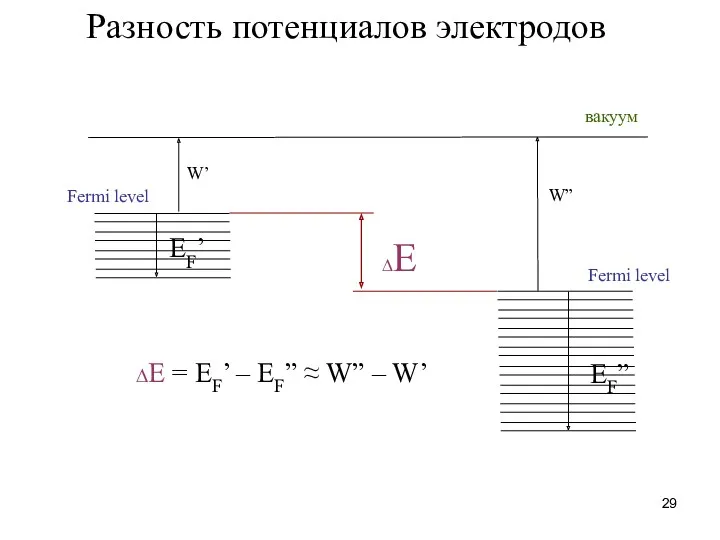
- 29. Разность потенциалов электродов ∆E Fermi level Fermi level вакуум W’ W” EF’ EF” ∆E = EF’
- 30. Абсолютная шкала потенциалов
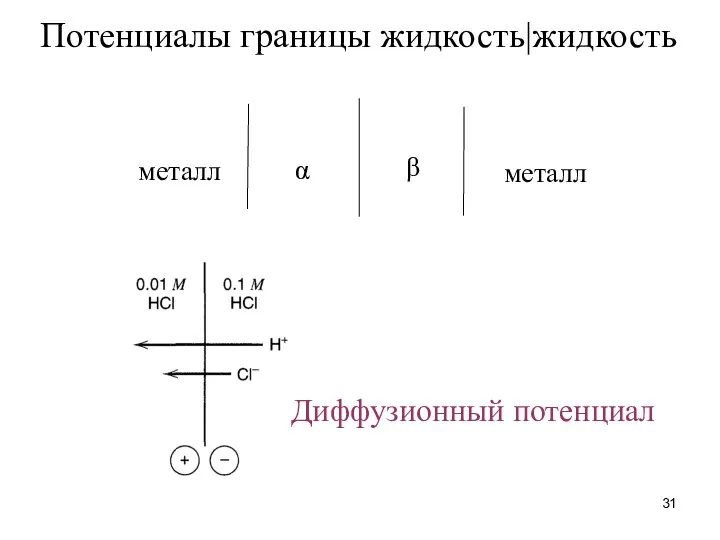
- 31. металл металл β α Потенциалы границы жидкость|жидкость Диффузионный потенциал
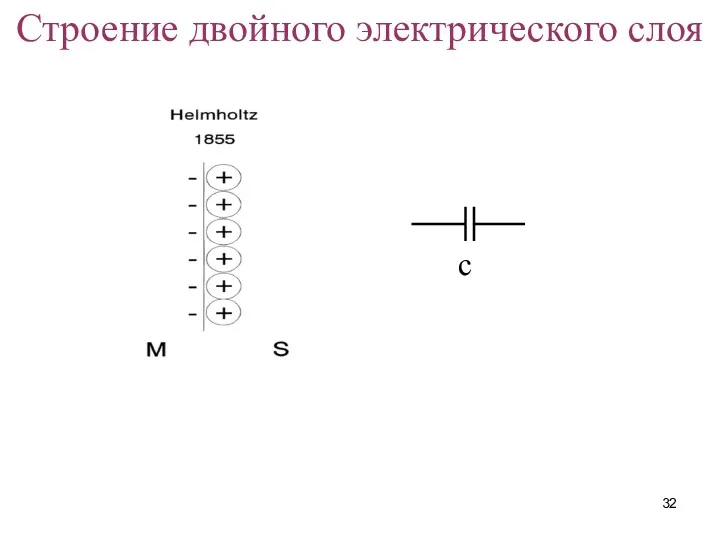
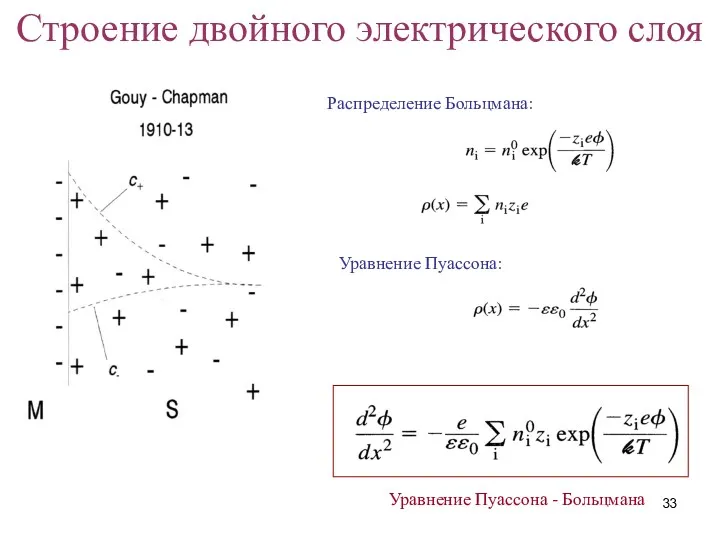
- 32. Строение двойного электрического слоя
- 33. Распределение Больцмана: Уравнение Пуассона: Уравнение Пуассона - Больцмана Строение двойного электрического слоя
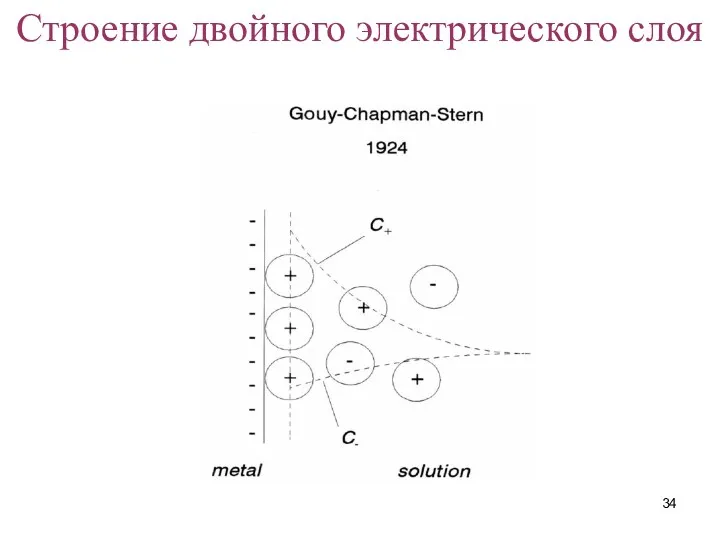
- 34. Строение двойного электрического слоя
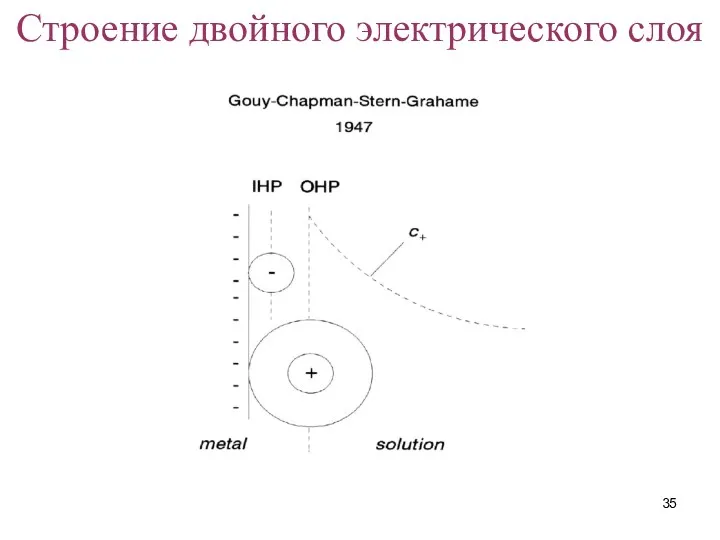
- 35. Строение двойного электрического слоя
- 36. Электрохимическая кинетика
- 37. Электрохимические методы:
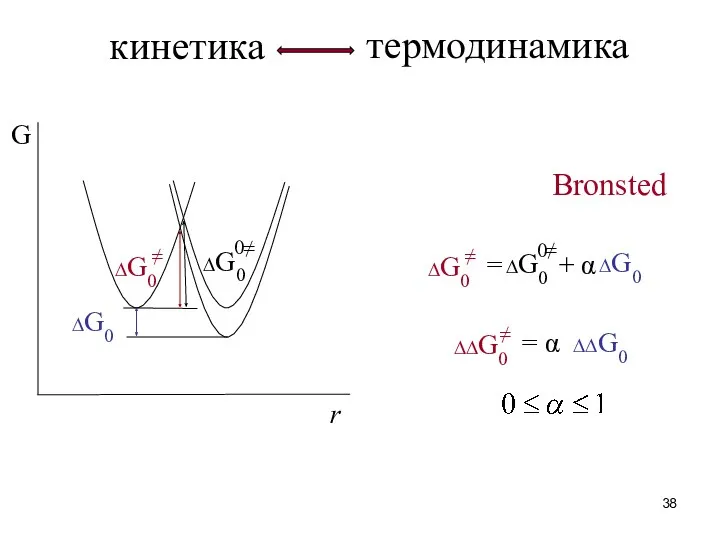
- 38. кинетика термодинамика ∆G0 ∆G0 ≠ Bronsted
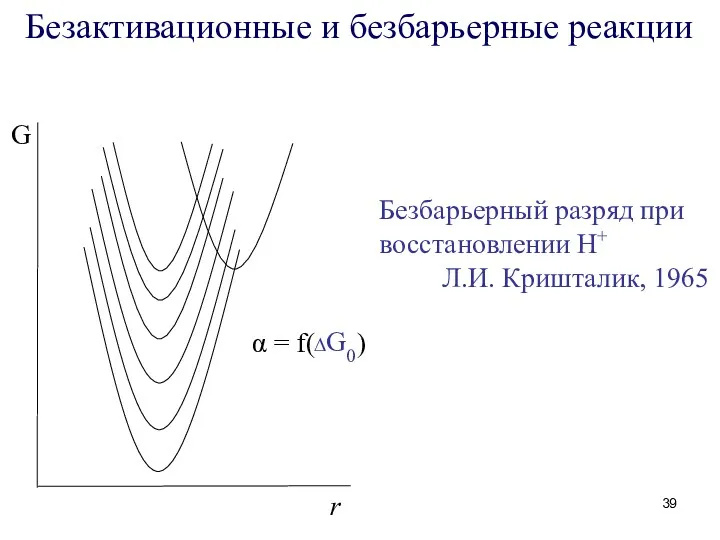
- 39. r G Безактивационные и безбарьерные реакции Безбарьерный разряд при восстановлении Н+ Л.И. Кришталик, 1965 α =
- 40. кинетика термодинамика ∆G0 = -nF(E-E0)
- 41. Электрохимическая обратимость
- 42. Уравнение разряда для обратимой реакции Butler-Volmer
- 43. Равновесие. Ток обмена. Равновесие:
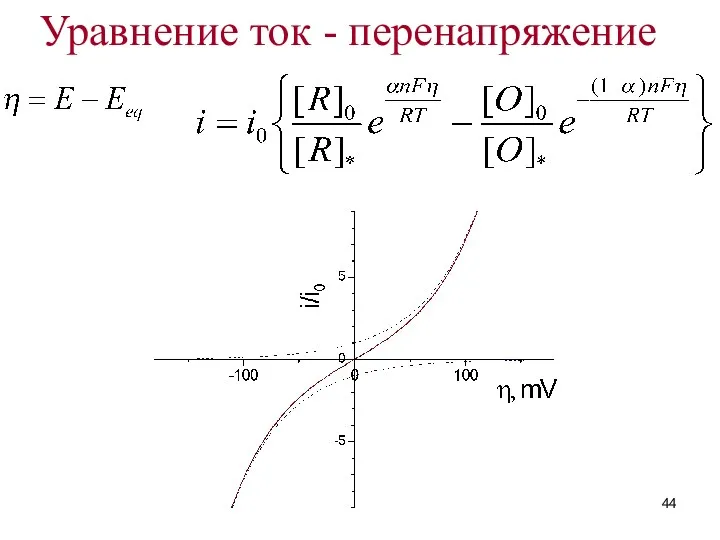
- 44. Уравнение ток - перенапряжение
- 45. Предельные случаи а) отсутствие влияния массопереноса а1) малые перенапряжения Butler-Volmer а2) большие перенапряжения RT/F ≈ 25
- 47. Скачать презентацию






















 Понятие методологической культуры педагога
Понятие методологической культуры педагога Урок 11.15. Трансформаторы
Урок 11.15. Трансформаторы Физика в баскетболе
Физика в баскетболе Тележка электровоза ВЛ80р
Тележка электровоза ВЛ80р Виды лазеров
Виды лазеров Разнообразие форм домашней работы учащихся по физике
Разнообразие форм домашней работы учащихся по физике Кинематика. Виды движения
Кинематика. Виды движения Машины для уборки и послеуборочной доработки картофеля. (Тема 13)
Машины для уборки и послеуборочной доработки картофеля. (Тема 13) Количество теплоты. 8 класс
Количество теплоты. 8 класс Другий закон термодинамiки
Другий закон термодинамiки Возникновение атомистической гипотезы строения вещества и ее экспериментальные доказательства. Идеальный газ
Возникновение атомистической гипотезы строения вещества и ее экспериментальные доказательства. Идеальный газ Metal-Insulator-Semiconductor and Metal-Insulator-Metal Structures. Heterogeneous Structures. Diodes
Metal-Insulator-Semiconductor and Metal-Insulator-Metal Structures. Heterogeneous Structures. Diodes Аккумуляторная батарея
Аккумуляторная батарея Электромагнитная индукция. 11 класс
Электромагнитная индукция. 11 класс 8 класс физика презентация по теме Виды теплопередачи
8 класс физика презентация по теме Виды теплопередачи Электромагнитные колебания
Электромагнитные колебания Кинематика. Методика организации и проведения обобщающего повторения
Кинематика. Методика организации и проведения обобщающего повторения Устный журнал. Страницы открытий. (к неделе физики)
Устный журнал. Страницы открытий. (к неделе физики) Отношение сигнал-шум на выходе приёмника ЧМ сигнала
Отношение сигнал-шум на выходе приёмника ЧМ сигнала презентация энергия электрического поля
презентация энергия электрического поля Постоянный электрический ток
Постоянный электрический ток Курение с точки зрения физики
Курение с точки зрения физики Викторина физика и живопись
Викторина физика и живопись Презентация Параллельное и последовательное соединение
Презентация Параллельное и последовательное соединение Начало космической эры и роль ученых нашей страны в изучении вселенной
Начало космической эры и роль ученых нашей страны в изучении вселенной Альтернативные виды топлива
Альтернативные виды топлива Основи молекулярно-кінетичної теорії газів
Основи молекулярно-кінетичної теорії газів Кинематика зубчатых механизмов
Кинематика зубчатых механизмов