Содержание
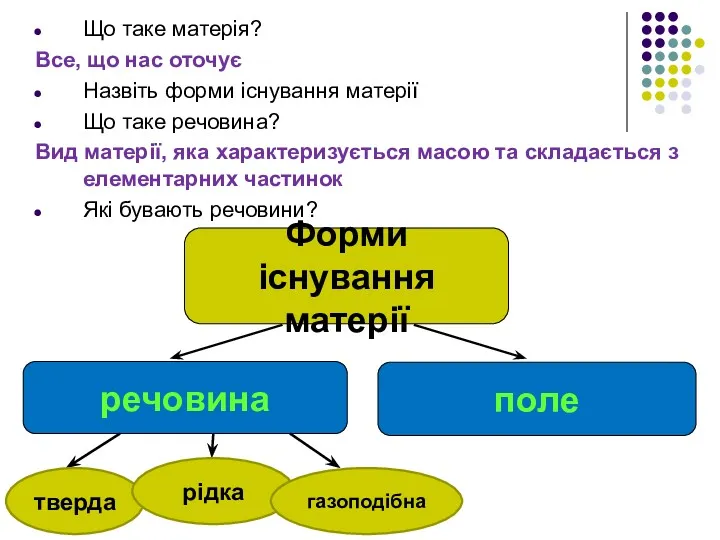
- 2. Що таке матерія? Все, що нас оточує Назвіть форми існування матерії Що таке речовина? Вид матерії,
- 3. Встановити відповідність: 1. Молекули рухаються з величезними швидкостями. 2. Тіла зберігають форму і об'єм. 3. Атоми
- 4. План лекції 1. Основні положення молекулярно-кінетичної теорії та їх дослідне обґрунтування. 2. Маса і розміри молекул.
- 5. «Мислячий розум не відчуває себе щасливим, поки йому не вдасться зв'язати воєдино розрізнені факти, їм спостережувані».
- 6. «Все складається з частинок ... речі відрізняються один від одного частинками, з яких складаються, їх порядком
- 7. Молекулярно-кінетична теорія сформувалася наприкінці дев'ятнадцятого століття Джон Дальтон ввів поняття хімічного елемента (1804) Джозеф Лошмідт розрахував
- 8. Молекулярна фізика — це розділ фізики, який розглядає властивості тіл як сумарний результат руху та взаємодії
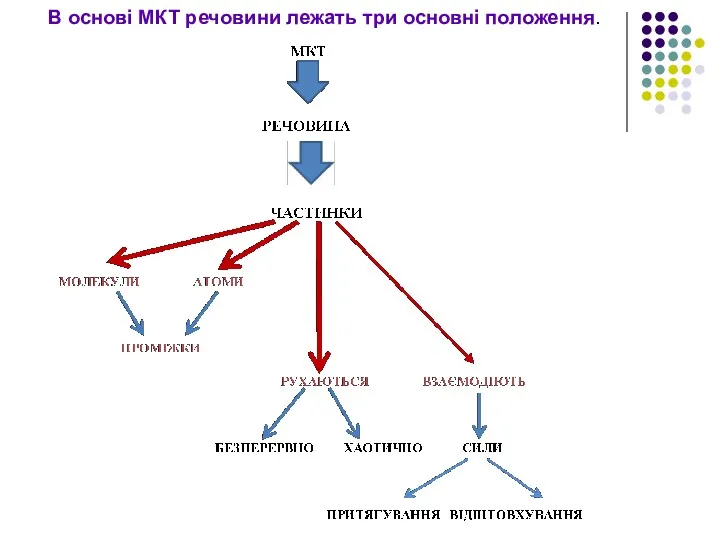
- 9. В основі МКТ речовини лежать три основні положення.
- 10. 1. Будь-яка речовина складається з найдрібніших частинок — молекул чи атомів. Всі речовини складаються з молекул,
- 11. нікель платина вуглець золото Зображення атомів
- 12. Дослід № 1 1. У прозору склянку насипаємо горох і вважаємо, що це атоми молекул На
- 13. 2. Щоб довести існування проміжків між молекулами і атомами досипаємо у ту ж склянку невелику кількість
- 14. 3.Крупа заповнює існуючі проміжки між горошинами, тим самим наочно демонструє наявність проміжків між атомами і молекулами.
- 15. 2. Молекули весь час рухаються… Атоми і молекули перебувають у безперервному хаотичному (тепловому) русі.
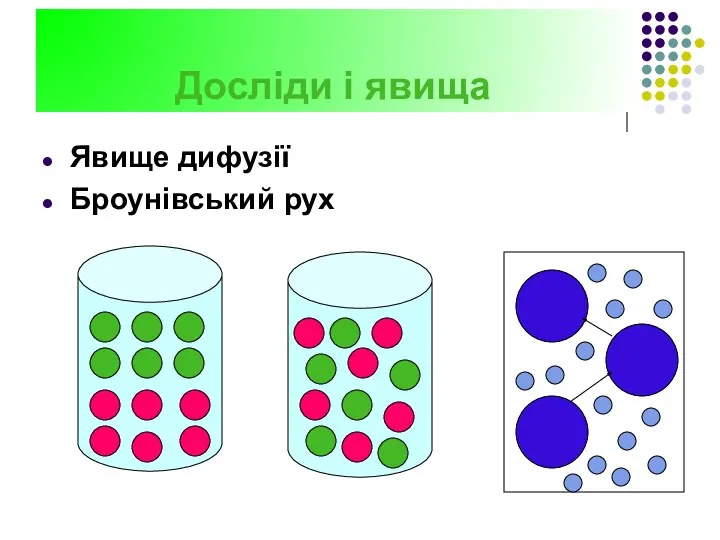
- 16. Досліди і явища Явище дифузії Броунівський рух
- 17. Дослід 2 Дифузія - проникнення молекул однієї речовини у другу в наслідку хаотичного руху молекул. Дифузія
- 18. Броунівський рух - хаотичний рух найдрібніших частинок речовини, під впливом неврівноважених співударів молекул рідин або газів.
- 19. 3. Між молекулами (атомами) існують сили взаємодії… Між молекулами діють сили взаємного притягання та відштовхування.
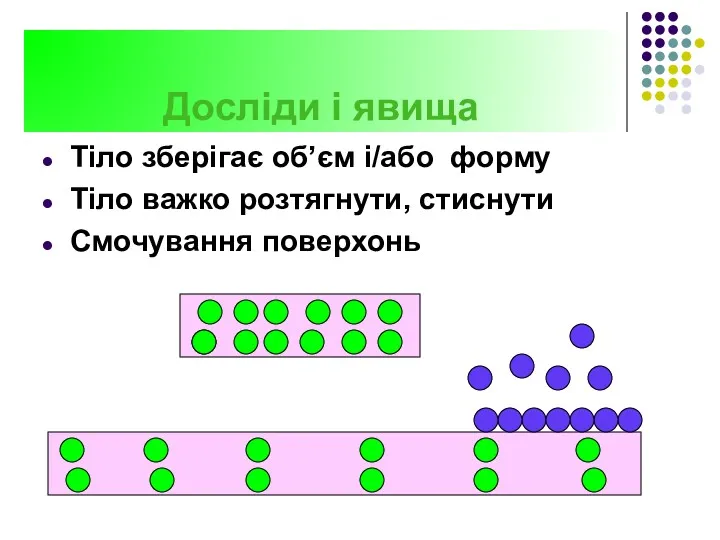
- 20. Досліди і явища Тіло зберігає об’єм і/або форму Тіло важко розтягнути, стиснути Смочування поверхонь
- 21. Дослід 3
- 22. Які розміри молекул? Якщо молекула тоді наш кулак
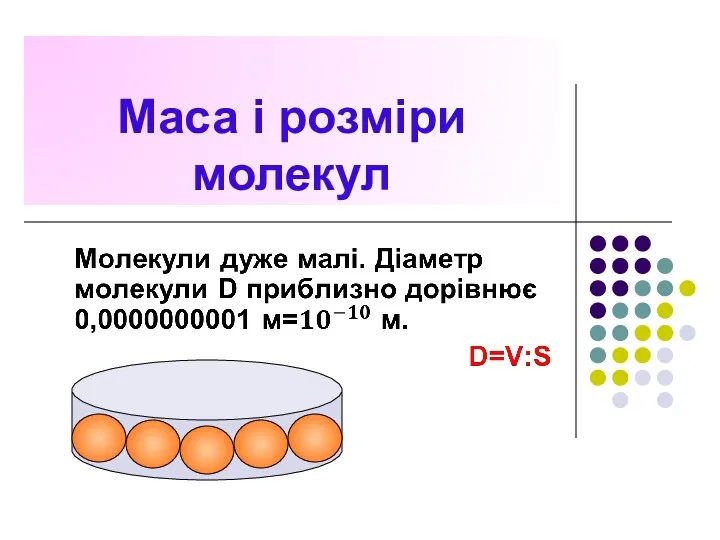
- 23. Маса і розміри молекул S
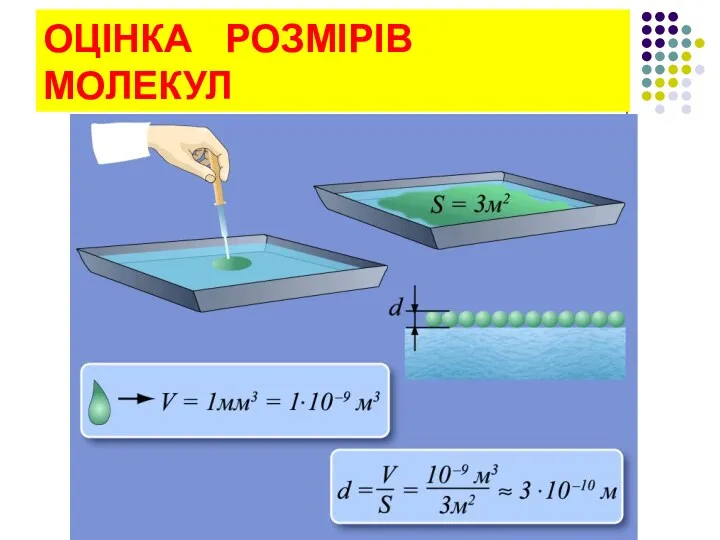
- 24. ОЦІНКА РОЗМІРІВ МОЛЕКУЛ
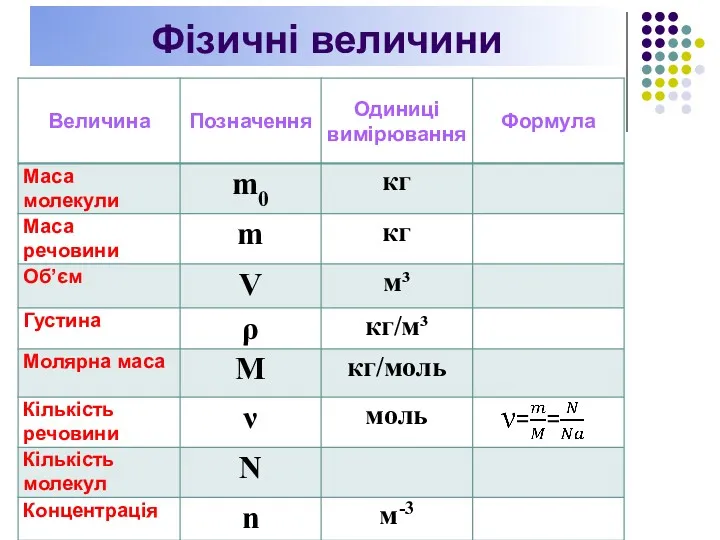
- 26. Фізичні величин
- 27. Фізичні величини
- 28. Ідеальний газ - теоретична модель газу, в якій нехтують розмірами і взаємодією часток газу, а враховують
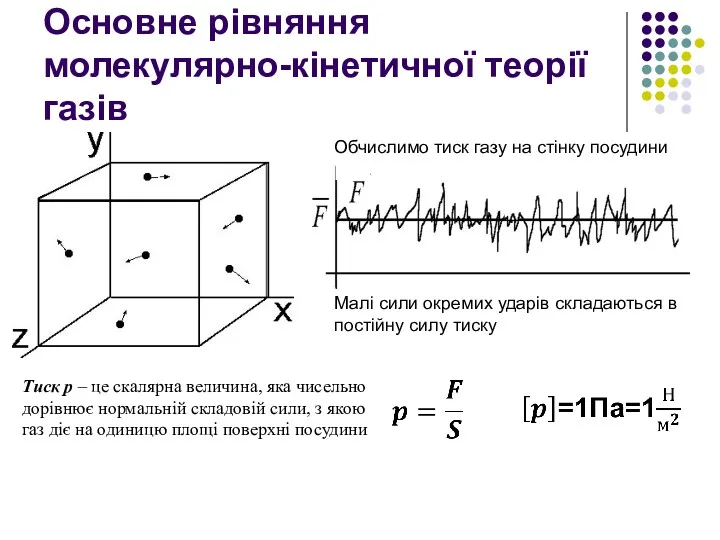
- 29. Основне рівняння молекулярно-кінетичної теорії газів Обчислимо тиск газу на стінку посудини Малі сили окремих ударів складаються
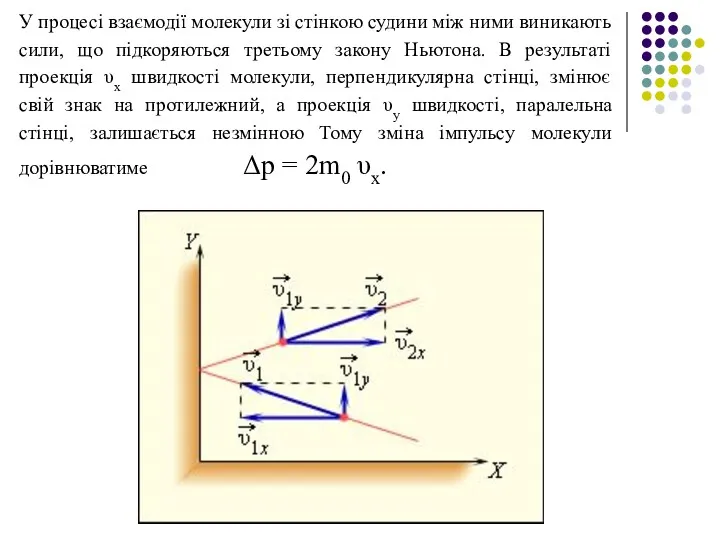
- 30. У процесі взаємодії молекули зі стінкою судини між ними виникають сили, що підкоряються третьому закону Ньютона.
- 31. Повна зміна імпульсу всіх молекул, що зіткнулися за час Δt з майданчиком S, дорівнює Розділивши обидві
- 33. Гра «Доміно»
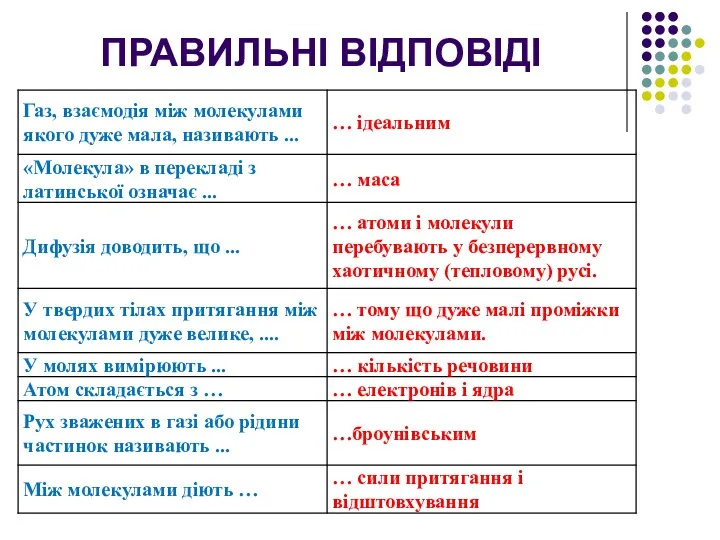
- 34. ПРАВИЛЬНІ ВІДПОВІДІ
- 36. Скачать презентацию























 Насоси. Загальна характеристика насосів
Насоси. Загальна характеристика насосів История паровых двигателей
История паровых двигателей Игра Строение атома
Игра Строение атома Гидрогазодинамика. Основные понятия механики жидкостей и газов
Гидрогазодинамика. Основные понятия механики жидкостей и газов Сила Лоренца
Сила Лоренца Основы теории напряженного состояния. Понятия главных площадок и главных напряжений. Лекция 9
Основы теории напряженного состояния. Понятия главных площадок и главных напряжений. Лекция 9 Принцип работы и техническая характеристика дыхательного аппарата на сжатом воздухе. Тема 3.1
Принцип работы и техническая характеристика дыхательного аппарата на сжатом воздухе. Тема 3.1 Расчет установившихся режимов простейших электрических сетей. (Глава 6)
Расчет установившихся режимов простейших электрических сетей. (Глава 6) Ядерный магнитный резонанс
Ядерный магнитный резонанс Знакомство с бытовой швейной машиной
Знакомство с бытовой швейной машиной Методы расчета статически определимых систем на постоянную нагрузку
Методы расчета статически определимых систем на постоянную нагрузку Гук заңы
Гук заңы Внеклассное мероприятие К вершинам физики
Внеклассное мероприятие К вершинам физики Дифузія навколо нас
Дифузія навколо нас Распределители с закрытым центром. Описание функционирования
Распределители с закрытым центром. Описание функционирования Нерівноважна термодинаміка та хімічна кінетика. Лекція 1
Нерівноважна термодинаміка та хімічна кінетика. Лекція 1 Распространяющиеся в пространстве возмущения электромагнитного поля
Распространяющиеся в пространстве возмущения электромагнитного поля Трактори та мінітрактори, які використовуються у лісовому господарстві. Лекція 1. Частина 2
Трактори та мінітрактори, які використовуються у лісовому господарстві. Лекція 1. Частина 2 Источники звука и звуковые колебания
Источники звука и звуковые колебания Бойове застосування КЗА 86Ж6. Система електроживлення, вентиляції, кондиціювання. Технологічне обладнання 86Ж6. (Тема 9.4)
Бойове застосування КЗА 86Ж6. Система електроживлення, вентиляції, кондиціювання. Технологічне обладнання 86Ж6. (Тема 9.4) Презентация к уроку-сказке по теме Механическое движение в 7 классе коррекционной школы.
Презентация к уроку-сказке по теме Механическое движение в 7 классе коррекционной школы. Дополнительный материал по физике для 8 класса.
Дополнительный материал по физике для 8 класса. Закон всемирного тяготения
Закон всемирного тяготения Частотный метод синтеза корректирующего звена по ЛАЧХ разомкнутой системы
Частотный метод синтеза корректирующего звена по ЛАЧХ разомкнутой системы Радио
Радио Растяжение и сжатие
Растяжение и сжатие Мощность. Единицы измерения мощности. 7 класс
Мощность. Единицы измерения мощности. 7 класс Уравнения Максвелла
Уравнения Максвелла