Содержание
- 2. Химические процессы, которые сопровождаются возникновением электрического тока или протекают под действием электрического тока, называются электрохимическими процессами.
- 3. Гальванические элементы Гальванический элемент - это устройство для преобразования химической энергии окислительно-восстановительной реакции в электрическую.
- 4. При окислительно-восстановительных реакциях (ОВР) происходит переход электронов от восстановителя к окислителю. Если осуществить ОВР так, что
- 5. Электрохимические процессы, в которых химическая энергия превращается в электрическую, протекают в химических источниках электрической энергии (гальванический
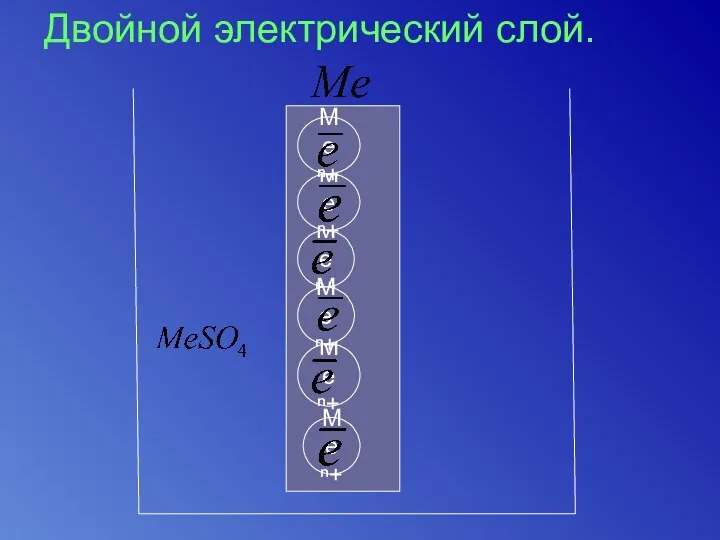
- 6. Двойной электрический слой. Ме ⁿ+ Ме ⁿ+ Ме ⁿ+ Ме ⁿ+ Ме ⁿ+ Ме ⁿ+
- 7. На границе металла – раствор возникает двойной электрический слой. Разность потенциалов на границе металла – раствор
- 8. Данный процесс является обратимым. Потенциал, устанавливающий в условиях равновесия реакций окисления и восстановления на электроде, называется
- 9. На величину электродного потенциала влияют: 1. природа металла; 2. концентрация катионов, в растворе электролита; 3. температура.
- 10. Количественно эта зависимость выражается уравнением Нернста: e = e0 + RT/nF Ln [Men+] где е –
- 11. n – число электронов, принимающих участие в процессе (заряд иона); F – постоянная Фарадея, 96,500 Кл/моль.
- 12. Стандартный электродный потенциал – потенциал данного электрнода при концентрации ионов в растворе 1,0 моль/л и температуре
- 13. Если расположить металлы в ряд в порядке возрастания потенциалов, то получим ряд стандартных электродных потенциалов: К/К+
- 14. При работе гальванического элемента имеет место: движение электронов по внешней цепи – электронная проводимость; движение ионов
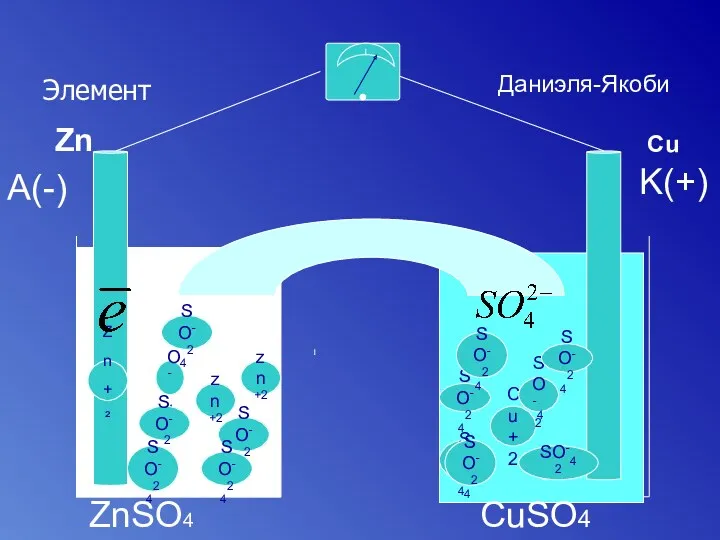
- 15. Элемент Zn+² zn+2 Cu+2 so zn+2 SO-42 SO-42 SO-42 SO-42 SO-42 SO-42 SO-42 SO-42 Даниэля-Якоби Cu
- 16. Гальванический элемент записывают в виде электрохимической схемы. Схемы элемента Якоби-Даниэля A (-) Zn | ZnSO4||CuSO4| Cu
- 17. Максимальное напряжение, которое дает элемент (электродвижущую силу) рассчитывают Э.Д.С. = eкатода - eанода Э.Д.С. элемента Якоби
- 18. Концентрационные гальванические элементы
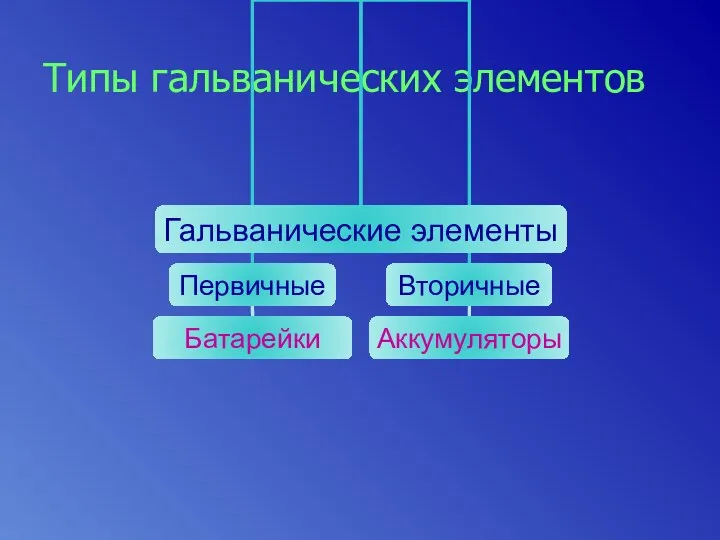
- 19. Типы гальванических элементов
- 20. Применение щелочных аккумуляторов в автокарах
- 21. Применение аккумуляторов Щелочные аккумуляторы используются в автокарах, в автопогрузчиках. Кислотные аккумуляторы – в автопромышленности.
- 22. Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор
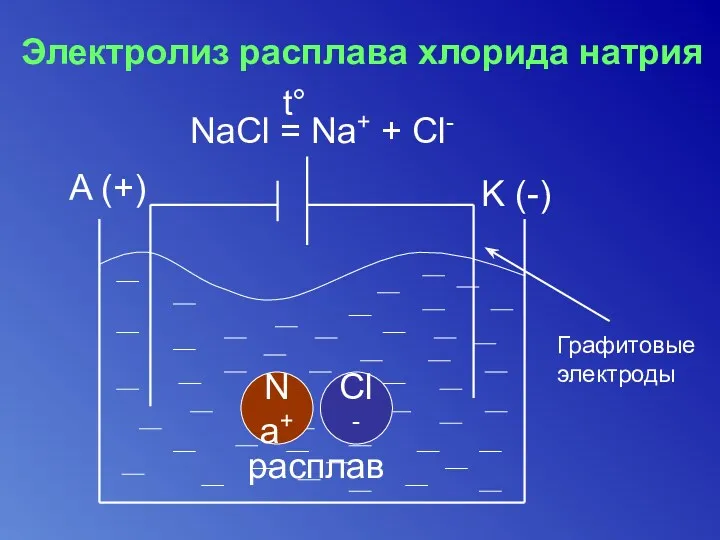
- 23. Электролиз расплава хлорида натрия NaCl = Na+ + Cl- t° A (+) K (-) Cl- Na+
- 24. Катод Анод К 2| Na+ + e- = Na A 1| 2Cl- - 2e- = Cl2
- 25. Электролиз водных растворов электролитов Восстановление и окисление воды при этом может идти по уравнению: на катоде
- 26. Последовательность восстановления ионoв из водных растворов на катоде зависит от величины электродного потенциала восстановления катионов электролита
- 27. Из реакций Меm+ + me- = Me 2Н2О + 2е = Н2 + 2ОН- е =
- 28. 2. Ионы металлических элементов, электродный потенциал которых меньше -0,41 (В). В первую очередь восстанавливаются ионы водорода
- 29. Для ионов металлических элементов электродный потенциал которых от -1,18 (В) до -0,41 (В) (от AL3+ до
- 30. Последовательность окисления ионов из водных растворов на аноде зависит от величины электродного потенциала окисления анионов электролита,
- 31. Аноды подразделяются на инертные (нерастворимые), изготовляемые из угля, кокса, графита или платины, и растворимые, изготовляемые, как
- 32. На инертном аноде возможно окисление анионов электролита или окисление воды. Анионы бескислородных кислот /S2-, Сl-, Вг-,
- 33. В первую очередь окисляются ионы йода /J-/ с выделением молекулярного йода /J2/ 2J- - 2е- =
- 34. Например, из возможных процессов: 2Н2О - 4е = О2 + 4Н+ е0 = +1.23 (В) 2SO42-
- 35. Например, при электролизе водного раствора сульфата меди с медным анодом возможны процессы: Сu - 2е- =
- 36. Примеры электролиза водных растворов с инертным анодом. Пример 1. NaJ = Na+ + J- Н2О Н+
- 37. Электродный потенциал восстановления ионов Н+ из воды e2H+/H2 = -0,41 (В). Поэтому в первую очередь на
- 38. Катод 1| 2H2O + 2e- = H2 + 2OH- Анод 1| 2J- - 2e- = J2
- 39. Катод 2| 2H2O + 2e- = H2 + 2OH- Анод 1| 2H2O - 4e- = O2
- 40. Примеры электролиза водных растворов с активным анодом. CuSO4 = Cu+ + SO-24 Н2О Н+ + ОН-
- 41. Применение электролиза. Электролиз с активным анодом используют для очистки (рафинирования) металлов (меди, золота, серебра, свинца, олова
- 42. (примесей), то примеси остаются в растворе. Электролиз используется для нанесения металлических покрытий на металлы (гальваностегия), а
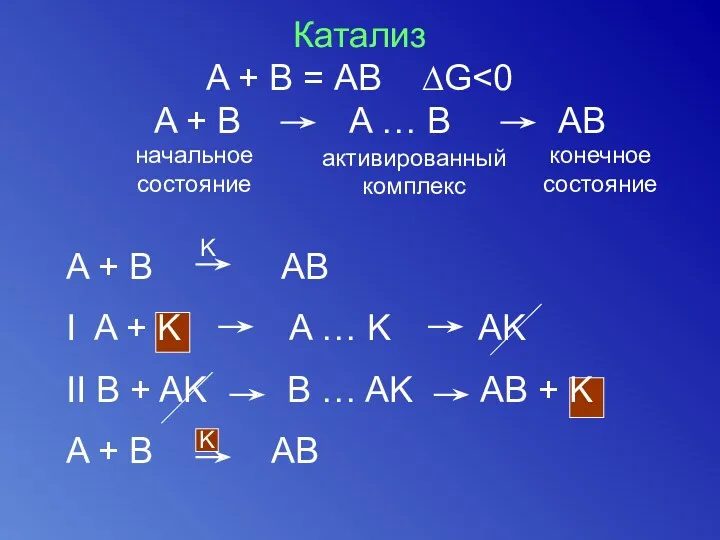
- 43. Катализ A + В = АВ ∆G A + B A … B AB начальное состояние
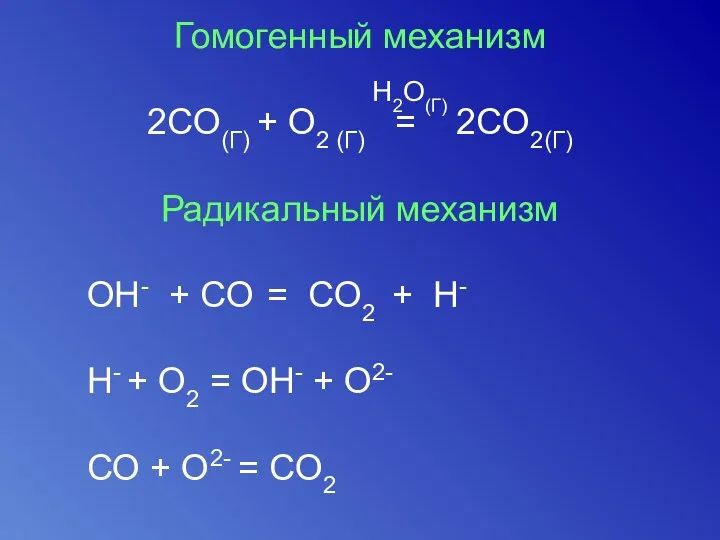
- 44. Гомогенный механизм 2СO(Г) + О2 (Г) = 2СO2(Г) Радикальный механизм OH- + CO = CO2 +
- 45. Молекулярный механизм 2SO2(Г)+ О2 (Г) = 2SO3(Г) – гомоген. I NO + 1/2 + O2 =
- 46. Гетерогенный 2SO2(Г)+ О2 (Г) = 2SO3(Г) 5 стадий 1. транспорт вещества к поверхности катализатора 2. адсорбция
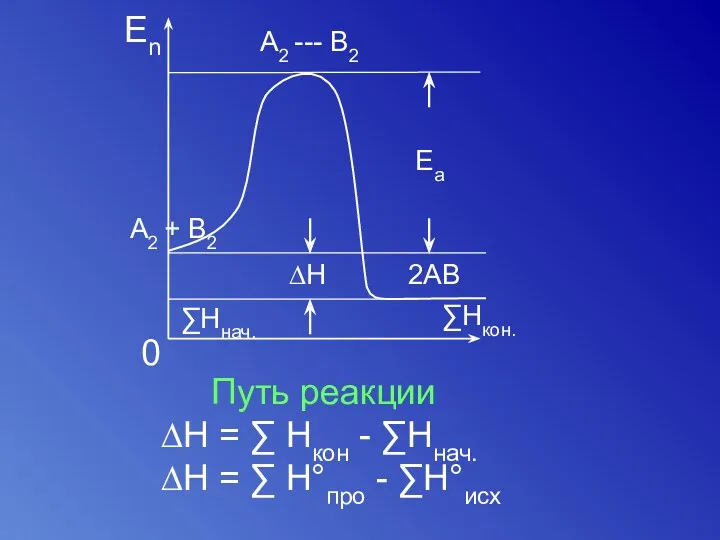
- 47. Путь реакции [начальное] [переходное] [конечное] активированный комплекс A2 + B2 = 2AB ∆G A – A
- 48. Путь реакции ∆H = ∑ Hкон - ∑Hнач. ∆H = ∑ H°про - ∑H°исх
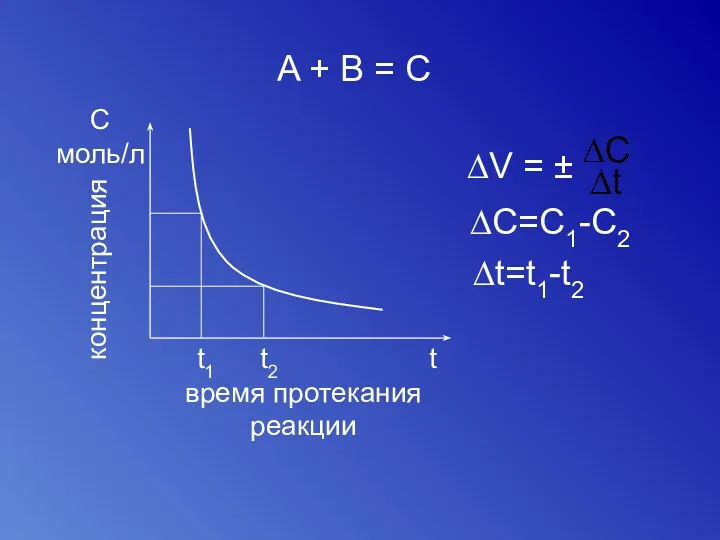
- 49. A + В = С С моль/л t t1 t2 концентрация время протекания реакции ∆V =
- 50. Уравнение связывающие константу скорости с энергией активации и энтропией активации
- 52. Скачать презентацию







































![Путь реакции [начальное] [переходное] [конечное] активированный комплекс A2 + B2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/330963/slide-46.jpg)

 Шудың адам денсаулығына әсері
Шудың адам денсаулығына әсері Дисперсия света
Дисперсия света Масс-спектрометрия и хромато-масс-спектрометрия высокого разрешения
Масс-спектрометрия и хромато-масс-спектрометрия высокого разрешения ВКР: Границы использования аналитических моделей в диссипативной среде с усредненными параметрами биологической ткани
ВКР: Границы использования аналитических моделей в диссипативной среде с усредненными параметрами биологической ткани Плюсы и минусы сотовых телефонов
Плюсы и минусы сотовых телефонов Второй закон термодинамики. Обратимые и необратимые процессы. Энтропия
Второй закон термодинамики. Обратимые и необратимые процессы. Энтропия Сила трения
Сила трения Многосигнальная селективность магистральных радиоприемных устройств в декаметровом диапазоне волн
Многосигнальная селективность магистральных радиоприемных устройств в декаметровом диапазоне волн Оптическая система. Лучевая и волновая оптика
Оптическая система. Лучевая и волновая оптика Історія рекордів швидкості на човнах. (Тип проекту – повідомлення)
Історія рекордів швидкості на човнах. (Тип проекту – повідомлення) Содержание курса физики основной школы наше время
Содержание курса физики основной школы наше время Разработка конструкции и моделирование узла усилителя мощности звуковой часоты
Разработка конструкции и моделирование узла усилителя мощности звуковой часоты Закон электромагнитной индукции
Закон электромагнитной индукции Ремонт автомобилей. Ремонт автомобильных шин. (Тема 4.12)
Ремонт автомобилей. Ремонт автомобильных шин. (Тема 4.12) Закон Джоуля - Ленца
Закон Джоуля - Ленца Тепловые двигатели
Тепловые двигатели Атомная энергетика и её экологические проблемы
Атомная энергетика и её экологические проблемы Обмотка статора машины переменного тока
Обмотка статора машины переменного тока Альфа-, бета-, гамма-распад атомного ядра
Альфа-, бета-, гамма-распад атомного ядра Обслуживание топливной аппаратуры грузовых автомобилей
Обслуживание топливной аппаратуры грузовых автомобилей Вес тела. Перегрузка и невесомость
Вес тела. Перегрузка и невесомость Организация технического обслуживания и ремонта автомобиля КамАЗ 6460
Организация технического обслуживания и ремонта автомобиля КамАЗ 6460 ПРЕЗЕНТАЦИЯ К УРОКУ-ИССЛЕДОВАНИЮ ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ
ПРЕЗЕНТАЦИЯ К УРОКУ-ИССЛЕДОВАНИЮ ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ Животная пирамида (иерархия доминирования). Эфирная традиция. Непрерывный эфир
Животная пирамида (иерархия доминирования). Эфирная традиция. Непрерывный эфир Электростатика. (Лекция 12)
Электростатика. (Лекция 12) Гидравлический привод сцепления автомобиля Камаз
Гидравлический привод сцепления автомобиля Камаз Работа и мощность электрического тока. Единицы работы электрического тока
Работа и мощность электрического тока. Единицы работы электрического тока Презентация по теме Закон всемирного тяготения
Презентация по теме Закон всемирного тяготения